2019-2021 年江西省药品监督抽检不合格情况分析
2022-11-09袁惠董文南周雷罡徐菲左丽平杨毅生
袁惠,董文南,周雷罡,徐菲,左丽平,杨毅生
江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029
药品质量和安全直接关系人民群众的身体健康和生命安全,药品监管责任重于泰山。抽查检验是国家对上市后药品监管的重要手段,各级药品监督管理部门负责本辖区内药品监督抽检工作。本文对江西省药品监督管理局(以下简称江西省药监局)网站2019 至2021 年度公布的所有江西省药品监督信息公告[1]进行了梳理和统计分析,重点分析讨论2019 至2021 年公告的530 批不合格药品情况,为药品监管部门以问题为导向的监管提供参考依据。
1 资料与方法
1.1 资料来源
收集江西省药监局网站首页“政务公开”“政务通告”“监督抽检”项下公布的2019 至2021 年度所有江西省药品监督抽检信息公告,分析江西市场药品抽样不合格情况,以发现问题为导向,找准监管重点方向,保障用药安全。
1.2 研究方法
统计分析2019 至2021 年不合格数据,包括年度数据分析,品种类型、样品来源、不合格项目。对各个数据的主要问题进行重点分析,部分重点问题附图表进行解析。
2 结果
2.1 监督抽检不合格情况
2019 至2021 年公布的不合格药品批数分别为374 批、74 批、82 批,共530 批。其中公告备注“涉嫌假冒”“标示生产企业否认生产”的样品批数分别为5 批、1 批、6 批,发现问题率分别为1.3%、1.4%、7.3%,如图1 所示。
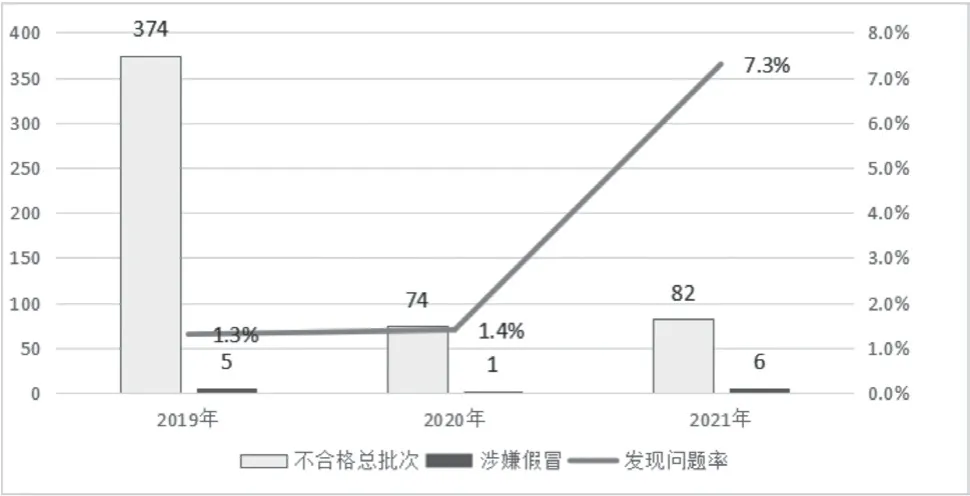
图1 2019至2021年公布不合格药品总数及涉嫌假冒问题比较
2.2 不合格品种类型情况
530 批次不合格药品涉及6 个品种细类,包括原辅料2 批(0.4%)、药包材4 批(0.8%)、抗生素12 批(2.3%)、化学药64 批(12.1%)、中成药140 批(26.4%)、中药材及饮片308 批(58.1%)。
2.3 不合格药品来源情况
对530 批不合格药品抽样环节进行分析,发现来源于生产环节的有39 批,来源于经营环节的有260 批次,来源于使用环节的有229 批次,还有2批来源于其他环节。详情如表1 所示。
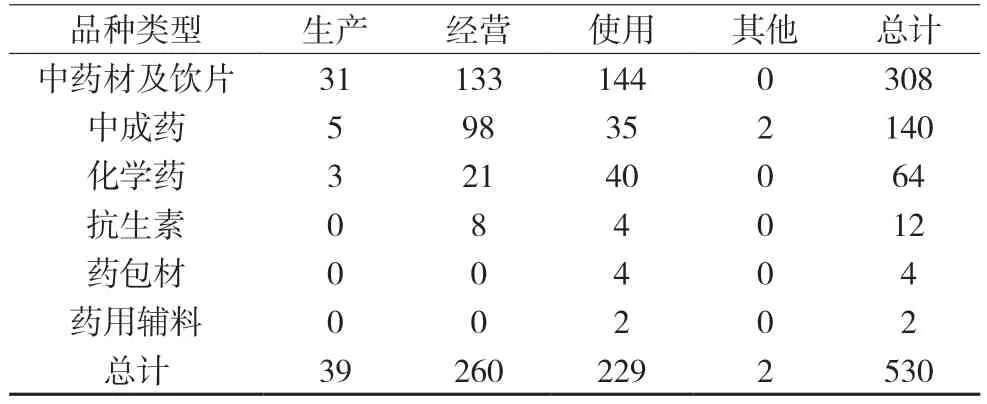
表1 530批不合格药品样品来源情况 批
2.4 不合格项目情况
530 批不合格药品涉及30 个不合格项目,占比最高的是性状(25.1%,179/713),其次为含量测定(11.9%,85/713),鉴别(11.2%,80/713),灰分(10.9%,78/713)等。具体情况如表2 所示。
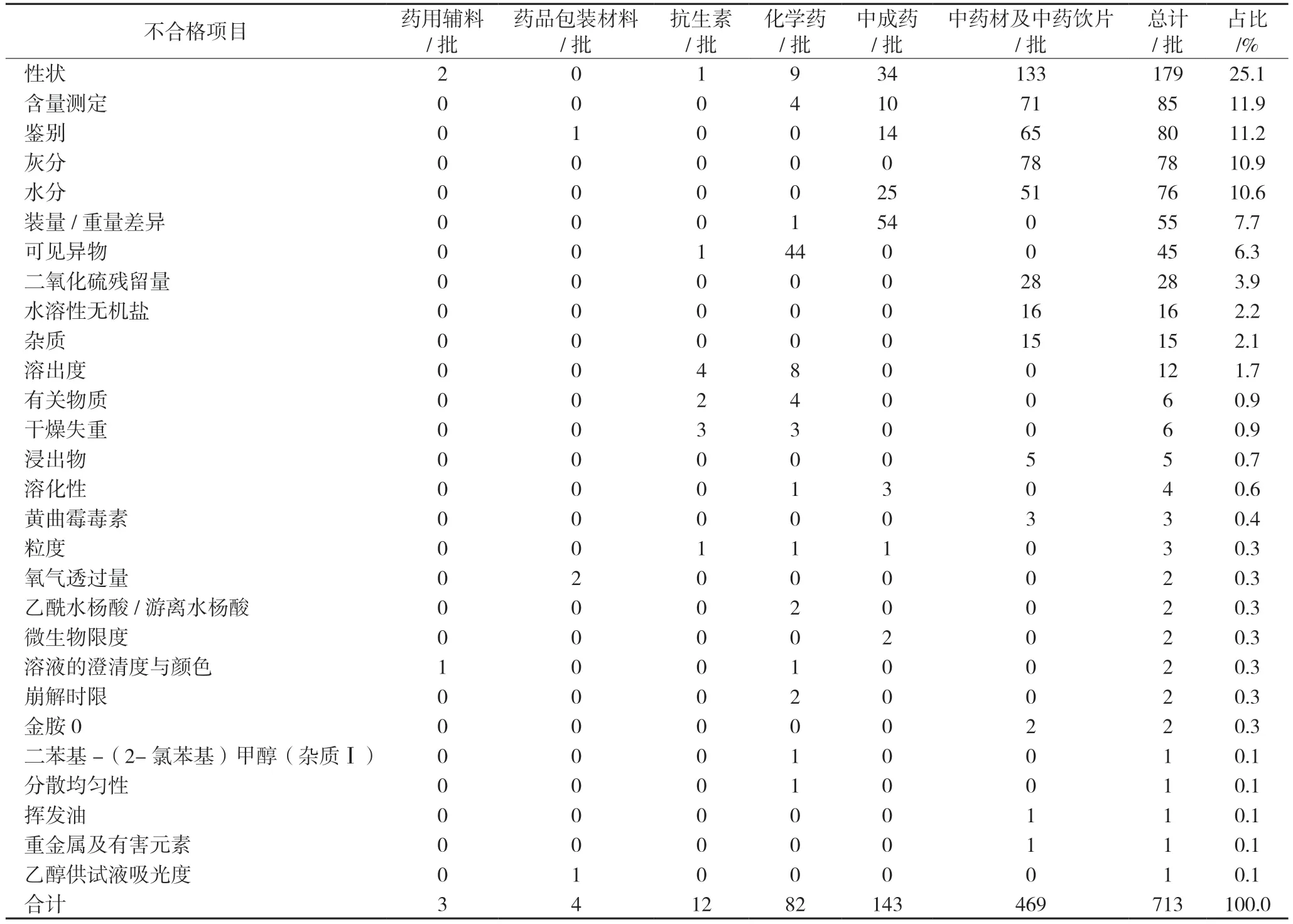
表2 530批不合格药品不合格项目
3 讨论
3.1 监督抽检总体情况讨论
2019 至2021 年数据显示不合格批数呈明显下降趋势,但公告信息备注“涉嫌假冒”“生产企业否认生产”的发现问题率有所上升。这表明《药品管理法》(2019 年版)等各相关法律的修订及颁布实施对药品从业主体提出更高的要求,促进了行业整体提升,提高了药品质量,保障了药品安全。各级监管部门坚持落实党中央有关药品安全“四个最严”要求,坚持“以问题为导向”[2]的监管思路,提高了药品监督抽检的靶向性,净化了药品市场。
3.2 不合格品种类型讨论
530 批不合格药品中中药材及饮片不合格批数高达308 批,中成药不合格批数达140 批。中药材及饮片质量参差不齐,不合格率高的主要原因可能有:掺伪掺杂问题,如金银花可能掺伪掺杂山银花;多基原问题,如各地方标准中黑蚂蚁来源各不同;染色问题,如蒲黄中检出金胺O;外源性有毒有害物质残留问题,如中药材种植过程环境污染或储存不当等产生的有害物质[3]。中成药不合格率高的原因除受其原料中药材及饮片质量影响之外,还可能与其生产工艺、辅料质量、包装材料等因素有关[4-5]。化学药不合格批数仅64 批,可能与近年来我国大力开展仿制药一致性评价,着力提升化学药品质量有关。
3.3 不合格样品来源讨论
来源于经营环节的不合格批数有260 批,占比高达49.1%,此环节质量控制链条较长,涉及采购、收货验收、储存养护、销售、出库复核和运输等环节,各经营单位应合理设置工作岗位、配置专业技术人员、完善质量管理体系文件和配备合适的经营场所等硬件设施[6]。不合格数据公告中,12 批数备注“涉嫌假冒”“标示生产企业否认生产”,表明经营单位在药品采购、验收等环节出现质量风险,其应严格按照《药品经营监督管理办法》《药品经营质量管理规范》、质量管理体系文件等依法依规保障其所销售药品质量。使用环节不合格药品有229 批,占比43.2%,仅次于经营环节。使用环节是指各级医疗单位,是药品到达普通百姓手中的最后环节,该环节药品质量直接关乎用药安全,不容忽视。不合格药品信息公告中,1 批备注“虫蛀,非生产企业造成”,表明医疗机构除规范药品采购验收行为,还应加强储存与养护,建立配套的质量管理制度,加强人员培训,重视药品质量在医疗行为中的重要作用[8]。生产环节不合格药品批数相对较少,为39 批。《药品管理法》(2019 年版)和《药品生产监督管理办法》(国家市场监督管理总局令第28 号)均强调生产事中监管,坚持风险管理、全程管控的原则,落实药品生产企业的主体责任,派驻专业检查员进行现场检查及指导,有效地降低了生产环节的不合格率[8]。
3.4 不合格项目讨论
不合格项目主要为性状(178 批),其次为含量测定(85 批)、鉴别(80 批)、灰分(78 批)、水分(76批)、装量/重量差异(55 批)等。其中中药材及饮片的性状、含量测定、鉴别不合格的主要原因都可能与掺伪掺杂有关,如沉香掺伪松香;灰分可能因药材未洗净掺入泥沙而导致该项目不合格,如沪地龙中掺入无机杂质泥沙;水分不合格可能与其储存养护不当有关,如2021 年全国抽检工作中发现有的五味子、党参等饮片水分超标[3]。中成药不合格项目数最多的是装量/重量差异,而这会影响药物的有效成分含量分布不均,影响疗效。中成药处方均较复杂,含有多味药材和辅料,在生产过程中粉体的均匀性、流动性、压缩性、黏性和引湿性等因素都可影响分剂量的准确而导致装量差异和重量差异不合格[9]。可见异物是化学药的主要不合格项目,主要是因为不合格化学药全部为注射剂,而如果在注射剂研发生产阶段对可见异物成因、质控限度、稳定性考察等因素考虑不到位,则会导致化学药注射剂的主要不合格项目就是可见异物[10-11]。
4 建议
药品从业主体应加强配套设施建设,加强人员培训,增强法律意识,勇担药品质量责任人的重担,从源头保障药品质量安全可靠。各级检验机构及技术部门应致力完善药品质量标准,建立补充检验方法,提升检验能力,做好服务监管、服务产业、服务公众的技术支撑。监管部门持续加强高素质专职检查队伍建设,加大对重点品种、关键环节的监管力度,创新监管思路,维护药品市场安全可靠。
