模拟高原低氧环境下运动疲劳大鼠脑皮层单羧酸转运蛋白的变化及其意义
2022-11-07凡春玲李玉荣裴文娟关彩萍
高 晨,凡春玲,李玉荣,裴文娟,关彩萍
(联勤保障部队第九四〇医院全科医学科,兰州 730050)
运动性疲劳是指运动引起的肌肉最大收缩或最大输出功率暂时性下降的生理现象,机体生理过程不能维持其机能在特定水平上进行和(或)不能维持预定的运动强度。它是运动本身引起机体工作能力暂时降低,经过适当时间的休息和调整可以恢复正常的生理现象,是一个极其复杂的身体综合反应过程[1-3]。疲劳的发生是外周肌肉和中枢神经共同作用的结果。后者是由运动引起的中枢神经系统不能产生和维持足够的冲动到运动所需的肌肉而引起[4],其机制是脑能量代谢失衡,即与运动缺氧致脑电活动减弱,反馈性抑制中枢神经系统和脊髓前角α运动神经元活动有关[5-7]。
剧烈运动及低氧环境下,机体通过糖原等碳水化合物的无氧糖酵解来维持能量代谢的平衡,乳酸是这一过程的代谢产物。急进高原后机体运动能力迅速下降,与高原低氧环境下机体乳酸堆积加速导致体内pH值变化有关[8]。由此引起的一系列病理反应损伤神经元[9-10]。但长期高原生活出现高原习服现象,抗疲劳能力等机体生理功能在一定程度上有所恢复。近年来,相关研究已证明乳酸在特定情况可作为能量代谢的来源[11]。“中枢乳酸穿梭”假说(astrocyte-neuron lactate shuttle hypothesis)[12-14]表明极量运动或缺氧状态下,胶质细胞无氧代谢所产生的乳酸被神经元摄取作为能量底物为其供能,且乳酸优先于葡萄糖被神经元利用氧化供能。据此推测,高原习服的产生与机体乳酸代谢及利用有关。机体乳酸代谢转运的载体是广泛分布于组织细胞膜上的具有14种亚型的单羧酸转运蛋白(monocarboxylate transporters,MCTs)[15]。中枢乳酸穿梭主要依靠神经元表达的MCT2和星形胶质细胞表达的MCT4形成的闭合环路实现[16]。本研究通过模拟高原低氧环境下大鼠乳酸代谢的干预,记录其运动能力变化。进一步测定鼠脑皮层MCT2和MCT4的表达,缺氧神经元损伤情况以及脑组织乳酸含量,探讨高原低氧环境运动疲劳与脑乳酸代谢转运之间的相关性,为运动疲劳的医学干预奠定理论基础。
1 材料与方法
1.1 实验动物及分组
8周龄清洁级雄性SD大鼠63只,体质量(280±10)g,由联勤保障部队第九四〇医院动物实验科提供[SCXK(军)2017-0023],分笼饲养于屏障设施内[SYXK(军)2017-0047]。正常饮水、饮食。环境温度维持在18~24℃,相对湿度40%~60%。大鼠随机分为7组,每组9只:对照组在常压常氧环境下正常饲养,不建立运动疲劳模型;常规运动组在常压常氧环境下正常饲养2周后建立运动疲劳模型;急进高原组在常压常氧环境下饲养2周后迅速转至模拟低压低氧环境后建立运动疲劳模型;高原习服3 d组在常压常氧环境下饲养11 d后转至模拟低压低氧环境,再饲养3 d后建立运动疲劳模型;高原习服1周组先后在常压常氧环境和模拟低压低氧环境下各饲养1周后建立运动疲劳模型;高原习服2周组在模拟低压低氧环境饲养2周后建立运动疲劳模型;高原抑制剂组在模拟低压低氧环境饲养2周,给予乳酸转运抑制剂后再建立运动疲劳模型。动物实验经联勤保障部队第九四〇医院伦理委员会书面同意(编号2020KYLL032)。
1.2 实验设备及试剂
FLYDWC50-ⅡA型低压低氧动物实验舱(中航工业贵州风雷航空军械有限责任公司)。ZH-PT型动物跑台(安徽淮北正华生物仪器设备有限公司)。SpectraMax i3全自动荧光酶标仪(美国Molecular Devices公司),EG1150H自动包埋机(德国Leica有限公司),AX80荧光显微镜(日本奥林巴斯),ASP-200S自动脱水机,M398419自动切片机。
MCT4抗体(货号:PAB21410)购自中国台湾Abnova公司,MCT2抗体(货号:sc-50323)购自美国Santa Cruz公司。二甲基联苯胺(3,3-diamino-benzidine,DAB)显色试剂盒(货号:AR1002)购自武汉博士德生物工程有限公司。尼氏染色试剂盒(亚甲蓝法,货号:UFJ01207)购自上海君瑞生物技术有限公司。比色法乳酸检测试剂盒(货号:A019-2)购自南京建成生物工程研究所,α-氰基-4-羟基肉桂酸乙酯(α-cyano-4-hydroxycinnamate,4-CIN)购自美国Sigma公司。
1.3 模拟高原低压低氧环境
低压低氧动物实验舱模拟海拔5 000 m低压低氧环境。具体参数如下:压力0.054 MPa,氧分压11.3 kPa,上升速度10 m/s,温度12℃(每日8:00~20:00)及2℃(每日20:00~次日8:00),相对湿度30%~40%。
1.4 建立运动疲劳模型及抑制剂注射
除对照组以外,其余各组大鼠均在建立运动疲劳模型前在动物跑台上进行为期3 d的适应性训练(速度为15 m/min,时间为5 min/d,坡度0°)。之后采用Bedford等的[17]递增负荷运动方案建立运动疲劳模型,速度及持续时间方案:8.2 m/min×15 min+15 m/min×15 min+20 m/min持续,直至力竭。力竭标准:大鼠跑步姿态由蹬地式变为伏地式,滞留跑道后1/3处达3次以上,各种刺激驱赶无效,停跑后表现为呼吸急促、神情倦怠、反应迟钝[18]。抑制剂运动组在建立运动疲劳模型前1 h,按90 mg/kg剂量为每只大鼠腹腔注射乳酸转运抑制剂4-CIN[19]。分别记录各组大鼠负荷运动达到力竭状态的运动时间,取平均值。
1.5 免疫印迹检测[20]
疲劳模型建立后,各组分别取3只大鼠在异氟烷麻醉下断头处死。取运动区皮层组织匀浆后裂解,提取总蛋白,BCA法测定浓度。聚丙烯酰胺凝胶电泳(SDS-PAGE)每孔上样蛋白总量为20 μg,时间120 min。350 mA恒流带电转膜(120 min),5%牛血清白蛋白室温振荡封闭1 h,5%脱脂奶粉稀释后分别加入一抗MCT2抗体(1:1 000)和MCT4抗体(1:500),以α-tubulin抗体(1:1 000)作为内参,4℃孵育过夜。加入辣根过氧化物酶标记的二抗(1:5 000),在室温下振荡孵育2 h。滴加发光检测液,在凝胶成像系统中摄影。应用Image J软件进行灰度量化分析,重复3次实验取平均值。
1.6 鼠脑切片制备
各组再取3只大鼠在异氟烷麻醉下经心脏灌流处死,断头取脑。质量分数4%多聚甲醛溶液固定24 h,蔗糖PB溶液阶梯脱水48 h。包埋后连续冠状位冰冻切片,切片厚度分别为6 μm。切片置于60%甘油磷酸缓冲盐溶液(PBS)中,-20℃冷冻保存待用。
1.7 免疫组织化学检测(DAB染色法)[21]
鼠脑切片用1%牛血清蛋白(BSA)+0.3% Triton X-100在室温下封阻非特异性结合并破膜1 h。PBS清洗。加入1:500的MCT2或1:200的MCT4一抗稀释液,4℃缓慢振荡器孵育过夜。PBS清洗。滴加以生物素标记的二抗(试剂A),在室温下,60 r/min振荡器上,孵育10 min。PBS清洗。滴加链霉素菌抗生素-过氧化物酶复合物(试剂B),室温下,60 r/min振荡器上,孵育10 min。PBS清洗。鼠脑切片转移至载玻片上,滴加新鲜配制的DAB显色液(20倍缓冲液50 μL+20倍底物H2O250 μL+20倍DAB色源50 μL+去离子水850 μL),避光显色,以抗体稀释液取代一抗做空白对照。显色后脱水,中性树胶封片,显微镜明场下观察拍照。
1.8 神经元尼氏染色及病理学评价[22-23]
鼠脑切片常温下复温,晾干。0.01 mol/L PBS漂洗3次,将切片置于60℃水浴中的5%尼氏染液中5~10 min,蒸馏水冲洗。70%乙醇溶液中浸泡2 min,置于95%乙醇溶液中分色,梯度乙醇溶液脱水,二甲苯透明后中性树胶封片,明场镜下观察并拍照。
选择对缺氧损伤较为敏感的鼠脑皮层切片图像,通过组织学分级(histological grade,HG)和平均神经元密度(neuronal density,ND)值进行鼠脑迟发性神经元死亡的病理学评价。HG分为4个等级[24]:0级,无神经元死亡;Ⅰ级,散在单个神经元死亡;Ⅱ级,大量神经元死亡;Ⅲ级,神经元几乎全部死亡。ND值计量方法如下:随机选取运动区皮层6个高倍视野(high power field,HPF,×400),计数250 μm直线上正常存活(细胞膜、细胞核完整,核仁清晰可辨)的锥体神经元数量,取平均值。
1.9 脑组织乳酸含量测定
各组剩余3只大鼠在异氟烷麻醉下断头处死。取脑组织标本准确称取重量,按照重量(g)∶体积(mL)=1∶9加入0.9%NaCl溶液(即生理盐水)后在玻璃匀浆器中匀浆,制成10%脑组织匀浆。3 500 r/min,4℃离心10 min,取上清液装入EP管,采用比色法检测脑组织乳酸含量[25]。严格依照南京建成生物工程研究所试剂盒说明书执行操作。
1.10 统计学方法
本研究数据资料采用SPSS 13.0统计软件包进行分析。计量资料采用平均数±标准差(-x±s)表示。不同组样本均数间比较采用单因素方差分析。根据各组总体方差齐同与否,选择Bonferroni法或Tamhane’s T2法修正结果,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠力竭运动时间变化情况
各组大鼠平均运动力竭时间如表1所示。与常规运动组比较,急进高原组、高原习服3 d、1周组及高原抑制剂组运动能力均明显下降(P<0.05)。高原习服2周组大鼠运动能力明显恢复,与急进高原组和高原抑制剂组比较均有明显统计学差异(P<0.05),与常规运动组比较则差异无统计学意义(P>0.05)。
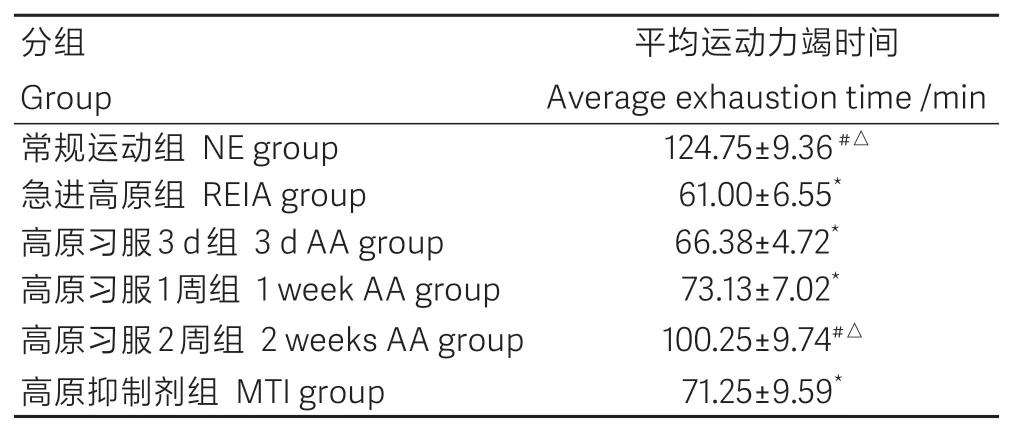
表1 各组运动疲劳模型大鼠平均力竭时间Table1 Average time-to-exhaustion in rats under exercise-induced fatigue conditions(-x±s,n=9)
2.2 大鼠脑运动皮层MCT2及MCT4表达变化
免疫印迹法检测各组大鼠运动皮层MCT2和MCT4表达变化情况如图1所示。对照组大鼠运动皮层MCT2及MCT4均少量正常表达。与对照组比较,常规运动组、急进高原组二者表达变化均无统计学意义(P>0.05)。高原习服后,二者表达水平逐渐升高。其中高原习服1周组,高原习服2周组及高原抑制剂组MCT2表达分别较对照组明显升高约81.5%、120.6%和164.4%,差异均有统计学意义(P<0.05)。MCT4表达升高较MCT2更早。高原习服3 d组、1周组、2周组及高原抑制剂组MCT4表达分别较对照组明显升高约144.3%、176.1%、174.6%和168.8%,差异均有统计学意义(P<0.05)。
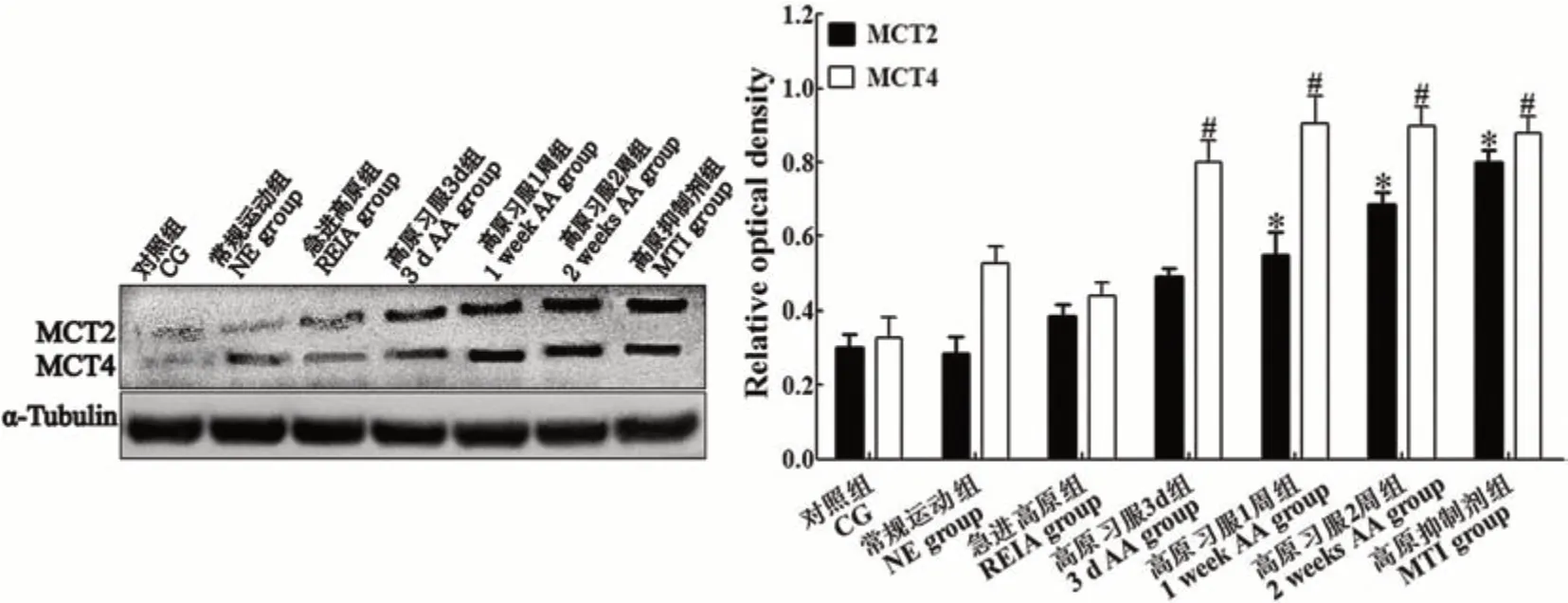
图1 免疫印迹检测各组运动疲劳模型大鼠脑运动皮层中MCT2和MCT4的表达Figure 1 Western blotting analysis of MCT2 and MCT4 expressions in the cerebral motor cortex of rats in each group
采用免疫组织化学DAB染色技术对比检测各组鼠脑运动区皮层神经元上MCT2和星形胶质细胞上MCT4表达情况。如图2所示,与对照组相比,大鼠脑运动皮层神经元上MCT2的表达在高原习服1周后明显升高并维持稳定。与MCT2不同,MCT4表达在星形胶质细胞内,其在高原习服3 d后即开始升高,2周后明显升高并维持稳定。MCT2和MCT4免疫组织化学检测变化趋势与免疫印迹检测结果基本一致,可互相印证。
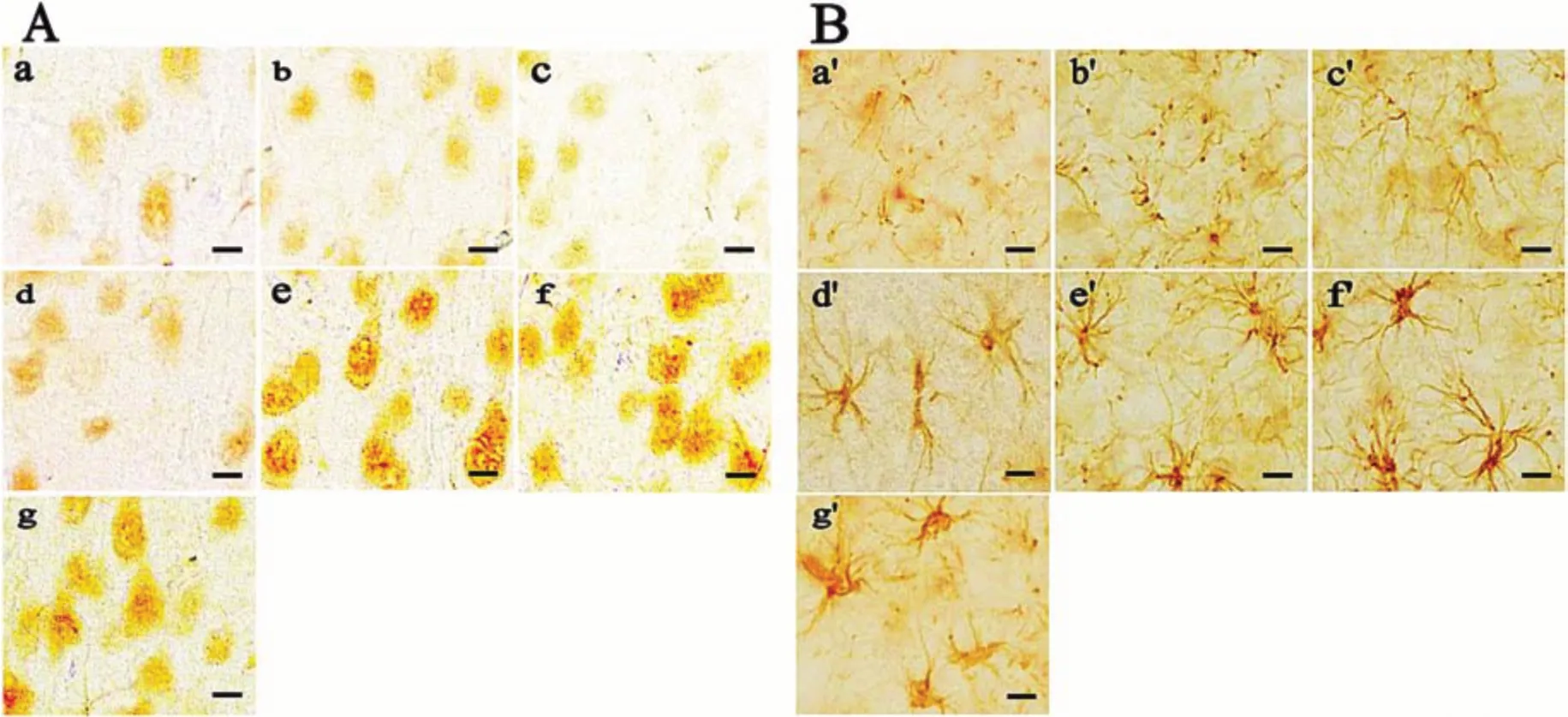
图2 免疫组织化学检测各组运动疲劳模型鼠脑运动皮层中MCT2(A)和MCT4(B)表达(DAB染色法,×400)Figure 2 Immunohistochemical detection of MCT2(A)and MCT4(B)in the cerebral motor cortex of rats in each group(DAB staining,×400)
2.3 大鼠脑迟发性神经元死亡病理学评价情况
通过脑切片尼氏染色进行迟发性神经元病理学评价。各组鼠脑神经元组织学分级及平均ND值如表2所示。与对照组比较,急进高原组、高原习服3 d和1周组及高原抑制剂组的平均ND值均明显降低,差异有统计学意义(P<0.05)。常规运动组和高原习服2周组的平均ND值与对照组无明显差异(P>0.05)。
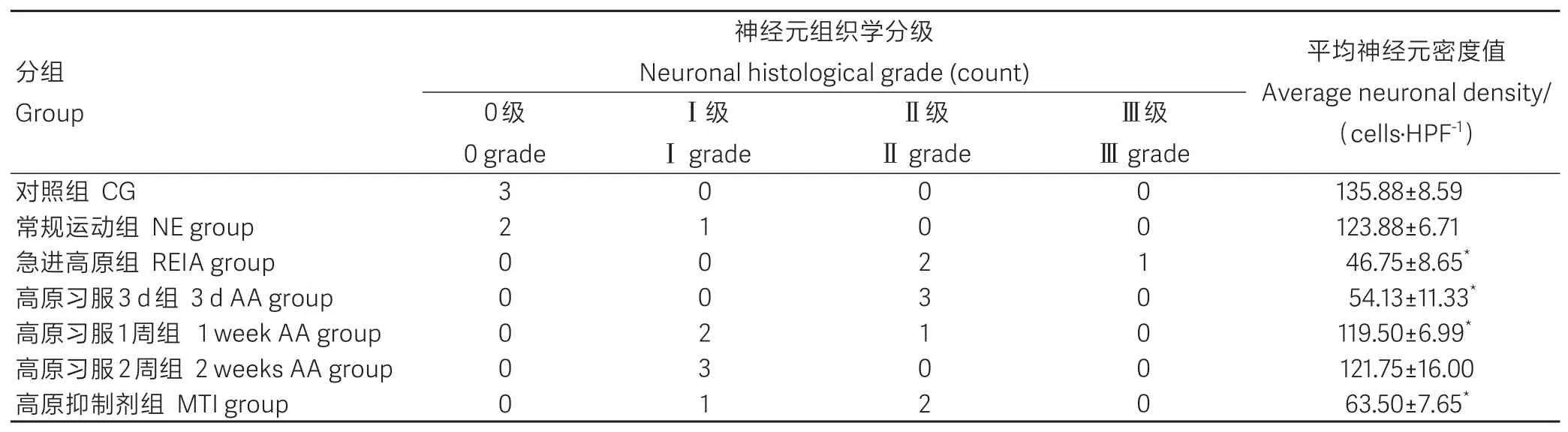
表2 各组运动疲劳模型鼠脑运动皮层神经元组织学分级数量和平均神经元密度值Table 2 Histological grade and average neuronal density in the cerebral motor cortex of rats under exercise-induced fatigue conditions(-x±s,n=3)
图3所示为具有代表性的各组大鼠脑皮层神经元尼氏染色图像。对照组、常规运动组、高原习服1周组及高原习服2周组的神经元排列均较为整齐、均匀,细胞间分界清楚,细胞膜、细胞核完整,核仁清晰,染色质分布均匀。急进高原组、高原习服3 d组及高原抑制剂组的神经元细胞排列稀松紊乱,细胞间分界不清,染色质浓集。特别是急进高原组和高原习服3 d组的细胞骨架及细胞器均有明显破坏,部分凋亡或坏死细胞固缩深染。

图3 各组运动疲劳模型鼠脑运动皮层神经元尼氏染色(×200,局部放大×400)Figure 3 Nissl staining in the cerebral motor cortex of rats under exercise-induced fatigue conditions(×200,local enlarged image×400)
2.4 鼠脑乳酸含量测定情况
各组鼠脑乳酸含量及变化趋势见表3。与常规运动组比较,除对照组外,其余各组鼠脑乳酸含量均明显升高,差异均有统计学意义(P<0.05),且随着模拟高原时间延长呈逐渐上升趋势。与急进高原组比较,高原习服1周后,鼠脑乳酸含量上升趋势明显加快,差异有统计学意义(P<0.05)。高原抑制剂组鼠脑乳酸含量最高,与各组之间差异均有统计学意义(P<0.05)。

表3 各组运动疲劳模型大鼠平均脑组织乳酸含量Table 3 Average brain lactate content in rats under exercise-induced fatigue conditions(-x±s,n=3)
3 讨论
3.1 高原习服与中枢乳酸的关联性
高原低氧环境对机体最显著且持久的影响是运动能力降低。有研究表明,急进4 500 m高原时,人体最大运动能力可降至平原的50%。随着在高原驻留时间延长,机体发生高原习服适应,运动能力逐渐恢复[7,26]。针对高原习服现象的研究是高原运动医学研究的核心内容之一。已有研究表明,中枢乳酸堆积可造成神经元损伤,同时在极量运动及缺氧状态下中枢乳酸亦可被神经元利用而氧化供能[11-12]。细胞间乳酸的转运依赖于MCTs。1974年英国研究人员率先报告了人体红细胞中MCT1及其抑制剂4-CIN。随后的研究陆续发现拥有14种亚型的MCTs分布于不同的组织细胞膜表面,其中MCT1、MCT2和MCT4对运动状态下的乳酸转运至关重要[27]。本课题组前期的研究表明,鼠脑乳酸排出与摄取利用的整个链路均表现出适应运动疲劳的积极变化[28]。据此推测,高原习服现象的产生与中枢乳酸的损伤及氧化供能两个过程取得平衡密切相关。
3.2 乳酸转运抑制与高原习服阻断
在前期研究的基础上,本研究利用乳酸转运抑制剂的干扰因素,针对高原运动能力变化、皮层神经元损伤及脑乳酸代谢之间的关联性进行了深入探讨。4-CIN是一种特异性线粒体乳酸和丙酮酸的共价转运抑制剂[29-32],可以有效抑制MCTs对乳酸的转运功能。MCTs的不同亚型之间对4-CIN的敏感性不尽相同,属竞争性抑制。MCT2对4-CIN抑制效应最为敏感,MCT4的敏感性较差[33-34]。中枢乳酸穿梭假说指出,由胶质细胞释放的乳酸通过MCT4流出细胞外,再经由MCT2转运进入神经元内部作为能量代谢的底物。这一闭合的能量代谢环路中无论是哪一个环节受到有效的竞争性抑制,均可被有效阻断。因此,本课题组将4-CIN引入高原运动疲劳研究中。研究结果表明,急进高原后大鼠平均运动力竭时间明显缩短,随着高原习服时间延长,运动耐力逐渐恢复。鼠脑运动区皮层MCT2和MCT4表达变化与高原习服时间呈正相关,免疫印迹和免疫组织化学检测均显示出相同的可互相印证的变化趋势。4-CIN的应用则迅速阻断了高原习服带来的运动能力的恢复。从4-CIN作为乳酸转运竞争性抑制剂的角度出发,笔者认为上述阻断主要源于能量代谢环路中乳酸经MCT2转运进入神经元被有效抑制。实验结果也表明,4-CIN仅抑制了MCT2和MCT4对乳酸的转运功能,并未影响二者在分子水平的表达。
3.3 运动疲劳状态下脑乳酸的损伤与供能平衡
体外细胞研究表明,在缺氧状态下,神经元-胶质细胞共培养体系中MCT4表达升高,神经元利用胶质细胞产生的乳酸作为能量底物抵抗缺氧性损伤[16]。体内研究表明,由于血脑屏障的存在,脑内胞外乳酸是独立于血乳酸而存在的[10,35]。缺氧及运动状态下,血乳酸的增加对脑乳酸变化影响较小。脑内细胞外乳酸主要来源于星形胶质细胞[35]。脑内乳酸堆积既可导致迟发性神经元损伤[9],也可在特定情况下作为神经元活动的能量底物[13]。本研究特别设定了神经元死亡病理学评价和脑乳酸含量测定对运动疲劳状态下的乳酸损伤和供能机制进行深入研究。结果表明,随着高原习服时间延长,大鼠疲劳负荷运动能力逐渐恢复,鼠脑乳酸含量呈现出逐渐上升的趋势,其神经元损伤与死亡程度亦逐渐减轻。应用乳酸转运抑制剂4-CIN可明显阻断这一恢复过程。综合分析,笔者认为急进高原后,脑乳酸堆积造成了明显的神经元损伤。随着高原习服时间延长,MCTs表达升高,运动疲劳状态下部分神经胶质细胞产生的脑乳酸经过MCTs的转运被神经元利用氧化供能,从而减轻了乳酸堆积造成的神经元损伤,运动能力随之逐渐恢复。4-CIN阻断乳酸转运后,这一保护作用随之消失。
综上所述,笔者认为MCTs可以作为高原低氧环境下运动疲劳医学干预的重要靶点。本研究中4-CIN仅阻断了MCTs的乳酸转运作用,并未影响其分子表达。后续研究中或可引入siRNA干扰及基因沉默等方法,人为调控MCTs表达,将会对这一机制提供更为有力的佐证。另外,体外研究中MCTs和兴奋性氨基酸转运蛋白相互作用参与神经元的迟发性损伤[36],也值得在高原运动医学中深入探究。
[医学伦理声明Medical Ethics Statement]
本研究涉及的所有动物实验均已通过联勤保障部队第九四〇医院实验动物伦理委员会审查批准(No.2020KYLL032)。所有实验过程均遵照中国实验动物相关法律法规条例要求进行。All experimental animal protocols in this study were reviewed and approved by Experimental Animal Ethics Committee of the 940th Hospital of Joint Logistics Support Force of Chinese People's Liberation Army(Approval Letter No.2020KYLL032).All experimental procedures were performed in accordance with the requirements of laws and regulations in China related to experimental animals,includingAnimal Management Regulations(01/03/2017),Laboratory Animal:Guideline for Ethical Review of Animal Welfare(GB/T 35892-2018),and so on.
[作者贡献Author Contribution]
高晨负责实验总体设计、数据统计及课题论文撰写;凡春玲负责高原低氧大鼠运动疲劳模型构建及运动能力检测;李玉荣负责鼠脑皮层蛋白提取及蛋白质印迹检测;裴文娟负责鼠脑切片制备、免疫组织化学检测和尼氏染色;关彩萍负责鼠脑迟发性神经元死亡病理学评价和乳酸测定。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。
