肝脏VX2原位移植瘤术后模型的建立及超声影像学评估
2022-11-07陈凯玲张炜彬毛丽娟曹佳颖王文平
陈凯玲 ,张炜彬,毛丽娟,曹佳颖,韩 红 ,毛 枫,王文平
1.复旦大学附属中山医院超声科,上海 200032;
2.上海市影像医学研究所,上海 200032
原发性肝癌的发病率居恶性肿瘤的第6位,死亡率居癌症相关死亡的第2位,全世界每年约80万人死于肝癌[1]。外科手术是原发性肝癌首选的治疗方案,但约70%的患者术后5年内复发,而复发性肝癌的治疗是临床工作中亟待解决的问题[2]。动物实验对于新型药物和新技术的研发具有重要价值,目前研究中应用的动物模型主要有皮下移植瘤、肝内原位种植瘤及化学诱导的模型,而构建肝癌术后复发模型的研究较少[3]。兔肝VX2原位移植瘤是目前广泛使用的较大动物模型[4]。相较于皮下移植瘤模型,肝VX2原位种植瘤的血供和生长特征与人原发性肝癌相似度更高;而且相较于裸鼠载体,兔可进行肝动脉、门静脉插管,便于经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)相关研究。本研究通过不同方法构建肝VX2原位种植瘤术后模型,以期为肝癌术后复发相关研究提供有效的动物载体。
1 材料与方法
1.1 实验动物
清洁级新西兰大白兔16只(购于复旦大学附属中山医院动物实验中心并饲养于动物房),雌雄不限,体质量2.0~2.4 kg,健康状况良好。VX2瘤株由上海市肿瘤研究所提供。本研究经医院动物实验伦理委员会批准(编号2019-071)。
1.2 肝脏VX2原位移植瘤模型的构建
37 ℃水浴复苏VX2肿瘤组织,生理盐水漂洗后剪成1 mm3瘤块备用,随机取1只实验兔经耳缘静脉按5 mL/kg剂量注射10%水合氯醛(上海酶联生物科技有限公司)麻醉后,用20 G注射器针头将瘤块接种于后腿肌间隙制成种兔。2周后肿瘤长至1~2 cm时空气栓塞法处死种兔,无菌条件下取出瘤块,选取瘤体周边生长旺盛的鱼肉样组织,生理盐水漂洗后用眼科剪剪至大小约1 mm3备用。
15只实验兔使用10%水合氯醛(5 mL/kg)耳缘静脉注射麻醉,腹部备皮、5%聚维酮碘溶液消毒、铺巾,沿剑突下腹中线切开约2 cm,暴露肝左叶,直视下用20 G针头在肝脏组织中分离深约l cm的窦道,将1块修剪好的瘤块植入窦道内,填塞约1 mm3明胶海绵后用无菌棉签按压止血后将肝脏还纳入腹腔,然后逐层缝合,关闭腹腔,制成荷瘤兔。麻醉苏醒后放回笼中饲养,术后每天肌注40万单位青霉素,连续注射3 d。
1.3 肝原位种植瘤术后模型的构建及实验分组
移植后7 d行超声检查显示15只荷瘤兔肝脏均成瘤,随机分为3组:R0切除组,以叶间切迹为标准行肝左叶部分切除术,手术部位无渗血后于肝切口旁同一肝叶行内隧道法植入约1 mm3瘤块,方法同上,然后将肝脏还纳入腹腔后逐层关腹;R1切除组,以瘤体边缘为界行肝左叶瘤体切除术,明胶海绵按压止血后还纳肝脏,逐层关闭腹腔;R2切除,瘤体部分切除术,直视下切除约1/2肿瘤组织后明胶海绵按压止血,然后还纳肝脏,逐层关闭腹腔。记录3组实验兔手术时间,麻醉苏醒后放回笼中饲养,术后每天肌注40万单位青霉素,连续注射3 d。
1.4 超声检查
VX2肿瘤原位移植后第7天,术后第7、14、21天行超声检查。采用深圳迈瑞生物医疗电子股份有限公司的Mindray Reason 8超声诊断仪,使用频率为7~11 MHz的线阵探头L11-3U,在超声造影(contrast-enhanced ultrasound,CEUS)模式下经耳缘静脉弹丸注射意大利Bracco公司生产的声诺维(SonoVue)0.6 mL,随后推注2 mL生理盐水冲管。
常规超声观察肝脏VX2肿瘤生长及血供情况,包括病灶数目、大小、内部回声(低回声、等回声、高回声)、回声均匀性(均匀、不均匀)、边界(清晰、不清晰)、形态(规则、不规则)、钙化(点状、短线状、无);彩色多普勒血流成像(color Doppler flow imaging,CDFI)显示血流信号的分布(周边、内部、周边及内部、无)和形态(点状、短线状、无);在CEUS模式下观察肿瘤的增强模式。
1.5 取材与病理学检查
实验结束后空气栓塞法处死实验兔,打开腹腔,观察各实验兔腹腔、网膜、肺、肾、脾有无转移结节。切取肝脏VX2肿瘤,书页状切开,观察肿瘤的数目、颜色、形态等特征;并对其他脏器组织取材,浸泡在4%的中性多聚甲醛溶液中固定后石蜡包埋,行H-E染色。
1.6 统计学处理
采用SPSS 23.0分析软件,计量资料以中位数M(P25,P75)表示,组间比较用Kruskal-Wallis秩和检验。计数资料以n(%)表示,组间比较采用Fisher精确概率检验,相关性分析用Spearman相关性检验,检验水准α=0.05。
2 结 果
2.1 模型构建的情况
肝左叶VX2肿瘤种植后第7天,超声检查15只实验兔肝脏成瘤,成瘤率100%。术后复发模型中,R0切除组(n=5)手术时间为25(23~30)s,R1切除组(n=5)手术时间为22(19~26)s,R2切除组(n=5)手术时间为23(22~25)s,组间差异无统计学意义(P>0.05)。R0切除组中1只实验兔术后第2天死亡,开腹后见腹腔积血及凝血块,考虑术后出血,余14只实验兔存活至实验结束。
2.2 不同时间点术后肝内复发VX2肿瘤的生长及转移情况
术后第7、14、21天行常规超声及CEUS检查,3组肿瘤随着时间而增大,且R2切除组肿瘤大于R0切除组及R1切除组,肿瘤形态不规则,呈融合状,但R0切除组和R1切除组肿瘤大小差异无统计学意义(P>0.05)。R2切除组肝内多发肿瘤(5/5,100%)、肺转移(5/5,100%)及肝门处淋巴结转移(4/5,80%)的比例高于R0切除组和R1切除组。3组术后复发肝VX2肿瘤不同时间点生长及转移的情况见表1。R0、R1、R2切除组常规超声、CEUS及术后病理学情况分别见图1~3。
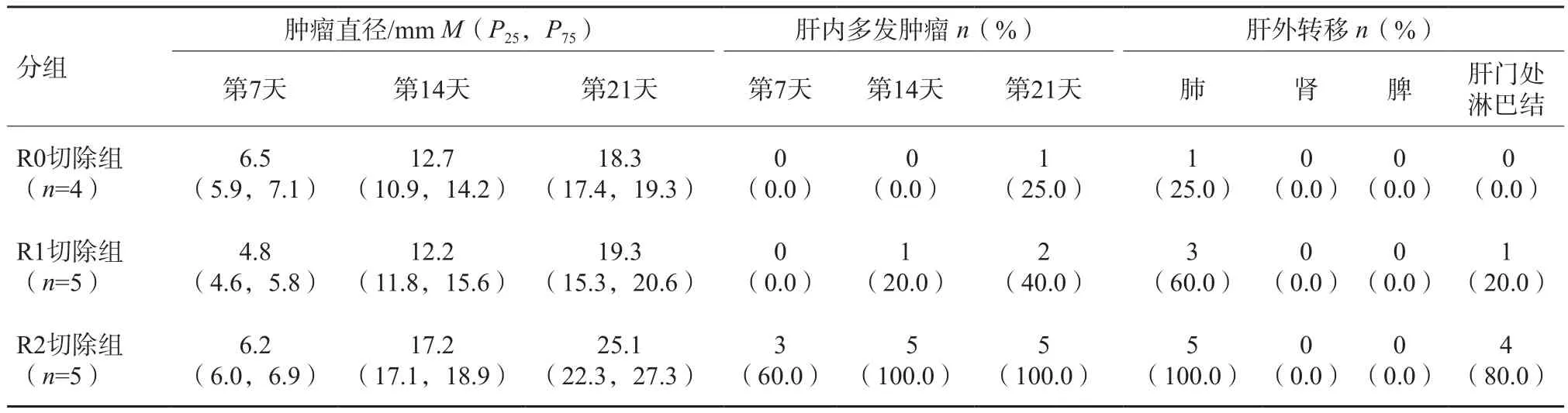
表1 3组术后复发肝VX2肿瘤不同时间点生长及转移的情况
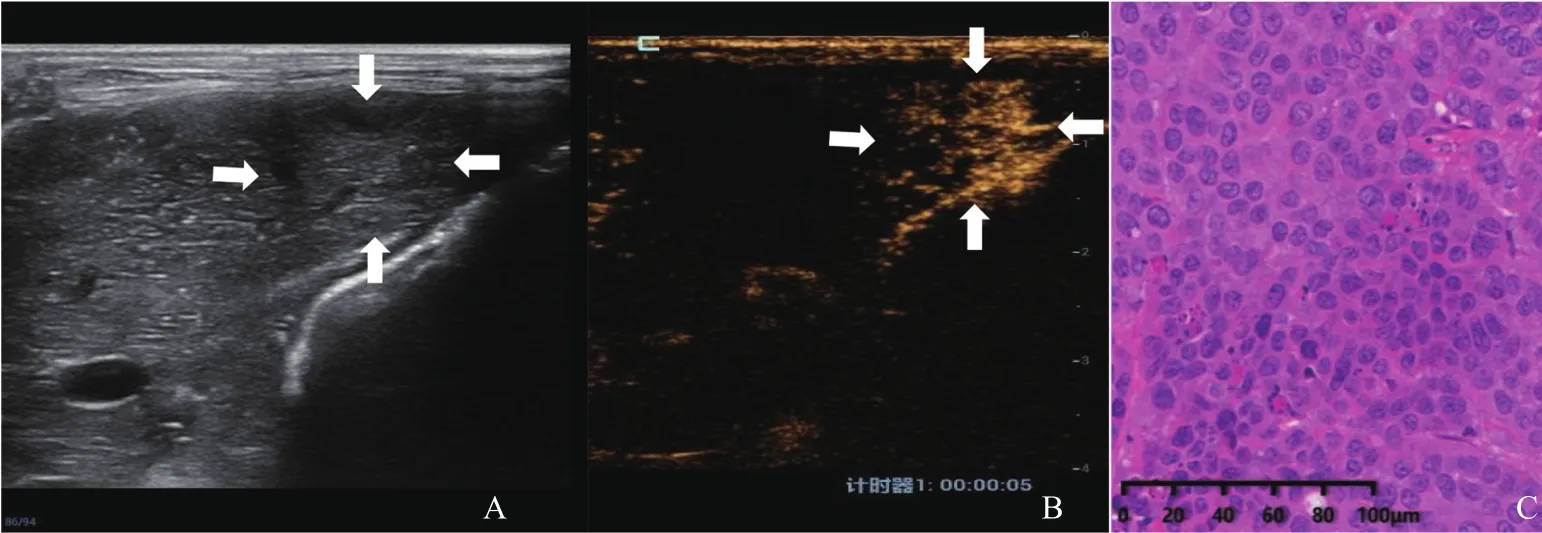
图1 R0切除组实验兔CEUS图像及病理学表现
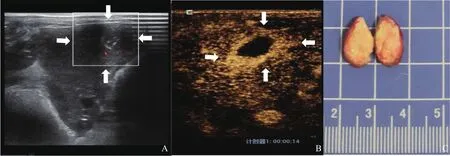
图2 R1切除组实验兔CEUS及大体标本图像
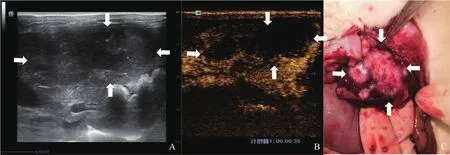
图3 R2切除组实验兔CEUS及大体标本图像
2.3 不同时间点术后肝内复发VX2肿瘤的常规超声特征
常规超声上所有肝内复发VX2肿瘤均呈低回声,在第7、14、21天,肿瘤内部回声不均匀(50.0%、92.9%、100.0%,P=0.03)、钙化(50.0%、85.7%、71.4%,P=0.001)的比例逐渐增高,而且肿瘤内部回声不均匀与时间呈显著相关(r=-0.518)。术后复发肝VX2肿瘤常规超声及CEUS分析见表2。
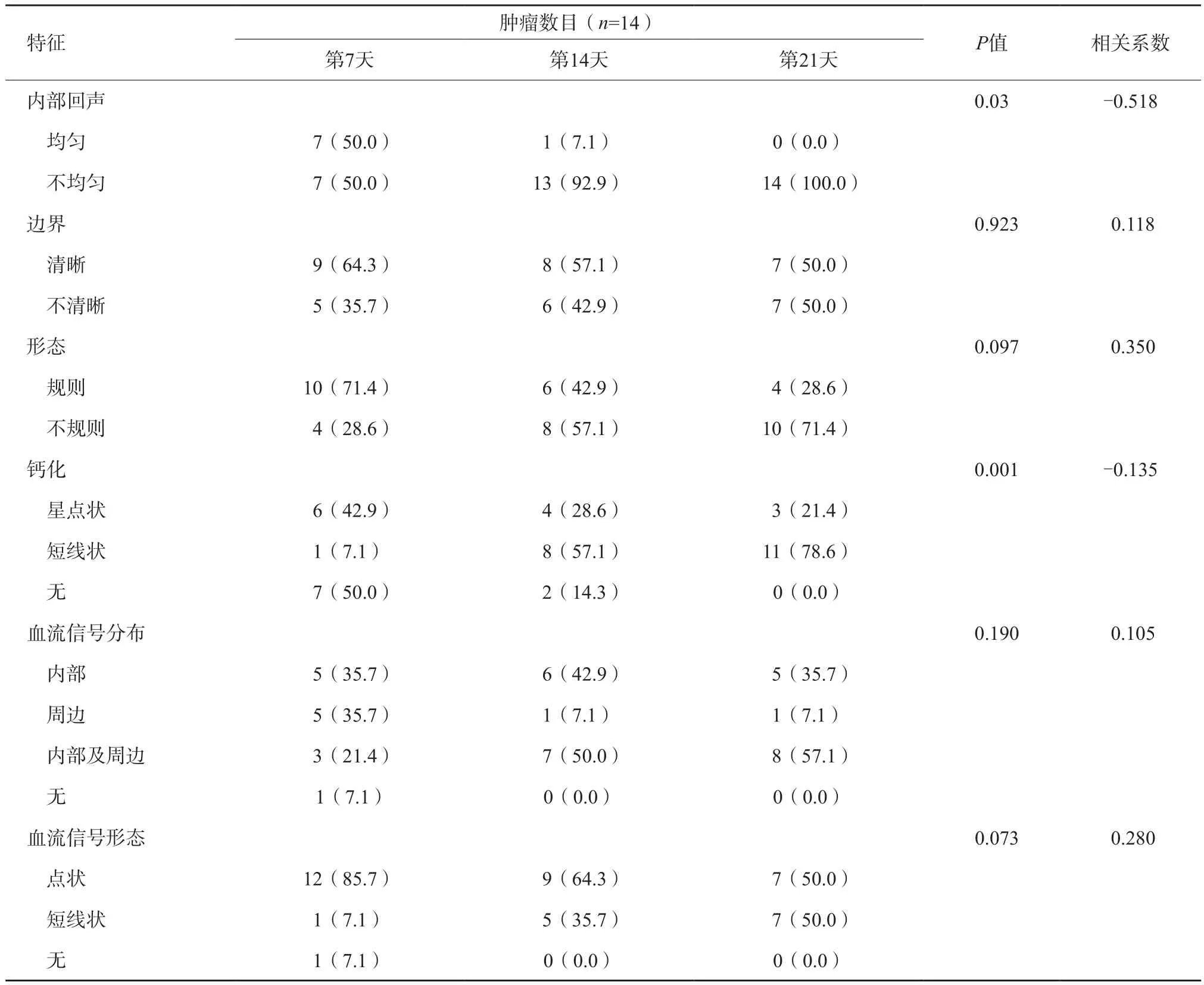
表2 术后复发肝VX2肿瘤常规超声及CEUS分析 n(%)
2.4 不同时间点术后肝内复发VX2肿瘤的CEUS特征
经耳缘静脉注射造影剂后,所有VX2肿瘤表现为快速高回声增强,第7天42.9%(6/14)的肿瘤呈整体增强;第14天及第21天,分别有64.3%(9/14)和28.6%(4/14)的肿瘤表现为整体不均匀增强,35.7%(5/14)和71.4%(10/14)的肿瘤呈环状增强(P=0.000),增强方式与时间呈显著相关性(r=0.632)。
VX2肿瘤开始高回声增强时间及低回声增强时间周围早于肝实质,呈“快进快出”的增强模式,但肿瘤及肝实质增强时间与时间无明显相关性(r分别为0.007、0.092、-0.135)。不同时间术后肝内复发VX2肿瘤的CEUS特征见表3。
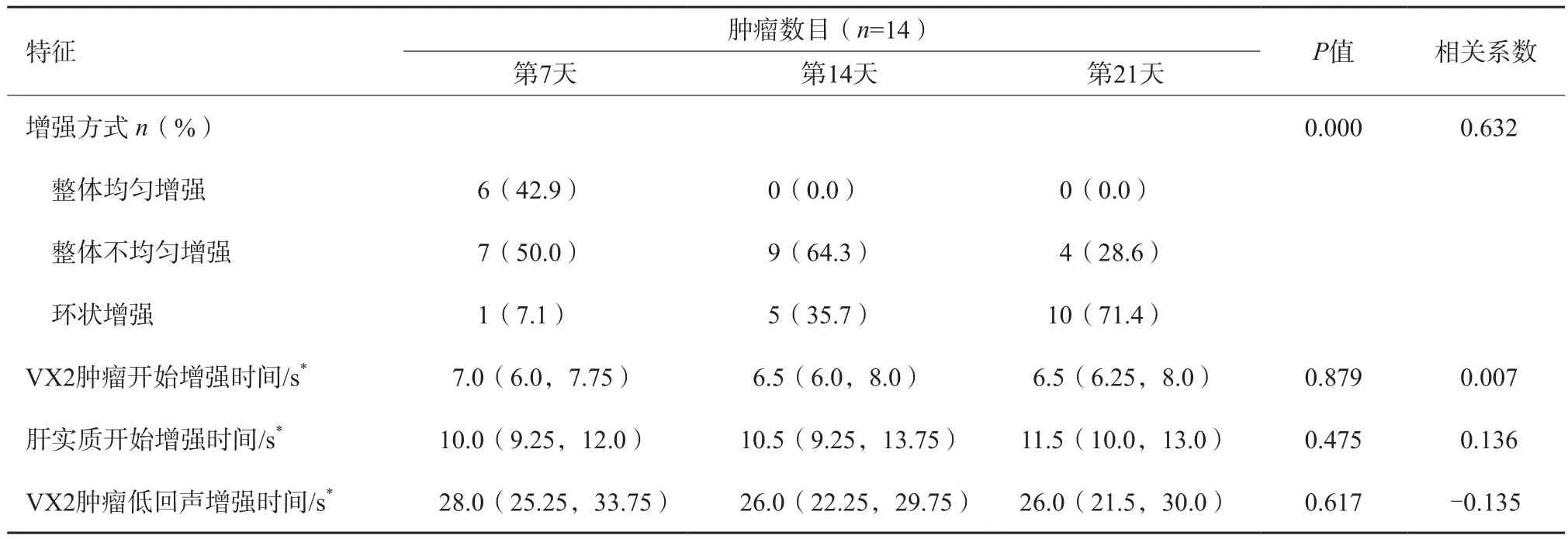
表3 不同时间点术后肝内复发VX2肿瘤的CEUS特征
3 讨 论
TACE、射频消融术、分子靶向治疗是肝癌术后复发的主要治疗方法,但效果不尽满意,患者术后5年总生存率仅30%~40%[5]。近年来,载药微球等新型栓塞材料、热消融的增效方法、免疫治疗及多种治疗方案的联合应用等研究[6-7]一直是肿瘤治疗领域的热点,急需适宜的动物模型评价其有效性及安全性。肝癌的荷瘤动物载体通常使用小鼠和兔,小鼠体型较小、血管细,不适用于TACE、手术等治疗方法的研究,而兔体型较大适于经肝动脉治疗的实验研究。而且兔VX2肿瘤血供丰富,生长周期短,模型构建方法简便易行,是目前TACE相关研究较为广泛的肝癌实验模型[8]。既往兔VX2肿瘤的研究[9]主要关注肿瘤的移植部位、肝原位移植瘤的移植方法等,而肝癌术后复发模型的研究较少。
复发性肝癌与原发性肝癌临床特征存在一定差异,复发性肝癌数目较多、手术切除导致解剖结构的变化影响后续治疗而且对肝脏储备功能造成损伤[10]。因而肝脏原位移植瘤模型在肿瘤的血管生成、侵袭性及对药物治疗的敏感性方面与肝癌切除术后模型有所不同,术后复发模型较原位移植瘤模型在评估肿瘤药物及微创治疗效果方面更加具有优势[11]。而且,既往研究[12]中常用的裸鼠等免疫缺陷动物的肝癌移植瘤模型由于免疫功能的缺失既不符合人类肿瘤发生、发展的模式又容易发生感染,本实验使用的新西兰大白兔弥补了此项不足。
超声是肝脏肿瘤的首选检查方式,VX2肿瘤表现为低回声,边界欠清,随着肿瘤增大,出现内部回声不均匀,点状及短线状钙化,与刘娅等[9]研究结果相似。我们还观察了CEUS不同时期VX2肿瘤的生长状态和血供情况,VX2肿瘤主要由肝动脉供血,在CEUS表现为“快进快出”的增强模式,与人类恶性肿瘤相似[13]。VX2肿瘤较小时主要表现为整体均匀增强,随着肿瘤增大而表现为整体不均匀增强和环状增强,可能与肿瘤中央坏死、向周边浸润性生长有关[14]。常规超声结合CEUS检查从大小和血供等角度显示VX2肿瘤的生长状况,一方面为评估肿瘤的生长特征提供更多的信息,另一方面为研究时开始干预时间的选择提供合理的依据,肿瘤过小不便于影像学诊断研究,而肿瘤内部坏死较多时影响实验治疗后的疗效评估。
本研究构建的3种模型均出现肝内术后复发VX2肿瘤。R2切除组的实验兔肝内复发肿瘤生长速度较快,肿瘤的数目多于R0和R1切除组,而且R2切除组的术后复发肿瘤呈融合状,形态不规则,较早出现中央坏死。肝外转移方面,R2切除组实验兔肺转移结节、肝门处淋巴结转移数目也多于R0和R1切除组,具有较强的局部侵袭性和远处转移的特点,适合进展期肝癌综合治疗及计算机体层成像(computed tomography,CT)/磁共振成像(magnetic resonance imaging,MRI)或正电子发射体层成像(positron emission tomography,PET)/CT等影像学相关研究,而不适用于超声诊断的实验研究[15]。
R0切除组荷瘤兔需要较高的无菌条件和一定的外科手术技能,实验兔术后创口大量出血等并发症发生率较高。而R1切除组手术操作相对简便,造模成功率高,肿瘤在肝内以单发为主,也出现肺转移,适合肝脏恶性肿瘤的超声及其他影像学研究,便于TACE、射频消融术等局部治疗或靶向治疗等全身治疗,是研究肝癌手术后复发较理想的模型。
本研究有一定的局限性,超声检查在评价多发病变方面存在不足,后续我们将会使用CT/MRI等影像学检查方法检测VX2肿瘤的生长特征;而且实验中研究的样本量较小,在以后的研究中会逐步扩大实验规模并进行改进。
综上所述,本研究建立了兔VX2肝癌术后模型,为后期研究提供可靠的动物荷瘤载体。
