Mg与Mg17Al12在Al2(SO4)3溶液中的产氢性能
2022-11-07柴玉俊
苏 琪, 柴玉俊, 王 宁
(1.河北师范大学 化学与材料科学学院,河北 石家庄 050024;2.河北师范大学 分析测试中心,河北 石家庄 050024)
金属镁及其合金作为一种新型材料已经广泛应用于不同领域,这些材料的回收再利用是减少环境污染的研究重点.镁及其合金能与水反应产生高纯氢气,是实时制氢的方法之一[1-4],同时可以使其再利用.但是,镁及其合金表面的氧化膜减缓了金属与水的反应[5-8].为此,研究人员采用球磨法减小镁/镁合金的粒径、增加缺陷,从而加速金属与水反应[9-15].Hou等[16]球磨Mg10Ni-EG-MoS2获得的复合物在水中反应,5 min内的平均产氢速率达到144.6 mL/(min·g).此外,在水中加入氯化物、硫酸盐和溴化物等,能加速金属的腐蚀,从而加快氢气的产生[17-20].Song等[18]认为氯离子具有点蚀作用,能加速金属的腐蚀,且随着氯离子浓度的增加,腐蚀速率加快.Saba等[19]报道了球磨Mg17Al12与AlCl3,MgCl2和NaCl,其中Mg17Al12-AlCl3复合材料在水中的产氢性能最优.在硫酸盐溶液中,特别是在高浓度MgSO4溶液中,镁被快速腐蚀,产生氢气;而在Na2SO4溶液中,镁合金较铝镁合金更容易被腐蚀[20].尽管镁及其合金在硫酸盐(Na2SO4,MgSO4)溶液中的腐蚀已经得到关注,但对镁及其合金在Al2(SO4)3溶液中产氢行为的研究较少.本文中,笔者系统地研究了Mg和Mg17Al12在Al2(SO4)3溶液中的产氢性能,并探讨了其反应机理.
1 实验试剂与仪器
将蒸馏水在水浴锅中恒温30 min,加入不同量的Al2(SO4)3(纯度为99%)得到不同浓度的Al2(SO4)3溶液;再加入0.4 g镁粉(纯度为99.5 %),观察镁粉在Al2(SO4)3溶液中的产氢性能,同时采用排水集气法收集气体.为减少误差,每组数据均重复多次.镁铝合金在Al2(SO4)3溶液中的反应与以上相同.
采用S-4800扫描电子显微镜(日本日立公司)和H-7650透射电子显微镜(日本日立公司)观察产物的微观形貌;采用D8 ADVANCE X射线衍射仪(德国布鲁克AXS公司)表征产物的组成;采用PHS-3C pH酸度计(梅特勒-托利多仪器公司)检测溶液pH值.
2 结果与讨论
2.1 Mg和Mg17Al12在Al2(SO4)3溶液中的产氢性能
Al2(SO4)3在水中水解,溶液呈酸性(pH为1.3~2.5),而Mg在酸性溶液中,容易被腐蚀,产生氢气.图1a给出了303 K时Mg在不同浓度Al2(SO4)3溶液中的产氢量和产氢速率.可以看出,随着Al2(SO4)3浓度的增大,镁粉完全反应,产氢量约为1 000 mL/g,表明Mg已完全反应.当Al2(SO4)3浓度为0.70 mol/L(pH=1.98)时,瞬时产氢速率达到85 mL/(min·g).随着温度的升高(c=0.70 mol/L),反应速率加快(图1b),瞬时速率从最初的56 mL/(min·g)(303 K)增加到156 mL/(min·g)(328 K).在Al2(SO4)3溶液中,连续加入镁粉,溶液黏稠度增大,体系由酸性(pH=2.2)逐渐变为碱性(pH=9.4),产氢量和产氢速率明显下降(图1c,d).
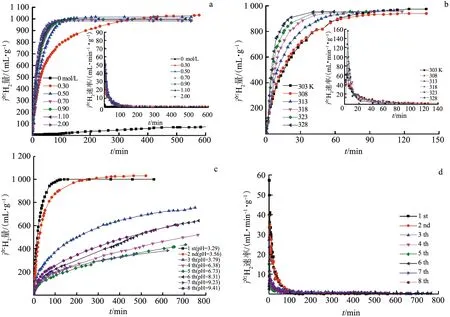
a.Al2(SO4)3溶液浓度的影响; b.温度的影响; c,d.批量添加Mg的影响.
图2a为303 K时Mg17Al12在不同浓度的Al2(SO4)3溶液中的产氢性能.Mg17Al12在水中不易被腐蚀,产氢量仅为80 mL/g.在Al2(SO4)3溶液中(c≥0.30 mol/L,pH=1.4~2.3),Mg17Al12极易被完全腐蚀,产氢量约为1 100 mL/g;产氢速率保持在68~77 mL/(min·g).随着温度的升高,产氢速率增加(c=0.30 mol/L),产氢量基本保持在1 100 mL/g(图2b).然而,随着Mg17Al12的连续添加,镁铝形成水合物,使得溶液黏稠度增大,pH由最初的2.4增加到7.6,减弱了合金与水的反应,产氢速率和产氢量均降低(图2c).
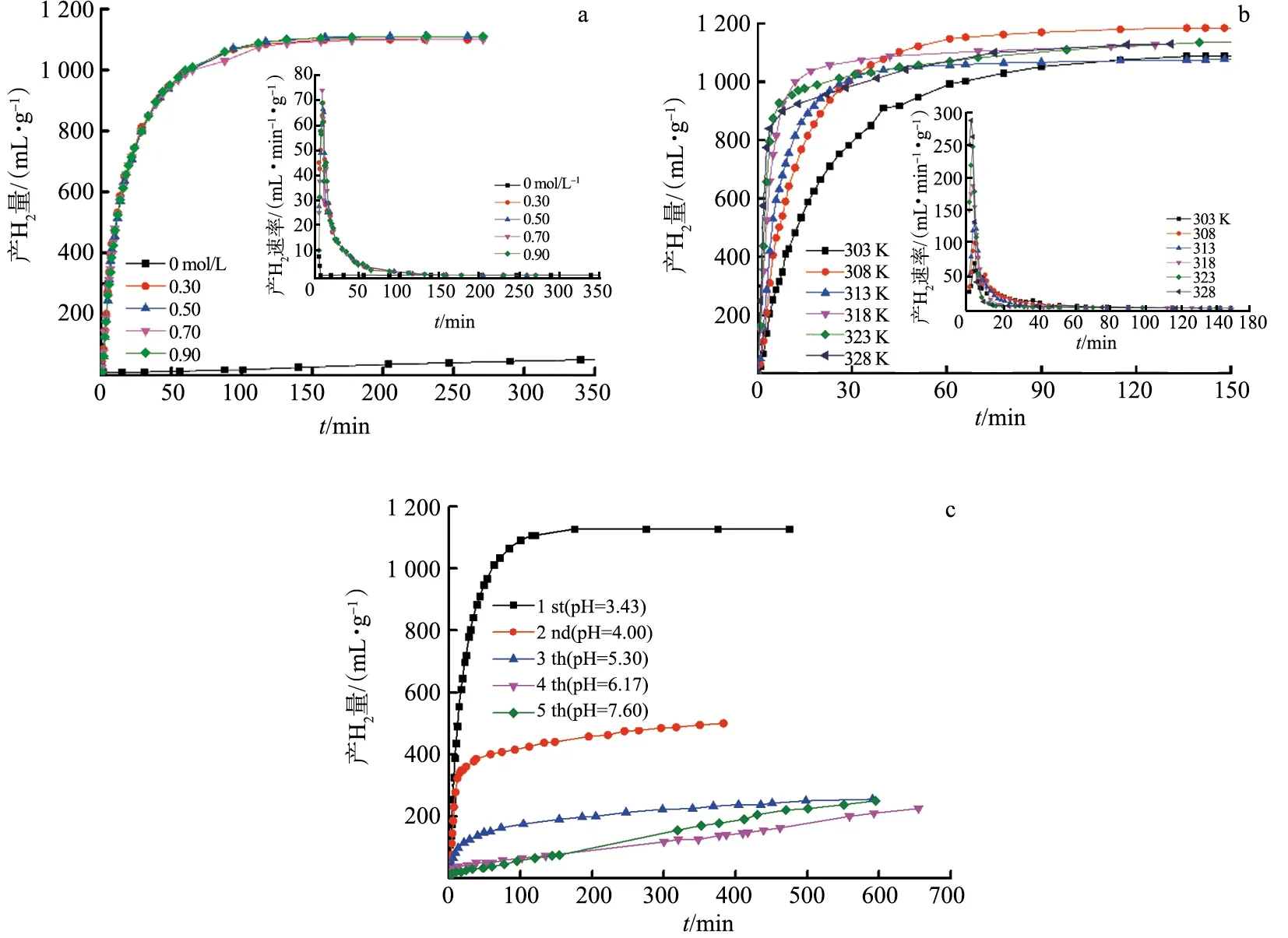
a.Al2(SO4)3溶液浓度的影响; b.温度的影响; c.批量添加Mg17Al12的影响.
图3给出了Mg和Mg17Al12分别在Al2(SO4)3溶液中获得的氢气与氧气反应产生的电流和电压的变化.开始时,Mg和Mg17Al12在Al2(SO4)3溶液中的产氢速率较快,氢与氧反应产生的电流和电压分别为92~94 mA和0.5 V.随着产氢量和产氢速率的变化,电流和电压逐渐降低,表明氢与氧反应不但与产氢速率有关,还与产氢量有关.
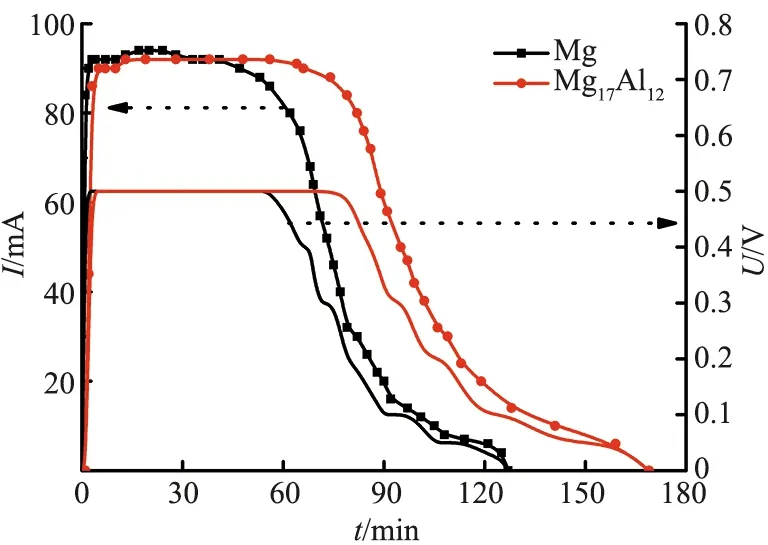
图3 氢-氧反应产生的电流和电压
2.2 Mg/H2O产氢机理
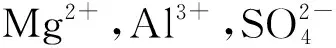
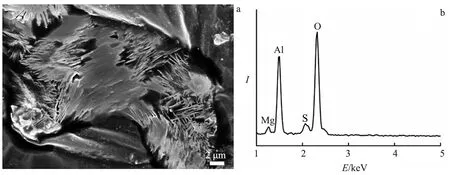
图4 Mg在Al2(SO4)3溶液中反应后的SEM(a)和EDS图(b)
图5 Mg在 Al2(SO4)3溶液中反应后的TEM(a)和Mapping图(b)

图6 Mg在Al2(SO4)3溶液中副产物的SEM-EDS图(a,b,c)和XRD图(d)
(1)
2.3 Mg17Al12/H2O产氢机理
Mg17Al12是常用的镁铝合金材料,其中合金中的Mg和Al均能在一定条件下与水快速反应产生氢气.Shoshin等[21]采用熔炼法合成不同比例的Mg-Al合金,其在弱酸性溶液中能快速反应.球磨为3 %,2 %的CO,Bi(质量分数)及Mg/Al(摩尔比为7∶3)的合金,所得混合物在海水中的产氢率为97.2 %[22].本实验中,由Al2(SO4)3水解产生的H+与Mg17Al12几乎完全反应;但在0.3 mol/L的Al2(SO4)3溶液中连续添加Mg17Al12,能检测到Mg17Al12的衍射峰(图7),表明Mg17Al12并未完全反应.Mg17Al12在0.30 mol/L的 Al2(SO4)3溶液中被腐蚀时,表面出现不同形貌的颗粒物质.由图8a~c可知,表面片层形成的疏松物质为Mg(OH)2或Al(OH)3,颗粒状中Mg与Al的原子比为1.5∶1和1∶1(图8d,e),表明产物是由Mg-Al-OH或Mg-Al-SO4组成.随着溶液中H+的减少,形成MgAl2(SO4)4胶状物质,当积累到一定的量后阻断了镁-水反应的进行.
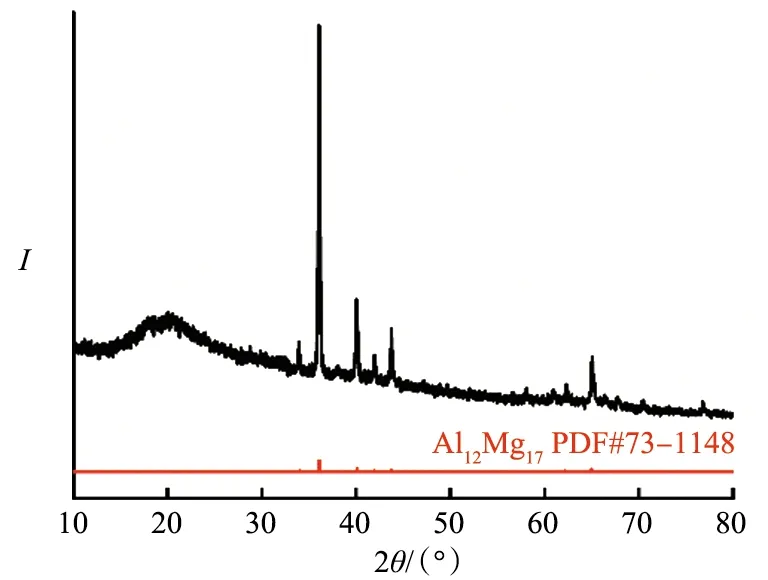
图7 Mg17Al12在Al2(SO4)3溶液中反应后的XRD图
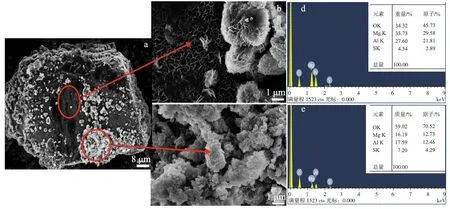
图8 Mg17Al12在Al2(SO4)3溶液中反应后的SEM图(a,b,c)和能谱图(d,e)
3 结 论