细胞周期蛋白B1的泛癌分析及在膀胱癌中的表达与临床特征的相关性
2022-11-06万正强郑冬冰王英磊
万正强 李 成 郑冬冰 王英磊
1 滨州医学院第二临床医学院 山东 烟台 264003; 2滨州医学院烟台附属医院泌尿外科 山东 烟台 264010
细胞周期蛋白B1(cyclinB1,CCNB1)基因定位于人染色体5q12,长约8.8 kb,包含9个外显子和8个内含子,可由2个不同的转录起始位点产生2个不同转录组,分别是组成型表达蛋白和G2/M期细胞周期调节蛋白[1]。其编码产物细胞周期蛋白B1的分子质量为62kD,含出核序列和入核序列,2种序列通过自身磷酸化的改变促进CCNB1穿梭于胞质和胞核间,使CCNB1在整个细胞周期中始终处于一种动态平衡[2]。CCNB1与细胞周期蛋白依赖性激酶1(cyclin-dependentkinase1,CDK1)结合并磷酸化CDK1Thr160/Thr161形成异源二聚体CCNB1/CDK1,即细胞成熟促进因子(maturationpromotingfactor,MPF),促进细胞从G2期进入M期,启动细胞有丝分裂[3]。CCNB1在细胞中的功能随细胞周期变化,间期集中在细胞质,但可以穿梭到细胞核,前期在细胞核中累积,然后在前中期聚集染色质、纺锤体微管、中心体和染色质,进入有丝分裂时,CCNB1-CDK1被激活并促进早期事件,比如染色体浓缩、细胞核膜包膜破坏和纺锤体极装配。CCNB1-CDK1复合物的另一功能是分解核膜使得有丝分裂纺锤体进入染色体[4]。
许多研究表明 CCNB1 在多种肿瘤中异常表达,如肺癌[5]、乳腺癌[6]、食管癌[7]、结肠癌[8]、肝癌[9]等肿瘤组织,并参与各种癌症类型的细胞生长、分化、凋亡和转移,有望作为肿瘤诊断和预后的分子标志物。CCNB在非小细胞肺癌(non-smallcelllungcarcinoma,NSCLC)中的表达高于正常组织,并且与患者的分化程度、组织类型、性别、淋巴结转移、脉管侵犯有关,而与患者年龄、肿瘤直径、分期、有无远处转移无关;并且高表达的患者有较短的总生存率,这些结果表明CCNB1可用作诊断和预后生物标志物及治疗NSCLC的分子靶点[10-11]。Fang等[12]在研究p53突变的乳腺癌中,体外实验研究示circ-ccnb1与H2AX 和Bclaf1 形成复合物,抑制乳腺癌细胞增殖,促进凋亡,表明突变型p53促进乳腺癌进展受到环状RNA circ-CCNB1抑制。Huang等[13]利用免疫组化检测了 100 例食管鳞癌组织和 41 例正常组织中CCNB1的表达水平,发现CCNB1在癌组织中过表达并且与病理分级有关,而与年龄、性别、肿瘤大小和淋巴结转移无关,进一步体内外实验发现 CCNB1 的异位表达能促进细胞增殖,增强细胞侵袭和迁移能力并导致细胞通过毛细血管内皮外渗的能力增加,同时发现CCNB1能通过促进上皮-间充质转变促进转移。相反,沉默CCNB1可以抑制食管癌细胞的增殖、侵袭和转移。Wang等[14]发现在结直肠癌(colorectal cancer,CRC)细胞株中抑制CCNB1的表达能抑制肿瘤细胞的增殖,并能通过调节细胞周期相关分子CDK1/CDC25C 促使细胞周期发生G2/M期阻滞,还发现抑制CCNB1可能通过激活p53-野生型HCT116细胞中的p53/Bax通路促使肿瘤细胞发生早期凋亡。然而抑制CCNB1 表达可抑制p53-突变HCT116细胞增殖,阻断细胞周期进程,诱导细胞凋亡。谷军生等[15]在肝细胞癌(hepatocellular carcinoma,HCC)中研究发现抑制CCNB1的表达后,肝癌细胞系的增殖能力明显降低,细胞迁移能力和侵袭能力及成瘤能力受到显著抑制,肝癌细胞系的凋亡率明显升高。Chai等[16]研究发现敲除肝癌细胞 SMMC7721和HepG2中的CCNB1 表达,MTT测定显示CCNB1的敲低能显著抑制2种HCC细胞系的增殖和肿细胞的克隆形成能力。目前,对于肿瘤中CCNB1表达,预后及免疫相关性的研究还很少,对CCNB1在肿瘤发病机制中的作用,尤其是在膀胱癌中的作用还没有全面了解。本研究利用相关数据库对CCNBI泛癌分析,分析CCNB1在膀胱癌中的表达及临床相关性,寻找肿瘤预后预测因子和治疗新靶点。
1 材料与方法
1.1 CCNB1基因在泛癌中的差异表达分析 为了分析在不同肿瘤组织和正常组织之间CCNB1的差异表达,本研究对至少具有两个正常组织的肿瘤类型进行t检验,采用基因表达水平中位数来计算倍数变化,分别在ONCOMINE数据库和GEPIA数据库进行泛癌组织和癌旁组织之间CCNB1表达水平的差异分析,P<0.01且表达倍数变化值|log2(fold change)|≥2被认为差异有统计学意义。
1.2 HPA数据库中CCNB1蛋白在泛癌组织中差异表达分析 HPA数据库(human protein atlas,HPA),即人类蛋白表达图谱数据库,利用转录组学和蛋白质组学技术,从RNA和蛋白水平研究人类不同组织和器官中的蛋白表达情况,从tissue atlas,cell atlas和pathology atlas角度分别展示蛋白在正常组织、细胞和肿瘤组织中的表达情况,可进行肿瘤组织蛋白差异表达分析,并可进行基因与肿瘤的生存分析。
1.3 CCNB1在泛癌中的预后分析 Kaplan-Meier Plotter数据库基于EGA以及TCGA等公共数据库的基因芯片和RNA-seq数据构建而成[17],可以评估54 675个基因在21种癌症中对于生存率的影响,主要包括乳腺癌(6 234例)、卵巢癌(2 190例)、肺癌(3 452例)和胃癌(1 440例)等。PrognoScan数据库通过大量收集公开的癌症芯片数据集来探索基因表达与患者临床预后之间的关系,包括总体生存期和无病生存期(disease-free survival,DFS)等。本研究利用Kaplan-Meier Plotter和PrognoScan数据库分析和验证泛癌中CCNB1表达对患者生存率的影响,P<0.05被认为有统计学意义;研究TIMER和CIBERSORT数据库中泛癌中CCNB1表达与免疫的相关性。
1.4 CCNB1表达水平与多种肿瘤免疫微环境的相关性 运用交互式在线数据库TIMER数据库[18],在其“基因”模块中研究了CCNB1表达水平和不同肿瘤中肿瘤浸润免疫细胞(tumor-infiltrating immune cells,TIICs)之间的相关性,TIMER应用去卷积堆积方法从基因表达谱推断肿瘤浸润免疫细胞的丰度,TIMER数据库包含10 897个样本,可以对TCGA中33种癌症类型评估其免疫浸润的丰度,免疫细胞类型包括B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞6种。在此,本研究分析了CCNB1表达与肿瘤浸润细胞的相关性并探究肿瘤免疫浸润与患者预后的关系,并利用CIBERSORT数据库进行部分验证,进一步探究CCNB1与8种癌症类型中22种免疫细胞亚型的相关性,并利用R包“GSVA包”重点分析了在膀胱癌中,CCNB1表达与24免疫细胞浸润的相关性。
1.5 CCNB1表达水平与膀胱癌患者临床病理特征相关性分析 UALCAN数据库是一个有效的癌症数据在线分析和挖掘的网站,主要基于TCGA数据库中的相关癌症数据进行分析,可以对相关基因进行biomarker鉴定、表达谱分析,生存分析等,还可以分析目标基因在癌和癌旁表达差异以及与癌症组织不同病理分级、年龄、性别、体重、种族等的相关性[19]。本研究探究了CCNB1表达水平与膀胱癌临床表型的相关性,包括病理分级,年龄、吸烟习惯、淋巴转移等临床特征。随后本研究从TCGA-GDC网站下载了408例膀胱癌患者的RNA-seq数据和临床病理数据,采用卡方检验分析验证CCNB1表达与膀胱癌临床病理特征之间的相关性,运用单因素与多因素Cox回归分析影响患者生存的危险因素。P<0.05为差异有统计学意义。
1.6 基因富集分析 通过GSEAv4.1.0软件[20]进行基因富集分析(gene set enrichment analysis,GSEA),以检测CCNB1表达高分组和低分组之间差异富集的信号通路,选择MSigDB基因集中的基因集“c2.cp.kegg.v7.1.symbols.gmt”作为参考基因集,标准化P<0.05、标准化富集分数(normalized enrichment score,NES)>1.5且 FDRq<0.05的信号通路被认为具有统计学显著性,GSEA分析通常富集丰富的信号通路被认为是与CCNB1表达相关的潜在通路。
2 结果
2.1 CCNB1在多种肿瘤的癌组织及其癌旁组织差异表达,且与其临床分期及预后相关 本研究在ONCOMINE和GEPIA中分析了CCNB1基因表达水平,以探究其在整个癌症范围内的表达情况。在ONCOMINE数据库中,与相应的正常组织相比,CCNB1在癌症组织中的表达水平更高,包括膀胱癌、头颈癌、乳腺浸润癌、子宫颈癌、结直肠癌、食管癌、肝癌、肺癌、卵巢癌、胰腺癌、前列腺癌以及淋巴瘤和肉瘤,但在膀胱癌、头颈部鳞癌、乳腺癌中CCNB1表达既有上调,也有下调,这种情况的出现,本研究考虑可能与其肿瘤亚型有关。另外,在白血病、黑色素瘤中CCNB1仅表达下调(图1A)。为了进一步分析和验证CCNB1在泛癌中的表达情况,本研究通过GEPIA数据库对CCNB1在前列腺腺癌、头颈部鳞癌、肝细胞癌、肺腺癌、结肠腺癌和乳腺浸润癌和其癌旁组织中的差异表达进行验证。本研究发现,CCNB1在前列腺腺癌、头颈部鳞癌、肝细胞癌、肺腺癌、结肠腺癌和乳腺浸润癌的表达显著高于癌旁组织,P<0.05(图1B)。以上结果表明,CCNB1在泛癌中普遍高表达,这揭示了CCNB1作为原癌基因的作用。
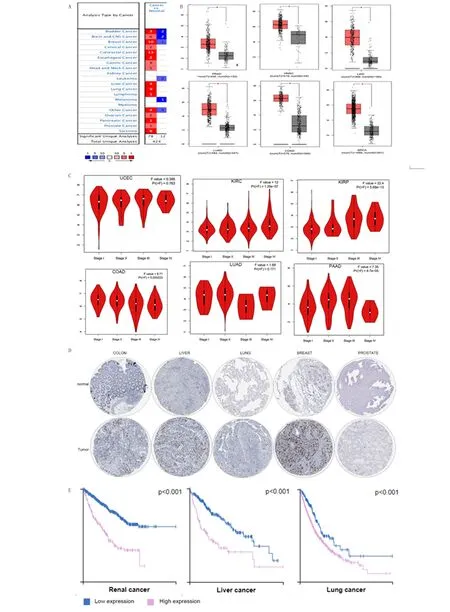
A.与正常组织相比,CCNB1在不同癌组织中的表达情况;B.在GEPIA数据库中,CCNB1在多种癌组织及癌旁组织差异表达(T代表肿瘤样本,N代表正常样本);C.在GEPIA数据库中,CCNB1表达与多种肿瘤的临床病理分期的相关性;D.在HPA数据库中,CCNB1蛋白在多种癌组织及癌旁组织的表达水平;E.在肾癌、肝癌和肺癌中,CCNB1蛋白表达水平与患者总生存期的相关性。
随后,在GEPIA数据库中,本研究探究了CCNB1表达水平与以上6种肿瘤临床病理分期之间的相关性,包括子宫内膜癌、肾透明细胞癌、肾乳头状癌、结肠腺癌、肺腺癌和胰腺癌。结果表明CCNB1基因的表达水平与以上4种人类肿瘤临床病理分期有相关性,包括肾透明细胞癌、肾乳头状癌、结肠腺癌、肺腺癌和胰腺癌,P<0.01(图1C),表明CCNB1在促进肿瘤进展中有着关键作用,这验证了本研究之前的观点,CCNB1是一种普遍存在的原癌基因。
最后本研究在蛋白质水平对CCNB1的表达情况进行了分析,利用HPA数据库分析人直肠组织、乳腺组织、肺组织、肝组织和前列腺组织的肿瘤组织和癌旁组织中CCNB1蛋白的表达情况,并探究了CCNB1蛋白表达与肿瘤预后的相关性。本研究发现,CCNB1蛋白主要表达于细胞的细胞质中,CCNB1蛋白在肾癌、肝癌和肺癌组织中表达显著增高,P<0.05,进一步的生存分析表明高表达CCNB1蛋白的肾透明细胞癌、肝细胞癌和肺腺癌患者总生存期较差,P<0.01(图1D、E),这进一步证实了CCNB1是一种普遍存在的原癌基因的观点,是众多癌症预后的不利因素。
2.2 多种肿瘤CCNB1高表达与患者更差预后密切相关 为探究CCNB1表达与癌症患者预后的相关性,本研究利用Kaplan-Meier Plotter数据库和PrognoScan数据库进行了相关分析,Kaplan-Meier Plotter的数据主要来自TCGA数据,而PrognoScan数据库的数据主要来自GEO数据库,TCGA数据和GEO数据是分别独立的数据集,故两个数据库的分析结果可相互验证。在两个数据库中,本研究分析了CCNB1表达水平与10种癌症类型预后的相关性,包括膀胱癌、乳腺癌、肾透明细胞癌、肾乳头状癌、肝细胞癌、肺腺癌、卵巢癌、胰腺癌、脑癌和前列腺癌。在Kaplan-Meier Plotter数据库,本研究发现在7种癌症类型中,CCNB1的高表达都会造成患者更低的生存率,包括膀胱癌、乳腺癌、肾透明细胞癌、肝细胞癌、肺腺癌、卵巢癌和胰腺癌(图2A)。
在PrognoScan数据库的分析结果与在Kaplan-Meier Plotter数据库的分析结果基本一致。本研究发现,在以下6种癌症类型中,CCNB1的高表达都会造成患者更差的预后,包括乳腺癌、膀胱癌、脑癌、卵巢癌、前列腺癌和肺腺癌(图2B)。以上分析表明,CCNB1为普通存在的原癌基因,其高表达可能会导致患者更差的预后。
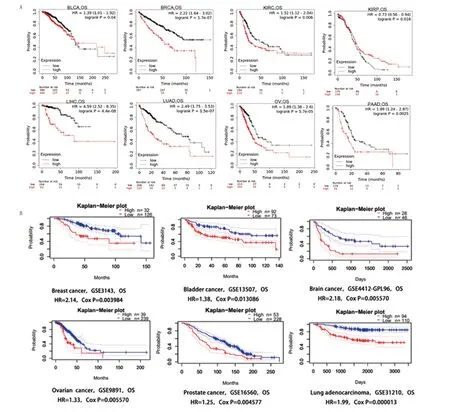
A.在Kaplan-Meier Plotter数据库中,CCNB1基因表达水平与肿瘤患者总生存期的相关性;B.在PrognoScan数据库中,CCNB1基因表达水平与肿瘤患者总生存期的相关性。
2.3 CCNB1与多种肿瘤免疫微环境密切相关,且可能通过影响肿瘤的免疫微环境进而影响患者预后 肿瘤浸润性淋巴细胞是一类肿瘤浸润性且具有抗原效应的细胞群,包括存在于肿瘤癌巢内的瘤内肿瘤浸润淋巴细胞及间质中的基质肿瘤浸润淋巴细胞,由T细胞、B细胞和自然杀伤细胞构成,被认为是免疫生物学标记物,是癌症前哨淋巴结状态和存活的独立预测因子。TIMER数据库,利用RNA-Seq表达谱数据检测肿瘤组织中免疫细胞的浸润情况,提供6种免疫细胞的浸润情况,包括B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞。在此,本研究分析了在5种癌症类型中,CCNB1与肿瘤免疫浸润细胞的相关性,包括膀胱癌、肾透明细胞癌、肝细胞癌、肺腺癌和前列腺癌,分别分析了其表达水平与6种免疫浸润细胞得分的相关性。本研究发现,在5种癌症类型中,仅在肾透明细胞癌中CCNB1表达与其肿瘤纯度显著负相关性,而在膀胱癌、肾透明细胞癌、肝细胞癌、肺腺癌和前列腺癌5种癌症类型中,CCNB 1表达与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞的浸润水平均有相关性,P<0.05。在膀胱癌中,CCNB1表达水平与CD8+T细胞、树突状细胞和中性粒细胞的浸润水平呈显著正相关,而与B细胞、CD4+T细胞的浸润水平呈显著负相关。然而在肺腺癌中,CCNB1表达水平与B细胞、CD4+T细胞、巨噬细胞和树突状细胞的浸润水平呈显著负相关(图3A)。这些发现强烈表明,在膀胱癌和肺腺癌等癌症中,CCNB1可与免疫浸润细胞相互作用从而影响患者的生存状况。
随后,本研究在TIMER数据库进一步分析了以上5种癌症类型免疫浸润水平和CCNB1表达对患者预后的影响。本研究发现,B细胞、树突状细胞和CCNB1表达与肺腺癌预后有关,随着B细胞和树突状细胞浸润水平升高,患者生存时间延长。CD8+T细胞、CCNB1表达与膀胱癌预后有关,随着CD8+T细胞浸润水平升高,患者生存时间缩短。而在肾透明细胞癌、肝细胞癌和前列腺癌中,其预后与免疫细胞浸润无相关性(图3B)。以上表明,CCNB1在肺腺癌、膀胱癌的免疫细胞浸润中起着强有力的调节作用,对B细胞、树突状细胞和CD8+T细胞浸润的调控作用尤其强。
为进一步探究CCNB1与以上6种免疫细胞的22种分子亚型之间的相互作用,本研究在CIBERSORT数据库进一步分析了CCNB1与22种免疫细胞亚型的相关性,使用Spearman相关系数表示两者之间的相关性,其结果用热图展示(图3C)。泛癌热图显示,CCNB1与多种肿瘤的Act-CD4+T细胞显著负相关,随着CCNB1高表达,其浸润水平降低,而与Mast Acting细胞显著正相关,随着CCNB1表达上调,其浸润水平增加。
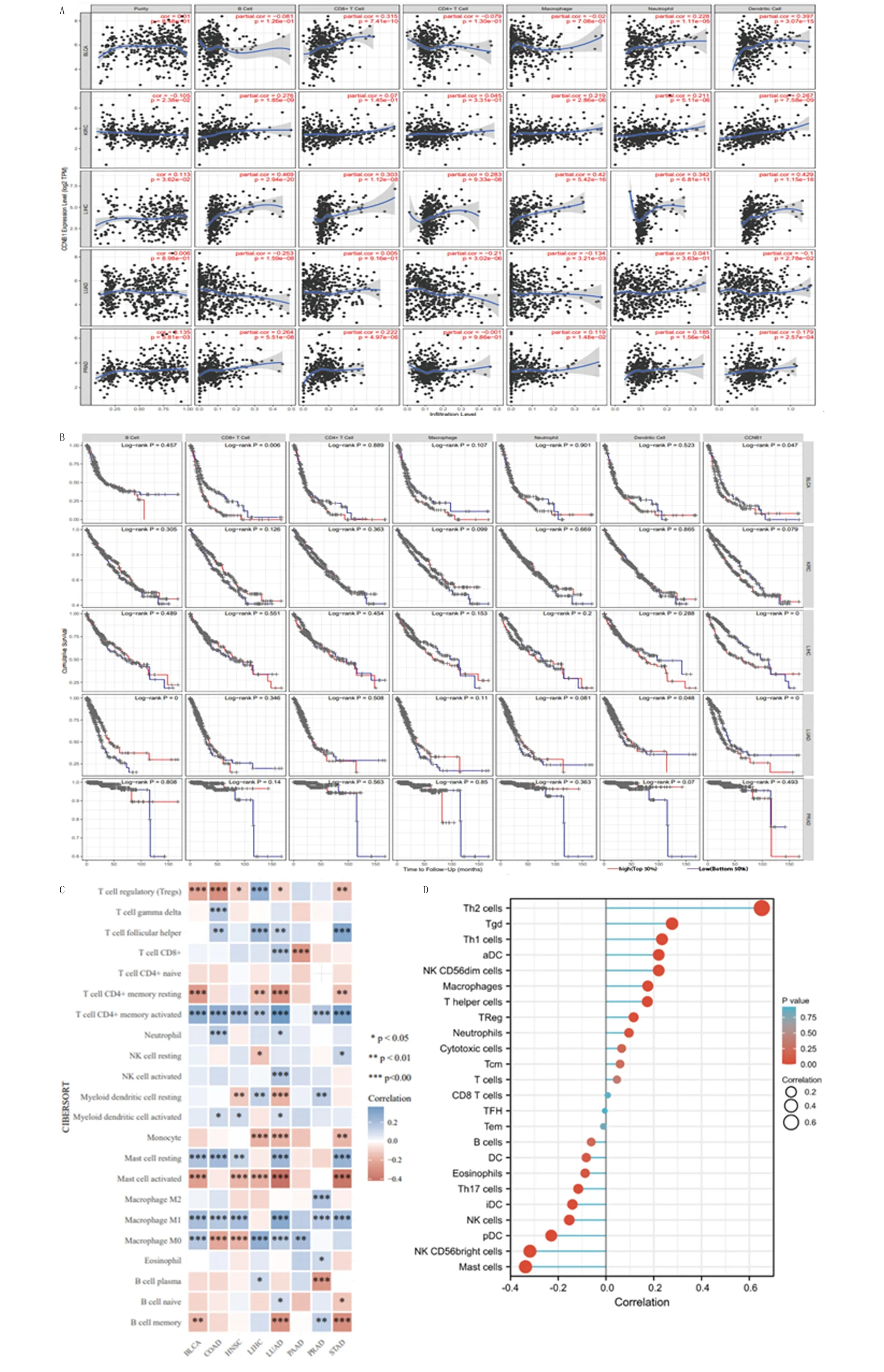
A.在TIMER数据库中,CCNB1表达水平与膀胱癌、肾透明细胞癌、肝细胞癌、肺腺癌和前列腺癌肿瘤免疫浸润水平的相关性;B.在TIMER数据库中,膀胱癌、肾透明细胞癌、肝细胞癌、肺腺癌和前列腺癌中免疫浸润水平与患者总生存期的相关性;C.在TIMER数据库中,CCNB1表达水平与24种免疫细胞亚型的相关性分析,结果用热图展示;D.在CIBERSORT数据库中,CCNB1表达水平与24种免疫细胞亚型的相关性分析,结果用棒棒图展示。*P<0.05,**P<0.01,***P<0.001。
鉴于CCNB1表达与膀胱癌免疫浸润细胞明显相关,且免疫浸润水平与膀胱癌患者预后有关,故本研究下载了TCGA数据库中膀胱尿路上皮癌RNAseq数据和临床数据,利用R包“GSVA包”进一步分析了在膀胱癌中,CCNB1表达与24种免疫细胞的相关性,其相关性用Spearman相关系数表示,分析结果用棒棒图展示。从棒棒图中可知,在膀胱癌中,CCNB1表达与多种免疫细胞相关,包括immature DC、Macrophages、Mast cells、NK cells和Th2 cells等(表1),其中与免疫细胞Th2 细胞显著正相关,P<0.001(图3C),CCNB1表达增加,Th2 细胞浸润水平增加。
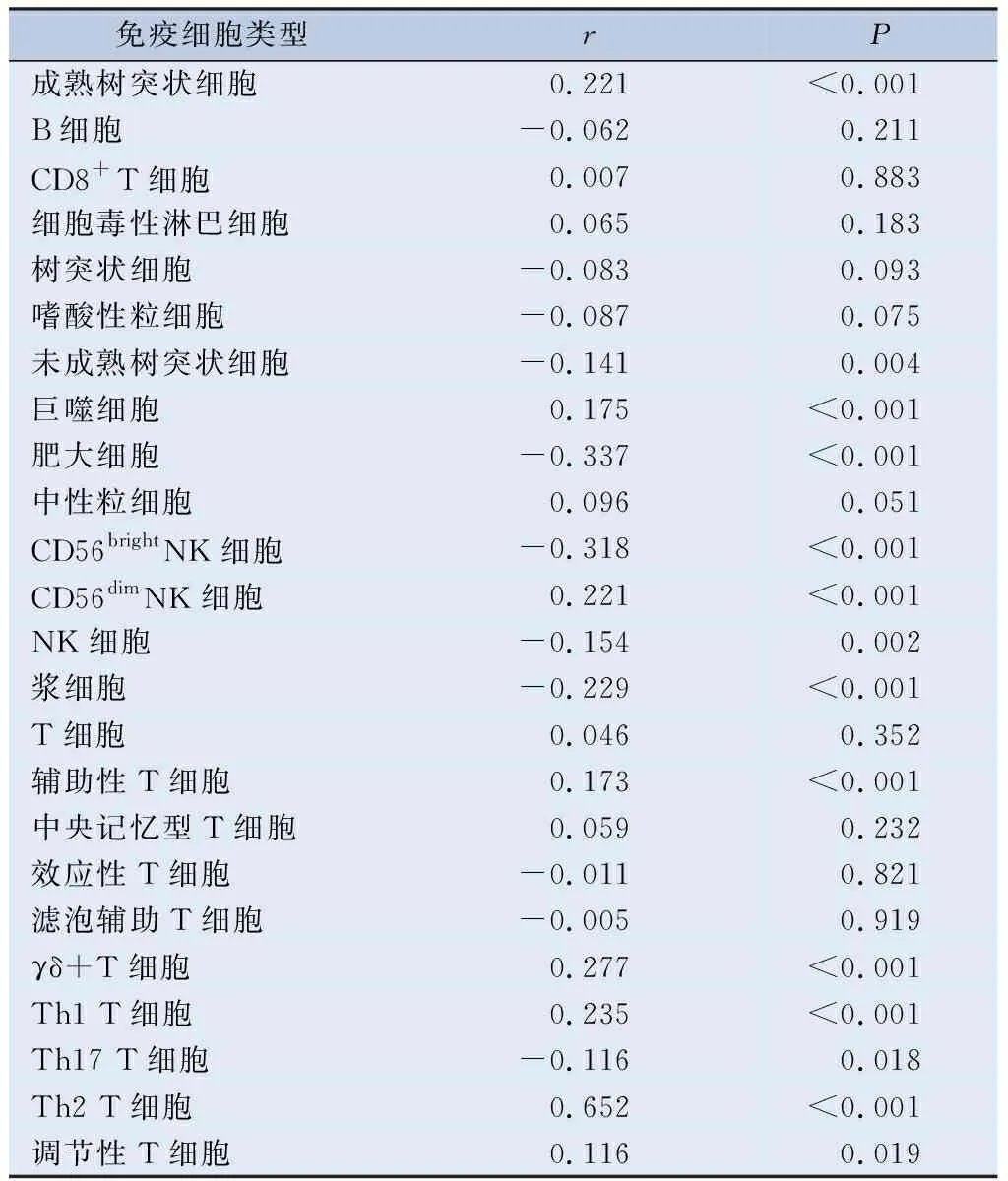
表1 CCNB1表达水平与膀胱癌肿瘤免疫浸润细胞的相关性
以上分析表明,CCNB1可与多种肿瘤免疫浸润细胞相互作用从而影响肿瘤的发生、发展,进而影响患者预后。
2.4 CCNB1表达水平与膀胱癌患者临床病理特征密切相关,且为膀胱癌患者预后的独立预测因子 鉴于CCNB1表达与膀胱癌免疫浸润水平显著有关,且其浸润水平与膀胱癌患者预后相关,CCNB1在基因组、转录组均展示出其在膀胱癌发生、发展中相对特异性的作用,那么CCNB1在膀胱癌临床层面的表现如何?故本研究进一步分析了CCNB1表达与膀胱癌临床病理特征的相关性。
为探究CCNB1表达水平与膀胱癌临床病理特征的相关性,本研究首先利用UALCAN 数据库进行了相关分析,包括疾病分期、年龄、吸烟习惯和淋巴结转移。本研究发现,在以上亚组分析中,膀胱肿瘤患者的CCNB1表达均明显高于正常对照组,P<0.05。在疾病分期中,CCNB1表达在膀胱肿瘤分期II期、III期和IV期较正常对照组明显更高。在淋巴结转移中,在淋巴结转移N0、N1、N2和N3中CCNB1表达较正常对照组明显更高。在年龄中,41~60、61~80和81~100岁中CCNB1表达较正常对照组表达明显更高,且发现在41~60、61~80和81~100岁中CCNB1表达较21~40岁表达明显更高,P<0.05,提示CCNB1表达与年龄有明显相关性。在吸烟习惯中,非吸烟者、吸烟者和改良吸烟者(<15岁)和改良吸烟者(<15岁)中CCNB1表达较正常对照组表达明显更高,但CCNB1在吸烟者中较非吸烟者中表达并无差异,表明吸烟可能并不会影响CCNB1的表达(图4A)。综合以上分析,本研究认为CCNB1表达可作为膀胱癌潜在的诊断指标。
为进一步分析和验证CCNB1表达与膀胱癌临床病理特征的相关性,本研究从TCGA-GDC网站下载已被TCGA确诊的408例膀胱癌患者的RNA-seq数据和临床病理数据,分析CCNB1表达与其临床病理特征的相关性,包括年龄、性别、组织学分级、总生存期、病理分期、T分期、N分期、M分期、放疗、淋巴血管侵犯和吸烟与否。
首先,本研究根据CCNB1表达水平,将408例膀胱癌患者分为CCNB1高表达组和CCNB1低表达组,用卡方检验分析人口统计学和临床病理参数与CCNB1表达的关系。分析表明,CCNB1表达水平与组织学分级(P<0.001)、淋巴血管侵犯(P=0.017)和总生存期(P=0.028)有相关性,而与年龄、性别、病理分期、T分期、N分期、M分期、放疗和吸烟与否无相关性。以上分析与本研究在UALCAN数据库的分析基本一致,但在UALCAN数据库的分析显示,CCNB1表达与年龄、临床分期有相关性(P<0.05)(图4A),出现这一情况,本研究认为这可能与本研究排除了较多的临床病理信息不全的患者所致。另外,UALCAN数据库没有分析CCNB1表达与膀胱癌组织学分级的关系,在此,本研究发现这两者之间有相关性(P=0.017)(表2)。
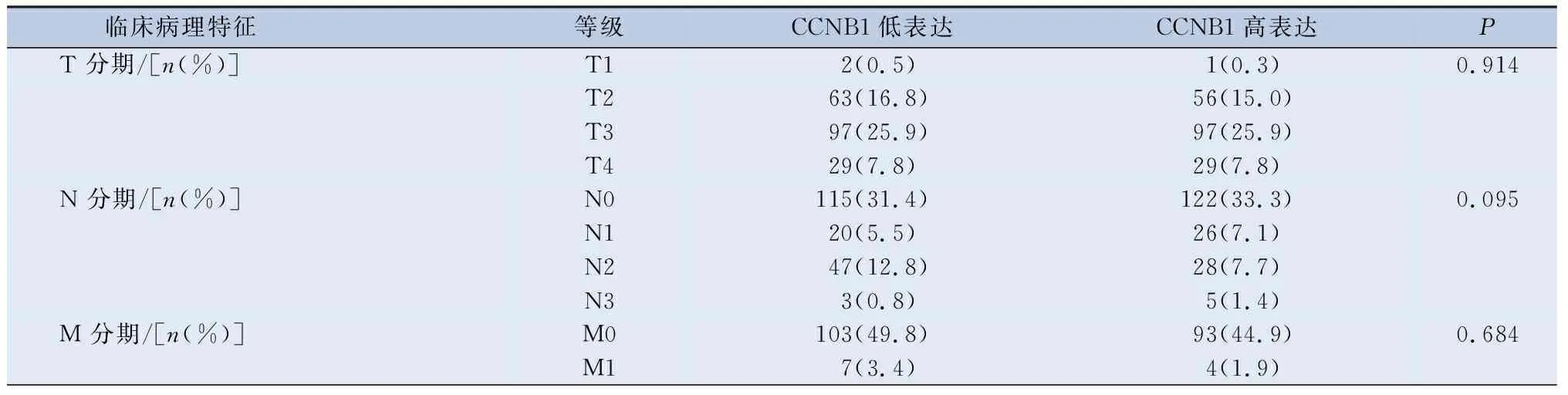
表2 CCNB1基因表达水平与膀胱癌患者临床病理特征的相关性/(n=204)
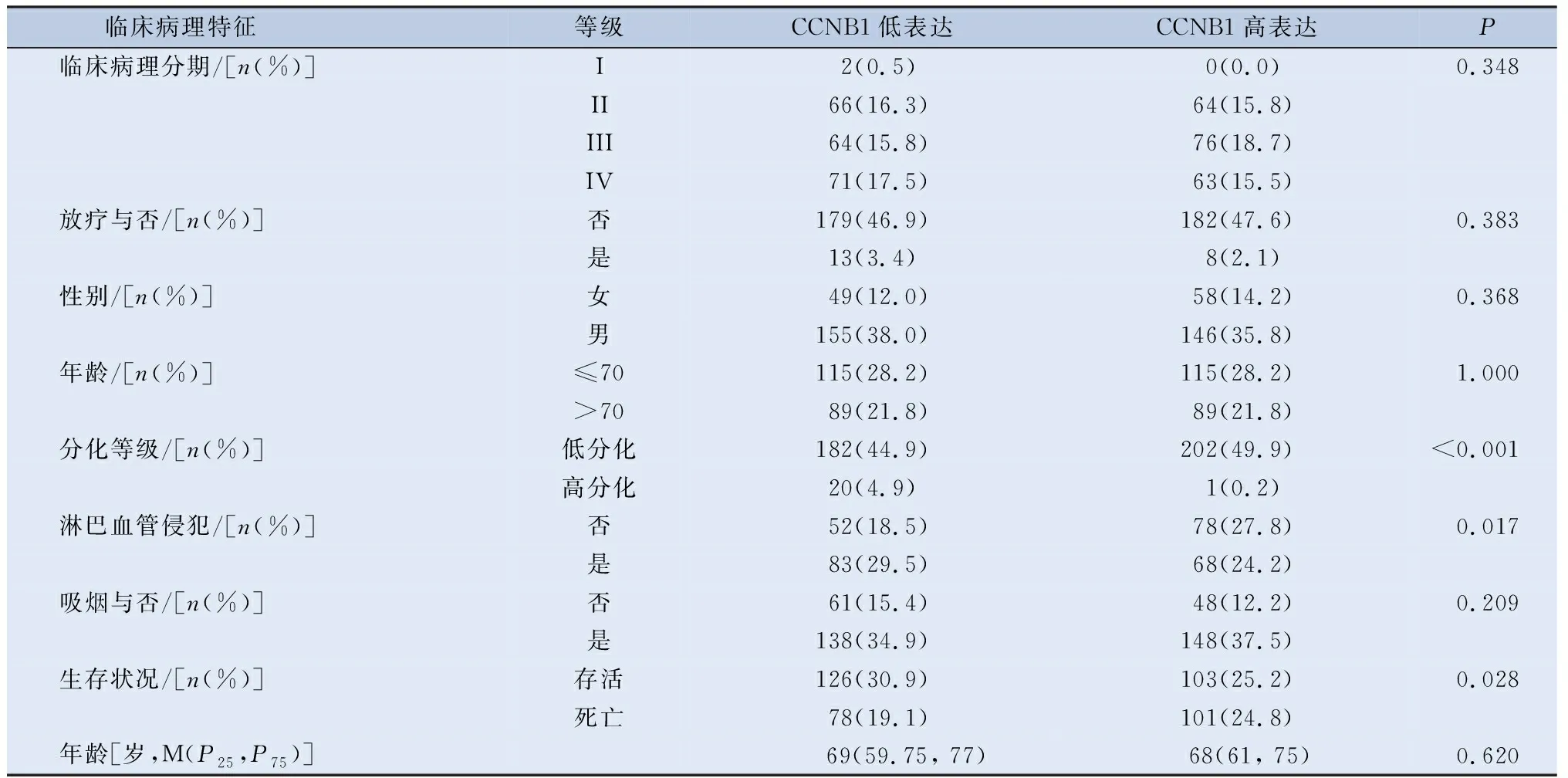
表2 (续)
随后,本研究利用Cox比例风险模型验证CCNB1作为膀胱癌预后因素的潜力,其单因素与多因素Cox回归分析结果使用R包“forestplot包”绘制为森林图(图4B、C)。单因素Cox回归分析表明,年龄(P=0.006)、病理分期(P<0.001)、T分期(P<0.001)、N分期(P<0.001)、M分期(P<0.001)、淋巴血管侵犯(P<0.001)和CCNB1表达(P=0.020)与患者预后有关。随后,本研究将单因素Cox分析中有意义的临床病理特征(P<0.05)纳入多因素Cox回归模型进行多因素回归分析,结果表明,淋巴血管侵犯(P=0.034)和CCNB1表达(P=0.009)与患者OS相关。最后,为了进一步探究CCNB1诊断膀胱癌的敏感性和特异性如何,本研究绘制了膀胱癌的ROC曲线,从图可知,在鉴别正常组织和肿瘤结局上,变量CCNB1的预测有较高准确性(AUC=0.909,CI=0.842~0.977)。另外,在鉴别低级和高级结局上,变量CCNB1的预测能力有一定准确性(AUC=0.813,CI=0.729~0.898)(图4D)。以上分析表明,淋巴血管侵害和CCNB1表达是膀胱癌患者预后的独立危险因素,且CCNB1在诊断膀胱癌中有着较好的诊断效果。
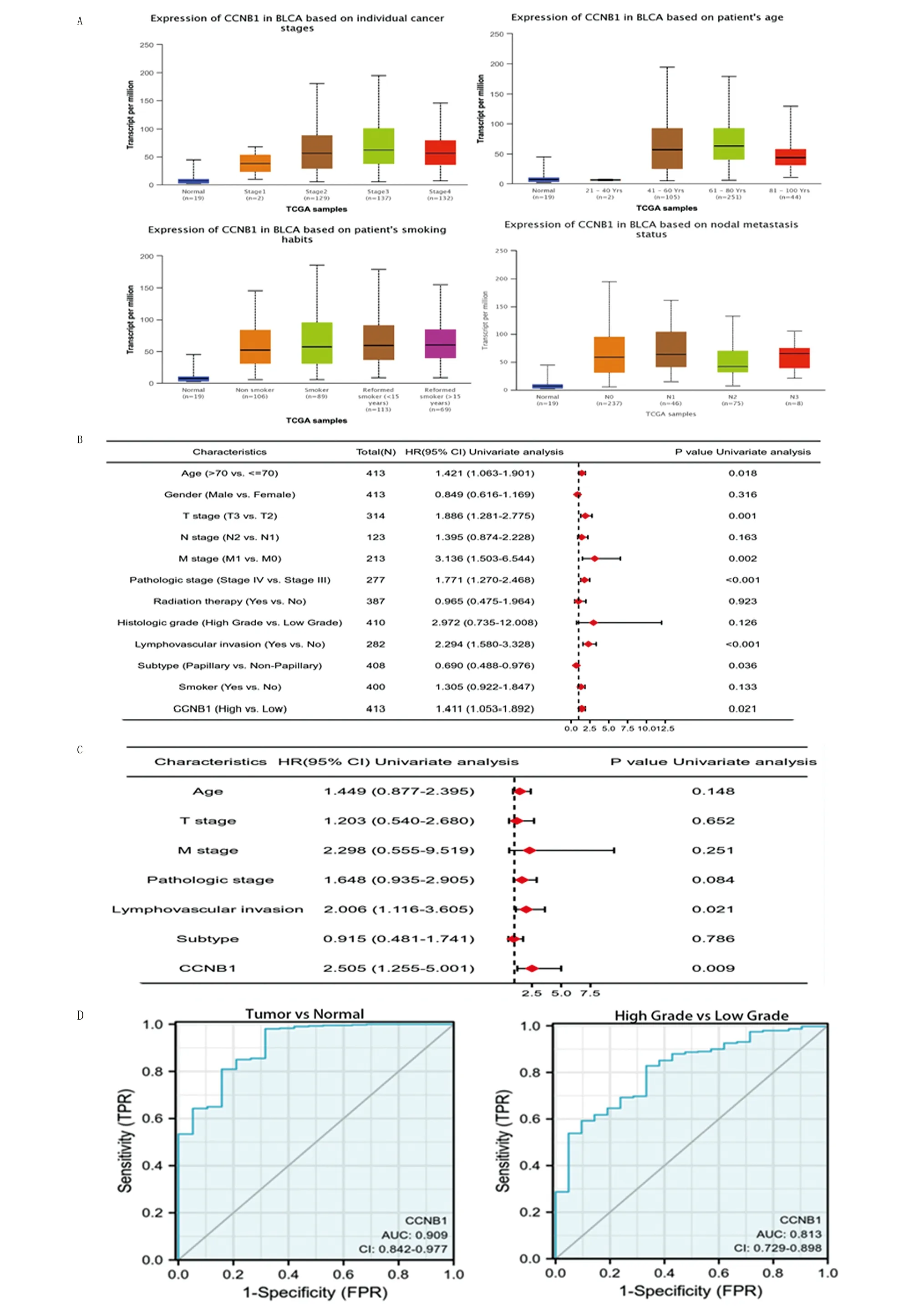
A.在UALCAN数据库中,CCNB1基因表达水平与膀胱癌临床病理特征的相关性;B.CCNB1基因表达水平与膀胱癌临床病理特征的单因素回归分析;C.CCNB1基因表达水平与膀胱癌临床病理特征的多因素回归分析;D.CCNB1基因在膀胱癌中诊断性ROC曲线。
2.5 CCNB1与膀胱癌发生、发展密切相关,其可能通过调控P-53信号通路等经典癌症通路影响膀胱癌患者预后 为探索CCNB1影响膀胱癌患者临床结局的潜在机制,本研究利用GSEA软件进行了基因富集分析。在P<0.05、FDRq<0.25和NES>1.5的条件下,GSEA共富集到40个KEGG信号通路,在此,本研究仅展示前10个KEGG信号通路,CCNB1低表达组和高表达组各5个(图5A、表3)。在GSEA富集分析中,本研究发现CCNB1高表达组主要富集于代谢相关通路,包括不饱和脂肪酸的代谢,亚油酸代谢、花生四烯酸代谢、α-亚麻酸代谢和初级胆汁酸合成以及水盐代谢等通路;而CCNB1低表达组主要富集于生物体生长发育相关通路,包括细胞周期、嘧啶代谢、剪接体、蛋白酶体和DNA复制等通路。
随后,本研究从单细胞基因组测序方向,利用Tabula Muris数据库进一步分析CCNB1在膀胱癌发生、发展中的作用。Tabula Muris数据库是一个小鼠细胞信息的开源数据库,收集了20个小鼠器官中分离出100 000多个细胞并进行注释,可通过利用小鼠的转录组图谱发现新的细胞类型,发现已知细胞类型中的新的基因表达,以及比较不同器官细胞类型。在此,基于FACS方法的分析表明,CCNB1在小鼠多种组织均有表达,包括膀胱组织、脑组织、骨髓组织、脂肪组织、肺组织、乳腺组织等,且在乳腺组织中表达最高。而基于微流体液滴技术对膀胱组织中的细胞组成进行分析,并通过细胞本体类进行注释,本研究发现CCNB1主要通过影响膀胱组织内的膀胱细胞、膀胱尿路上皮细胞、内皮细胞和白细胞的生物作用来影响膀胱癌的发生、发展(图5B)。
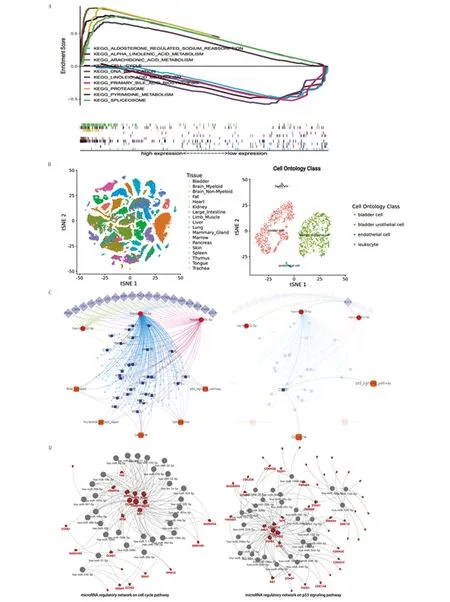
A.膀胱癌GSEA富集分析展示前10个富集分析结果;B.CCNB1在人类不同正常组织单细胞转录组以及在膀胱癌单细胞转录组中的表达情况;C.膀胱癌中与CCNB1基因表达相关的调节网络图;D.膀胱癌细胞周期信号通路/p53信号通路上的miRNA调控网络图。
最后,为进一步阐明CCNB1在膀胱癌发生、发展的调控机制,本研究联合miRNACancer数据库、TargetScan Human数据库和ENCORI数据库进一步分析参与调控CCNB1表达的上游miRNA和其下游信号通路,并构建miRNA-mRNA-信号通路的调控机制网。通过以上数据库联合预测上游miRNA,本研究发现参与调控CCNB1表达的miRNA有hsa-miR-139-5p、hsa-miR-132-3p和has-miR-181c-5p,取三者交集为hsa-miR-139-5p,进一步分析其下游信号通路,其分析表明,hsa-miR-139-5p负向调控CCNB1激活P53信号通路和细胞周期通路两条经典癌症通路,从而影响膀胱癌的发生、发展(图5C)。随后,本研究从泛癌角度探究与P53信号通路和细胞周期通路相关的miRNA、mRNA并构建miRNA-mRNA调控网络,以进一步分析CCNB1在以上通路中的作用,本研究发现CCNB1参与以上通路的调控,并受上游hsa-miR-139-5p调控(图5D),这验证了本研究先前的分析。
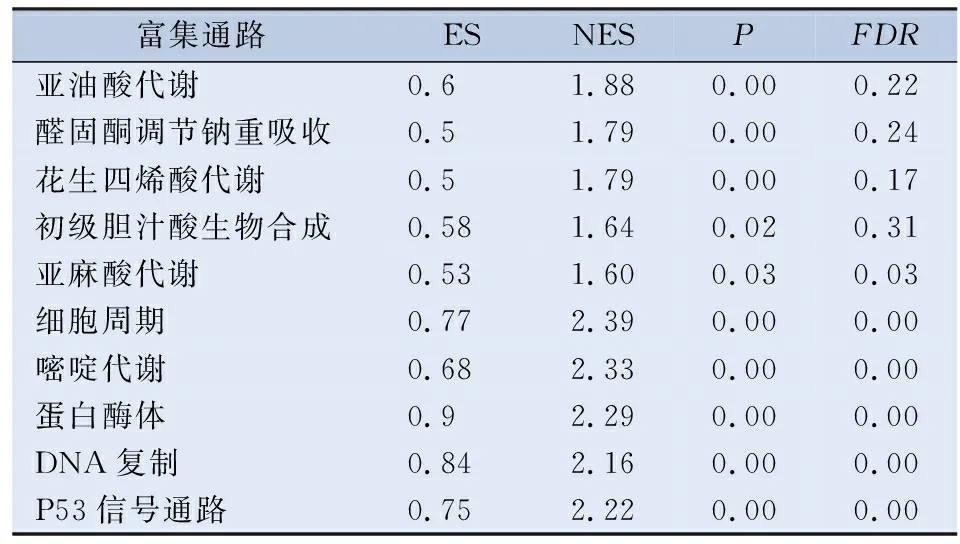
表3 膀胱癌中GSEA富集分析的前10个差异富集的KEGG信号通路
3 讨论
细胞分裂失控是肿瘤发生发展过程中不可或缺的事件,CCNB1是协调正常细胞周期进程的关键分子,在各种人类癌症类型中异常高表达,CCNB1是一种普遍存在的原癌基因。在ONCOMINE和GEPIA数据库中都证实了这一观点,这与诸多学者的观点基本一致。王璞等[21]发现CCNB1在口腔鳞癌细胞系中呈高表达,沉默CCNB1基因能够抑制人口腔鳞癌SCC-15细胞增殖、侵袭和迁移能力,其作用机制可能与抑制PI3K/Akt信号通路的激活有关。张卉等[22]发现沉默CCNB1的表达,能够抑制胰腺癌肿瘤细胞的增殖,并发现这一结果与P53信号通路被激活有关。Wendy等[23]通过组织芯片技术检测90例I-II期原发性非小细胞肺癌和支气管前体病变中CCNB1免疫组化表达,发现40.9%的非小细胞肺癌CCNB1表达增加。Anna等[24]通过对122例膀胱尿路上皮癌进行免疫组织化学染色,发现CCNB1在膀胱尿路上皮癌中高表达,并引起膀胱尿路上皮癌肿瘤细胞的高增殖,其作用机制可能与CCNB1激活p53和Rb通路有关。Yuan等[25]利用CCNB1 siRNAs降低乳腺癌、宫颈癌、骨肉瘤和前列腺癌肿瘤细胞中CCNB1的蛋白水平,发现不同来源的肿瘤细胞增殖被抑制50%~80%,凋亡从5%增加到40%~50%。Fang等[26]利用qRT- PCR检测150例结直肠癌标本中CCNB1的表达,发现CCNB1在结直肠癌组织中的表达显著高于癌旁组织,并且发现CC NB1的表达与淋巴结转移、TNM分期、远处转移有关。但本研究也发现在部分癌症类型中,CCNB1表达为下调,包括白血病、黑色素瘤,但在ONCOMIN数据库中,这两种癌症类型的样本数均偏少,或许并不能推翻CCNB1作为原癌基因这一观点,但CCNB1在这两种癌症类型的具体功能需要更多的实验进行验证。同时,本研究也发现CCNB1在同一癌症类型所发挥的功能并不完全相同,比如在膀胱癌,头颈癌和乳腺癌中,其表达既有上调也有下调。本研究考虑这或许与肿瘤亚型有关,比如乳腺癌根据ER、PR、HER2和KI67分为管腔上皮A型、管腔上皮B型、HER2过表达型和三阴性型4种分子亚型,其各自的浸润模式和对靶向药的敏感性相差甚远,故本研究认为应该关注到基因与肿瘤亚型的关系。
CCNB1与多种肿瘤TNM分期有关,但在各种癌症类型中所起的作用并不完全相同。Huang等[13]利用qRT- PCR检测了100 例食管鳞癌组织和 41 例正常食管组织中 CCNB1 的表达水平,发现CCNB1表达与TNM分期显著相关,随TNM分期增加CCNB1表达水平升高。Fang等[26]利用qRT-PCR检测了150名结直肠癌患者的癌组织和邻近癌旁组织中CCNB1表达水平,发现CCNB表达水平与晚期TNM分期呈负相关。然而Wendy等[23]通过组织芯片技术检测90例I-II期原发性非小细胞肺癌和支气管前体病变中CCNB1免疫组化表达,发现CCNB1表达与TNM分期无相关性,而与分化程度有关。这与本研究在GEPIA数据库中的分析基本一致,本研究发现结直肠癌与TNM分期有相关性(P<0.001),且随着肿瘤分期增加CCNB1表达水平下调,这与Fang等[26]的研究结果基本一致。同时,本研究也发现在一些肿瘤中,CCNB1表达与临床分期无关,比如子宫内膜癌等。那么,CCNB1是如何影响肿瘤TNM分期?在不同的癌症类型中,其机制也不同。Huang等[13]通过体内外实验发现CCNB1能通过促进上皮-间充质转变促进食管肿瘤细胞转移,而沉默CCNB1可以抑制食管肿瘤细胞的侵袭和转移。Liu等[27]研究发现在结直肠癌中CCNB1通过降低Sox2ot的表达和间充质蛋白N-钙黏蛋白的表达,同时增加细胞上皮蛋白E-钙黏蛋白的表达,从而抑制结直肠癌肿瘤细胞迁移和侵袭。王璞等[21]研究发现沉默CCNB1基因能够抑制人口腔鳞癌细胞增殖、侵袭和迁移,其作用机制可能与抑制PI3K/Akt信号通路的激活有关。
CCNB1作为普遍存在的原癌基因,其高表达往往意味着更差的预后。在Kaplan-Meier Plotter数据库的分析验证了这一观点,在多种癌症类型中,CCNB1高表达均会导致患者预后更差,且在膀胱尿路上皮癌中,CCNB1表达水平是其预后的独立危险因素。CCNB1是如何影响癌症患者预后,其具体作用机制尚不清楚,目前认为这可能与CCNB1能够促进细胞增殖和促进肿瘤组织上皮-间叶转化(epithelial mesenchymal transition,EMT)有关[28],EMT过程能够明显增强肿瘤细胞侵袭和转移能力;可能与CCNB1能够激活p53信号通路[29]、细胞周期通路和PI3K/Akt 信号通路等癌症通路有关。在对CCNB1在膀胱癌中的GSEA富集分析中,本研究发现CCNB1可能通过影响细胞周期、嘧啶代谢、剪接体、蛋白酶体和DNA复制等信号通路从而影响膀胱癌的增殖、转移等,进而影响膀胱癌患者的预后(图5A)。
肿瘤浸润淋巴细胞指具有高度异质性的淋巴细胞亚群,包括T细胞,少量的B细胞、自然杀伤细胞、巨噬细胞和树突状细胞等[30],不同的细胞亚群在肿瘤微环境中发挥着不同的作用。其包含具有正向调节免疫应答的免疫细胞,如树突状细胞、CD8+细胞毒性T淋巴细胞、自然杀伤细胞等[31],其通过对肿瘤细胞的识别、杀伤和清除,实现肿瘤免疫应答,也包含具有负向调节免疫应答的免疫细胞,如肿瘤相关巨噬细胞、调节性T髄细胞、源性抑制细胞等,其会分泌大量的免疫抑制细胞因子和生长因子,如IL-6、IL-10、VEGF等,抑制上述DC、CD8+细胞毒性T淋巴细胞、自然杀伤细胞的激活,从而使肿瘤细胞逃脱免疫监视,最终导致肿瘤形成、侵袭与转移[32]。免疫治疗是一种通过增强免疫系统功而达到对抗肿瘤的治疗方式,其中免疫细胞在抗肿瘤免疫中发挥着重要作用,而肿瘤浸润T淋巴细胞是免疫治疗过程中最重要的效应细胞类型,主要包括以下亚型:CD8+细胞毒性T淋巴细胞、CD4+T辅助淋巴细胞(Th)、CD45RO+记忆T细胞和FOXP3+调节细胞(Tregs)等,其中CD8+T淋巴细胞在抗肿瘤免疫中起核心作用[33]。通过探究CCNB1与肿瘤免疫浸润细胞的相关性,本研究发现CCNB 1表达与5种肿瘤的6种免疫浸润细胞有显著相关,包括B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞,且在同一肿瘤的不同免疫浸润细胞,CCNB1的调控作用不同,比如在膀胱癌中CCNB1促进CD8+T细胞、树突状细胞和中性粒细胞的浸润水平,抑制B细胞和CD4+T细胞的浸润水平。在不同肿瘤间CCNB1所起的调控作用也不同,在肺腺癌中,CCNB1表达水平抑制B细胞、CD4+T细胞、巨噬细胞和树突状细胞的浸润水平;而在肝细胞癌中,CCNB1表达水平促进B细胞、CD4+T细胞、巨噬细胞和树突状细胞的浸润水平。进一步分析CCNB1与6种免疫细胞22种亚型的相互作用,本研究发现CCNB1与多种肿瘤的Act-CD4+T细胞显著负相关,而与Mast Acting细胞显著正相关,且在膀胱癌中CCNB1与免疫细胞Th2 细胞显著正相关。目前研究认为,Th1细胞和Th2细胞都能分泌细胞因子促进自身的增殖并抑制对方的增殖,因此在正常情况下机体中Th1细胞和Th2细胞处于相对平衡的状态,当Th1细胞和Th2细胞平衡失衡且Th2 细胞占优势状态时,可能会导致肿瘤免疫逃亡[34]。这提示CCNB1可能通过影响膀胱癌中Th1细胞和Th2细胞的平衡性,并使Th2 细胞处于优势状态,从而影响患者预后。以上发现表明CCNB1可以调控肿瘤免疫浸润细胞的浸润水平,从而影响肿瘤患者的生存状况。许多学者的研究证实了以上观点,Geng等[35]通过对8 600名患者的Meta分析显示,肿瘤基质中高水平CD4+T淋巴细胞浸润在肺癌患者中表现出更好的预后。一项涉及4942 名胃癌患者的Meta分析显示,瘤内CD8+和CD3+T细胞的高度浸润与延长的OS显著相关[35]。Chen等[36]对566例食管鳞状细胞癌患者的研究表明,上皮内CD4+T淋巴细胞的浸润明显高于肿瘤基质区,上皮CD4+淋巴细胞的浸润与较长的OS显著相关,而CD3+和CD8+T淋巴细胞的浸润均与食管鳞状细胞癌患者的预后无关。Cai 等[37]发现肝癌瘤内DC的高浸润度提示较高的DFS,瘤内CD45+细胞、CD3+T细胞及CD8+T细胞浸润均与延长的DFS密切相关。
膀胱癌是泌尿系肿瘤中最常见的肿瘤,先前的泛癌分析提示CCNB1在膀胱癌发生、发展中有着独特的作用,本研究在UALCAN数据库的分析表明,CCNB1与膀胱癌多种临床特征均有相关性,包括疾病分期、淋巴结转移状态、吸烟与否和年龄。比较特别的是,基于TCGA数据库408例膀胱癌研究发现CCNB1在吸烟者中较非吸烟者中表达并无差异,表明吸烟可能并不会影响CCNB1的表达,吸烟是膀胱癌发生的独立危险因素,但可能不是影响CCNB1表达和其下游通路来实现的。CCNB1是否能作为膀胱癌新的预测因子,这是本研究一直很关注的问题,基于TCGA数据库408例膀胱癌患者的RNA-seq数据和临床病理数据,经由多因素Cox分析,本研究发现CCNB1是膀胱癌预后的独立危险因素,这预示CCNB1可作为膀胱癌新的预后因子。另外,淋巴血管侵犯也是膀胱癌预后的独立危险因素。
膀胱癌预后较差,且易复发。本研究已证实CCNB1与患者预后有关,且为膀胱癌预后的独立危险因素。为了进一步探究CCNB1高表达导致膀胱癌患者更差的预后的作用机制,本研究首先从单细胞转录测序方向研究CCNB1作用于膀胱组织的细胞群,发现CCNB1作用的细胞群除了本研究熟知的膀胱细胞和膀胱尿路上皮细胞外,还作用于内皮细胞和白细胞,具体机制尚需进一步探究;另外,Tabula Muris数据库是一个小鼠的单细胞数据库,在人类的膀胱癌发生、发展中,其作用机制可能会有所不同。之后本研究探究了调控CCNB1表达相关的miRNA和其作用的下游通路,通过miRNACancer数据库[38]、TargetScan Human数据库[39]和ENCORI数据库[40]联合预测最终发现hsa-miR-139-5p负向调控CCNB1激活p53信号通路和细胞周期通路两条癌症通路,从而影响膀胱癌的发生、发展,这与Anna等[24]的研究结果基本一致,其研究发现CCNB1激活 p53和Rb通路从而促进膀胱尿路上皮癌肿瘤细胞的高增殖。p53信号通路和细胞周期通路均为经典的癌症通路p53信号通路主要参与抑制细胞周期进程,分化和加速DNA修复,基因毒性和细胞应激后的衰老等生物过程[41],而细胞周期通路主要参与细胞周期进程、细胞分化、细胞凋亡等生物过程。
综上所述,CCNB1可影响泛癌预后,可作为泛癌的预后生物标志物,并与免疫浸润相关,这些发现可能提供一种基于免疫的抗肿瘤策略。另外,对膀胱癌组织公共数据集的分析表明,CCNB1高表达与膀胱癌患者的不良预后有关,且为膀胱癌患者的独立预后因素,其可能通过调控几种典型的癌症相关通路从而影响膀胱癌的发生、发展。
