高炉粉尘还原提锌的热力学分析与试验研究
2022-11-05解成成
杨 陶,高 鹏,刘 崇,解成成,刘 纲,张 剑
(1 马钢股份公司炼铁总厂,安徽 马鞍山 243011;2 河钢材料技术研究院,河北 石家庄 050023;3 清华大学信息国家研究中心,北京 100084;4 江阴兴澄特种钢铁有限公司,江苏 无锡 214429;5 河钢承德钒钛新材料有限公司,河北 承德 067102)
1 前言
高炉粉尘中Zn、Fe 等有价资源再利用是一个重要课题。美国环保部门在1976年就开始制定相关法律,将含铅、锌等成分的粉尘定性为有毒固体废弃物,必须对粉尘中的铅、锌等进行回收或是钝化处理方可排放[1-2]。由此,含铅、锌的有毒固体废弃物的综合利用受到了国内外钢铁企业的重视,成为冶金行业研究的热点问题。
转底炉是用于回收粉尘中的锌、铅等资源的冶金设备,高炉粉尘经混合—配料—成型—还原等工序脱除其中的铅、锌等有害成分后生产直接还原铁,直接还原铁可作为原料生产合格的铁水[3]。转底炉工艺的优点在于对能源要求低,效率高,且能回收尘泥中的铁、锌等有价资源[4]。于淑[5]等开发了利用转炉热环境、兑铁后铁水罐的余热和高炉铁水的物理热处理高炉粉尘团块技术,实现了在不引起高炉锌富集的前提下高炉粉尘的高效利用。张丙怀、郭兴忠[6]等对某厂电炉粉尘进行了探索性的铝浴熔融还原实验,得到含ZnO 91%的锌产品和含铅15%以上的渣,脱锌率在90%以上,基本上实现了锌、铅的分离。本文以烧结除尘灰、重力灰和布袋灰为原料,并对ZnO的还原热力学进行理论计算与分析,最后结合热态试验考察还原温度、配碳量等因素对含铁尘泥金属化率和脱锌率的影响程度,为高炉粉尘的资源化利用提供科学的数据支撑。
2 试验原料
以布袋灰、烧结除尘灰、重力灰为原料,3 种原料的化学成分如表1所示。由表1可知:3种原料主要为Fe、Ca、Al、Si 的氧化物,且均含有一定量的有害成分,如Na、K、Zn 等,限制了高炉灰的资源化利用。另外,碳在高炉布袋灰的含量高达21.7%,烧结灰中含有较高比例的CaO,且3 种原料中均含有较高的铁,若将此3种含铁粉尘按照一定的配比制成冷固球团,在回收粉尘中的有价成分的同时具有明显的环境效益[7]。
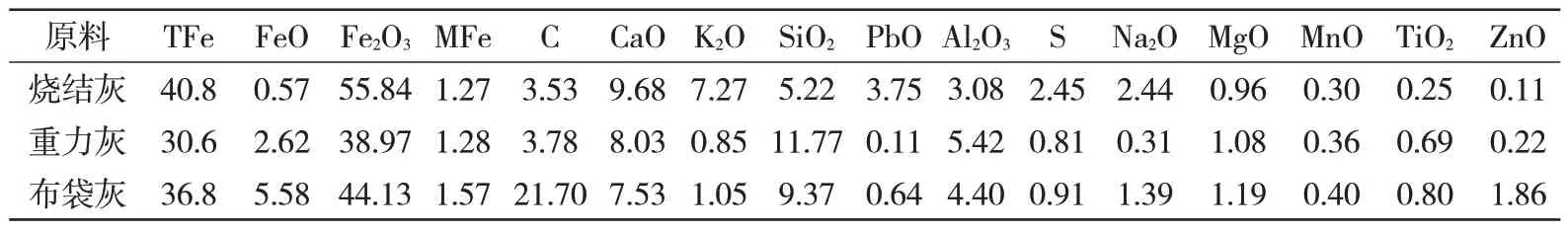
表1 高炉粉尘的化学成分(质量分数)%
3 高炉粉尘还原提锌过程热力学基础计算
3.1 高炉粉尘还原提锌热力学计算与分析
含铁尘泥中氧化物间的热力学反应条件是还原脱锌的前提,同时也是进行热态实验的理论基础。因此,必须对可能进行的反应进行热力学分析,从而确定尘泥还原脱锌过程的最佳工艺。
首先,对尘泥中可能存在的化学反应进行标准自由能变化(△rGθ)与温度(T)的关系以及反应焓(△H)进行分析计算。
由热力学原理可知△rGθ和T的关系式为△rGθ=A+BT[8]。
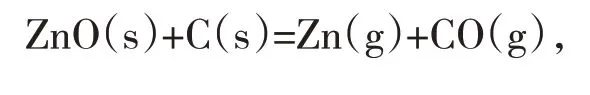
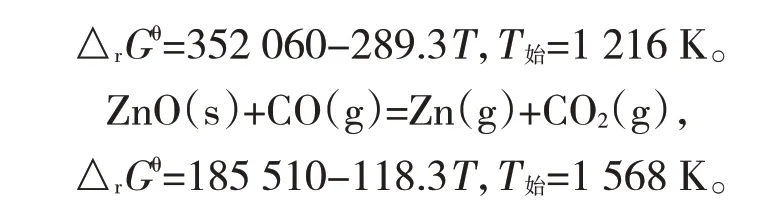
由上式可知,氧化锌的直接还原温度低,此时受界面化学反应的控制,活化能大,反应速度慢,所以反应只有在1 216 K以上才能顺利进行。升高温度,不仅有利于提高反应速率常数,且能使锌在较低的沸点下迅速汽化,避免循环生成氧化物,形成反应的障碍。
根据尘泥脱锌过程中可能存在的化学反应以及化学热力学关系,可初步确定实验中的热力学条件,即实验控制温度。脱锌的开始进行温度大约在950 ℃,考虑到其他物质还原以及外界环境对脱锌的影响,同时也为了提高脱锌速率,实验温度控制在1 000 ℃以上[9]。
在1 000 ℃的实验温度下,除了氧化锌的还原外,同时也存在多种物质的还原,主要是Na2O、K2O以及铁的各种氧化物的还原。其中铁的氧化物的还原对脱锌过程的影响最为严重且较为复杂,主要原因是铁存在多种氧化物,在反应过程中伴随着铁还原的同时,铁氧化物还存在相互之间的转换,其中铁氧化物的还原顺序为Fe2O3、Fe3O4、FeO。钾、钠、锌的金属性质极其相似,且锌最难还原。因此,高脱锌率的条件下,钾与钠必然也有高的脱除率,在这里假设钾与钠的氧化物被全部还原并且可以挥发脱除。
3.2 高炉粉尘还原提锌过程热力学模拟计算
3.3.1 空气条件下氧化锌的还原过程
采用FactSage 热力学计算得到了温度与锌的焓变值间的关系(见图1)和氧化锌被还原过程中平衡状态时的组分图(见图2)。根据计算可得:锌的熔点为419.7 ℃,沸点为918.47 ℃,这与文献[10]介绍的锌的熔点419.5 ℃和沸点907.97 ℃基本符合。
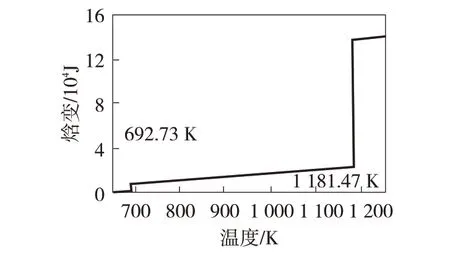
图1 锌的焓值随温度变化规律
由图2 可知,在500 ℃之前主要发生碳的氧化反应,即:C+O2=CO2;500~800 ℃。由于CO 生成,CO2的含量减少,且nCO∶nCO2=2∶1,可知此阶段为CO2的还原,即:C+CO2=2CO;800~900 ℃。由于CO 的生成量和金属Zn 的挥发量相同,即:ZnO+C=Zn+CO;随温度继续升高,CO2的生成量又与CO减少量相同,即:CO+ZnO=Zn+CO2,且该反应会持续进行,直至氧化锌被完全还原。
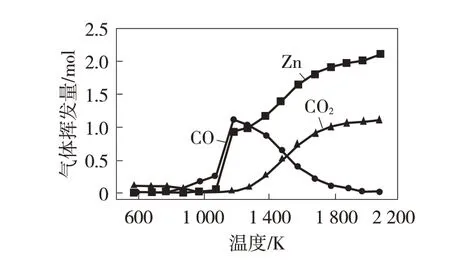
图2 反应平衡时的组分图
从热力学角度分析,氧化锌的还原反应属于吸热反应,温度越高,越有益于还原反应。根据阿累尼乌斯公式,反应温度越低,反应物的分子活性能越小,导致反应速率也越低,因此只有在高于1 000 ℃时,还原反应才能迅速地完成[11]。
3.3.2 不同配碳比下的氧化锌还原过程
根据最小吉布斯自由能原理,通过FactSage 热力学计算得到不同配碳量下ZnO的还原规律,其中计算过程中配碳量(C/ZnO摩尔比)为1∶1.0、1∶1.5、1∶2.0,计算温度区间为500~1 300 ℃。计算结果如图3所示。
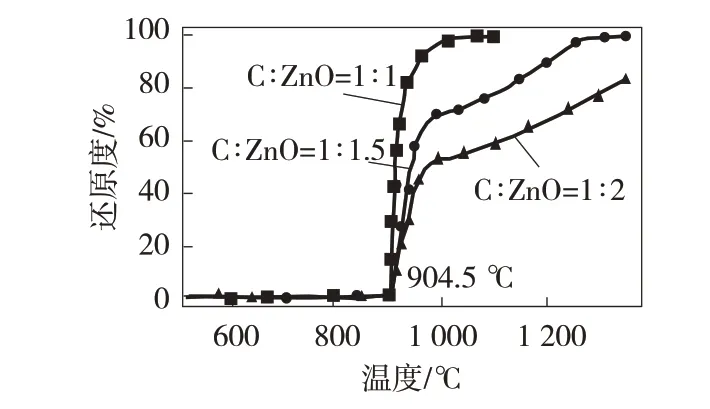
图3 不同配碳比ZnO还原曲线
由图3 看出,ZnO 的还原速率随温度的升高呈现出先增大后减小的变化规律[12],只有高于904.5 ℃时才可发生ZnO(s)→Zn(g)的转变,且随温度的升高,反应物活化分子也逐渐增多,有效碰撞次数增加,促使ZnO的还原速率增大。由图3还可以看出在1 000 ℃时,ZnO 的还原度在C∶ZnO 摩尔比为1∶1.0、1∶1.5、1∶2.0 条件下分别为100%、70.3%、52.6%,并且在1 000 ℃以后,ZnO 的还原过程逐渐达到了平衡状态,使还原速率降低;在温度1 250 ℃时,曲线C∶ZnO为1∶1.5、1∶2时中ZnO还原度分别为97.3%和67.3%,由此ZnO 的还原受配碳量的影响很大,在C∶ZnO=1∶1.5 的条件下,反应能迅速完成[13]。
4 高炉含锌粉尘还原性影响因素分析
以布袋灰、烧结除尘灰、重力灰为原料,按配碳量的差异配成混合物,并添加适量的还原剂、黏结剂和水后用压球机压制成冷固结球团,随后在实验室条件下进行含铁尘泥球团的熔融还原实验。
4.1 实验方法与方案
4.1.1 实验方法
将试样放置于恒温干燥箱中除去其中的水分后研磨至200 μm。将研磨后的原料根据规定的配碳量(1.10、1.15、1.20、1.25、1.30、1.35、1.40、1.45、1.50)进行混合。在配料过程中,按照烧结灰∶重力灰=1.00∶1.00,布袋灰根据配碳量不同按配比加入,同时加入10%的石灰(工业石灰中CaO的理论含量为78%~81%),并配入10%的水,混合均匀后利用压球机压制成Φ20×15 mm 的冷固球团,在蒸汽恒温箱放置3 d之后置于105 ℃的恒温干燥箱中2 h,使球团中的自由水尽可能脱除;然后利用卧式硅碳管高温加热炉在氩气的气氛下升温至预定温度,将球团放入反应皿缓慢推进到加热炉中间部位进行还原反应,将高温反应产物立即放入到盛有无烟煤的密闭容器中冷却至室温。
将实验冷却后的试样称重,并取少许试样用化学分析的方法检测产物中的Fe、Zn的百分含量,球团的金属化率和脱锌率的计算公式如下[14]:

式中:MFe反应前、MFe反应后为反应前、后金属铁的质量;TFe 为反应前全铁的质量;TZnO反应前、TZnO反应后为反应前、后氧化锌的质量。
4.1.2 实验方案
(1)在还原时间为25 min、配碳量为1.1 条件下,探究不同还原温度下球团的金属化率及脱锌率的变化规律,见表2。
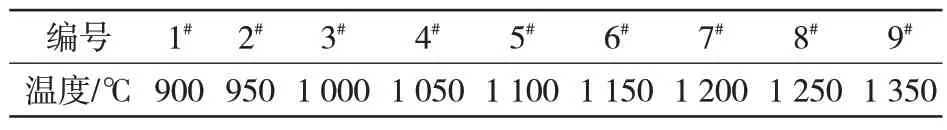
表2 配料完成后球团不同还原温度
(2)在还原温度为1 200 ℃、还原时间为25 min条件下,探究不同配碳量下球团的金属化率及脱锌率的变化规律,见表3。
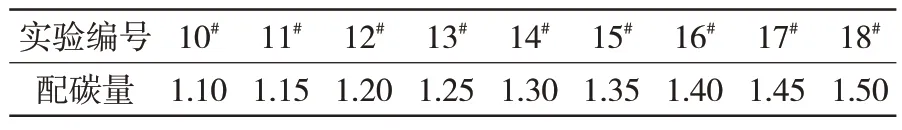
表3 配料完成后球团不同配碳量
4.2 实验结果与讨论
4.2.1 反应温度对球团还原过程的影响
为获得球团的还原程度与温度间的关系,根据表2的实验方案,将n(C)/n(O)=1.10的球团在不同温度下进行还原试验,试验结果如图4所示。
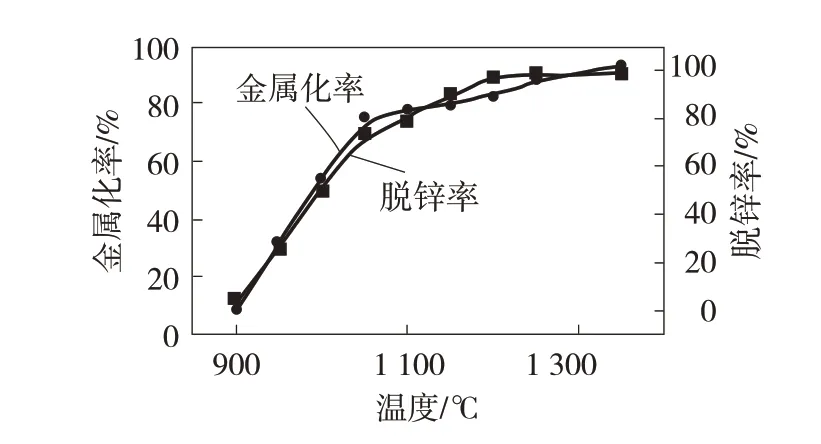
图4 还原温度对金属化率和脱锌率的影响
由图4 可知,还原过程中球团的金属化率、脱锌率随还原温度的升高而增加。在900~1 050 ℃,球团金属化率、脱锌率的增幅较大;球团的金属化率和脱锌率在1 200 ℃条件下分别为82.89%、97.54%,并且在还原温度为1 350 ℃时,球团的金属化率、脱锌率到了非常理想的指标,分别为92.59%、98.36%。分析可得:铁氧化物的还原过程属于吸热过程,且随还原温度的升高,碳的气化反应加剧,有助于铁氧化物还原反应的进行,因而球团的金属化率增大。同样,氧化锌的还原过程也是吸热的,且单质锌的沸点为908 ℃,反应过程中高温下生成的还原产物会很快挥发,温度越高,锌蒸气挥发越快,促进了氧化锌还原反应的进行,球团的脱锌率增加[15]。
4.2.2 配碳量对球团还原过程的影响
为考察球团还原程度受球团配碳量的影响程度,根据表3的实验方案,在1 200 ℃的温度下不同n(C)/n(O)比的球团还原25 min,结果如图5所示。
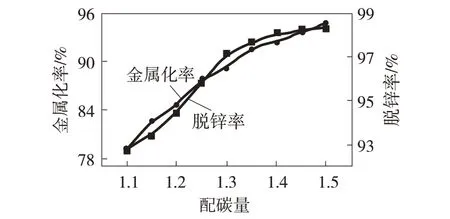
图5 配碳量对金属化率和脱锌率的影响
由图5分析可知,球团金属化率与脱锌率随配碳量的增加而增加,在n(C)/n(O)>1.40后,球团的金属化率和脱锌率增幅不明显。分析认为当n(C)/n(O)>1.40后,球团表面在高温反应过程中极易产生微细裂纹,造成CO外溢,致使在球团内部的分压降低,对还原过程产生不利影响。因此,球团的金属化率和脱锌率在n(C)/n(O)>1.40时变化不明显,且球团配碳量过大时,还会造成产物中残碳比例增加,不利于大规模工业化生产过程渣相的分离及金属颗粒的聚集[16]。综上,虽然增加配碳量可大幅提高尘球团的金属化率与脱锌率,但并不是配碳量越高越好,含铁粉尘球团的最佳配碳量为n(C)/n(O)=1.40。
5 结论
5.1 氧化锌的还原过程分为4 个阶段。500 ℃之前,以碳的氧化反应为主;500~800 ℃,主要发生布多尔反应,C+CO2=2CO;800~900 ℃,发生反应为ZnO+C=Zn+CO;900 ℃以后主要发生反应CO+ZnO=Zn+CO2。
5.2 在904.5 ℃时才能实现ZnO(s)→Zn(g)的热力学转变,在温度1 000 ℃甚至更高时,氧化锌才能迅速被还原。
5.3 球团的金属化率、脱锌率均随着还原温度的升高而增大,且球团金属化率、脱锌率在1 200 ℃下分别为82.89%、97.54%,此时氧化锌基本上被还原并脱除,还原效果比较理想,建议将还原反应温度控制在1 200 ℃。
5.4 随配碳量的增加,球团金属化率、脱锌率增大,当n(C)/n(O)>大于1.4 时,球团金属化率和脱锌率增幅不显著,因此为取得良好的效果,建议将配碳量控制在1.4。
