长链非编码RNA在神经退行性疾病中作用机制的研究进展
2022-11-05武世萍巩盼盼王满侠
武世萍,俞 坤,巩盼盼,王满侠
(兰州大学第二医院,中国甘肃 兰州 730030)
随着人类基因组计划的完成,人们发现只有 不到5%的基因是由编码序列组成的,而大部分基因缺乏编码蛋白质所需的开放阅读框(open reading frame,ORF),故不能翻译为蛋白质[1]。一般情况下,根据转录本长度是否小于200个核苷酸,非编码RNA(non-coding RNA,ncRNA)可分为短链非编码RNA和长链非编码RNA(long non-coding RNA,lncRNA),短链非编码RNA包含转移RNA(transfer RNA,tRNA)、核糖体 RNA(ribosomal RNA,rRNA)等,主要在基因表达过程中发挥重要作用,而lncRNA是转录本长度大于200 nt的具有特定二级结构的ncRNA,多位于细胞核或胞质内[2]。由于此前认识不足,lncRNA一直被认为是基因转录过程中的“噪音”,其生物学价值未被重视。近10余年来,随着芯片灵敏度和二代测序技术的提高,超过50 000个人类lncRNA基因组被发现,这引起了分子生物学领域的高度关注[3]。现有研究发现,lncRNA与包括自身免疫性疾病、恶性肿瘤在内的多种人类疾病的发病机制相关[4~5]。神经退行性疾病(neurodegenerative diseases,NDDs)是一类以大脑和脊髓神经元细胞丧失为特征的疾病,包括阿尔茨海默病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)、肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)、多发性硬化(multiple sclerosis,MS)及亨廷顿病(Huntington disease,HD)等[6]。在不同NDDs发生发展过程中,研究人员观察到lncRNA似乎发挥着重要的调控功能[6~7]。本文将简要介绍lncRNA起源、分类及可能的生物学功能,重点总结lncRNA在临床常见NDDs中可能发挥的作用机制的研究进展,以期加深人们对lncRNA生物学作用和NDDs发病机制的认识,为其诊断及治疗提供新思路。
1 lncRNA生物起源、分类及可能的作用机制
lncRNA的生物起源至今仍不清楚,大多数lncRNA是由RNA聚合酶Ⅱ(polymerase Ⅱ,pol Ⅱ)低效转录产生的,其处理过程与mRNA生成相似,也形成5′端帽结构和3′端多聚腺苷尾结构[8]。因lncRNA在哺乳动物中具有低序列保守性及快速进化的特点,故学者们对其起源提出如下假说:1)蛋白质编码基因在复制过程中发生变形产生;2)由其他ncRNA基因的片段或全基因复制演化而来;3)通过从头生成产生,如染色体重排;4)转座因子(transposable elements,TEs)的插入[9]。近年的研究发现,lncRNA具有与mRNA不同的转录、加工、输出和周转方式,这可能与lncRNA的细胞命运和功能密切相关[8]。
lncRNA的分类依据目前仍存在争议,业界认为应优先考虑转录产物的大小及定位,其次是功能[10]。根据lncRNA与蛋白质编码基因的相对位置和转录模式,其可分为4种不同类型:基因间区长非编码RNA(long intergenic non-coding RNA,lincRNA)、内含子lncRNA、重叠lncRNA及双向lncRNA[7,10]。对lncRNA分类的研究或许有助于其生物起源及生物学功能的理解。
研究发现,lncRNA通过与DNA、RNA和蛋白质相互作用,调节染色质的结构和功能以及编码基因的转录,并可以影响核糖核酸的剪接、稳定性和翻译[8]。其可能的作用方式有:1)与染色质修饰复合物相互作用,充当染色质修饰物的支架;2)与转录因子相互作用激发转录;3)作为响应信号特定地刺激或抑制转录;4)结合调控蛋白作为引导RNA,引导调控蛋白到特定位点进行染色质修饰;5)作为特定基因增强子和启动子之间的桥梁,激活转录;6)其他,即作为RNA加工过程的调节因子等[8,11]。lncRNA调控机制繁杂,其生物学功能的识别是分子生物领域一大挑战。
2 lncRNA与中枢神经系统
全基因组转录研究表明,约有40%的lncRNA基因在中枢神经系统(central nervous system,CNS)中特异表达,参与CNS的发育及病理过程[12]。CNS的发育是一个复杂且高度定型的过程,研究已证实,lncRNA从早期神经分化到晚期突触发生都发挥了不可或缺的作用,包括神经胚层分化、神经元-胶质细胞命运决定、突触发生、突触可塑性和强度的构建等[12~14]。例如:内胚层相关lncRNA1(definitive endoderm-associated lncRNA1,DEANR1)通过积极调节内胚层因子FOXA2的表达可促进内胚层分化[14];转移相关的肺腺癌转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)是一种有助于神经轴突细化的lncRNA,可促进突触发生相关基因的转录[13]。除此以外,研究人员还发现,lncRNA与CNS不同类型的病理过程密切相关,如脑血管病、神经精神障碍(neuropsychiatric disorder,NPD)、神经胶质瘤、NDDs等,意味着这些尚未被充分理解的转录本在CNS疾病中也具有重要作用[11,15~16]。下面将着重介绍lncRNA在NDDs中的研究进展。
3 lncRNA与神经退行性疾病
NDDs是大脑特定神经元群体及其联系功能进行性丧失而引发的病理状态,随着人口老龄化的到来,其患病率呈逐年上升趋势,尽管医疗技术的发展日新月异,但仍无有效治疗措施,临床治疗主要以延缓疾病进展为主[11,17]。研究发现,lnc-RNA的异常表达或者基因突变与NDDs有一定关联,研究两者之间的关系对理解NDDs的发生发展具有重要意义,并有可能在未来为此类疾病的治疗提供思路。表1是几种临床常见NDDs中主要失调的lncRNA及调节作用。
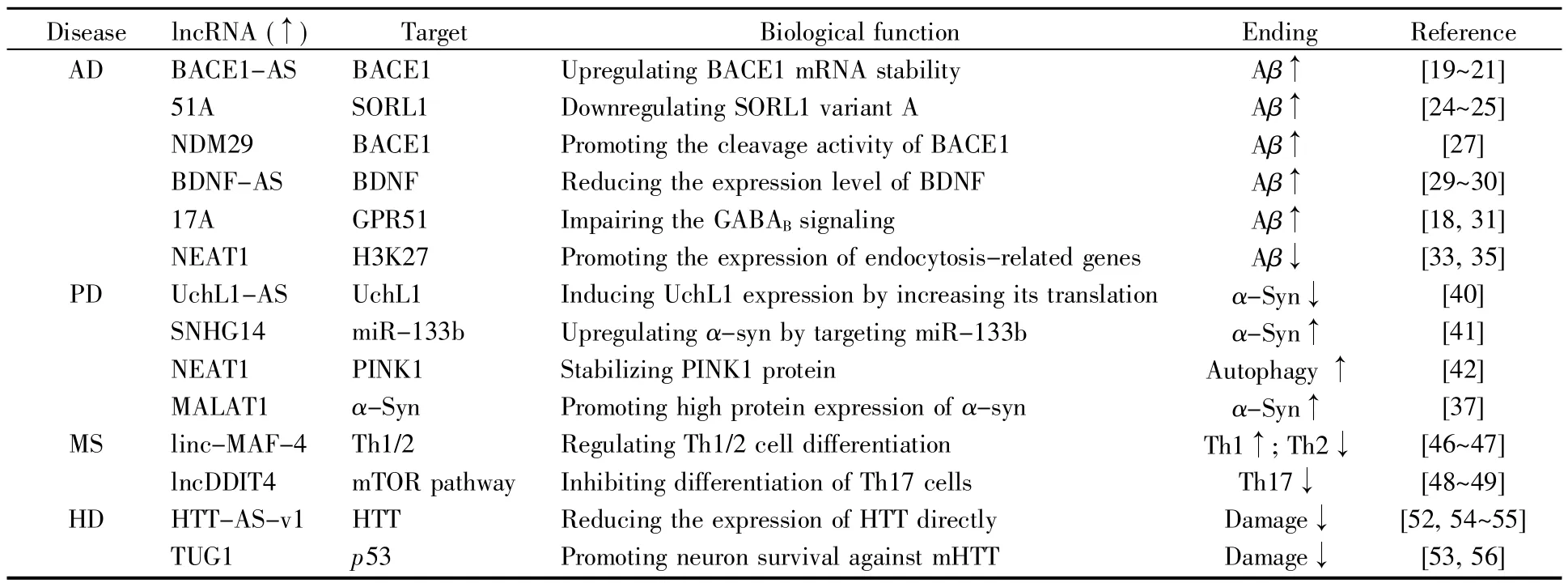
表1 常见神经退行性疾病中表达失调的lncRNATable 1 Dysregulated lncRNAs in common NDDs
3.1 lncRNA与阿尔茨海默病
AD是一种以细胞外β淀粉样蛋白(amyloid β-peptide,Aβ)沉积、神经原纤维缠结(neurofibrillary tangle,NFT)形成、神经元丢失、突触性和营养不良性神经炎为病理特征的典型NDDs[18~19]。AD已成为老年人痴呆的最常见原因,也是致死的主要原因;据估计,到2050年,全球AD患者将达8 000万之多,这将显著增加社会负担[18~19]。lncRNA在AD发生发展中的机制是近年研究的热点,现已发现多种lncRNA参与调节Aβ沉积、神经炎症、突触功能衰竭、神经营养因子消耗等AD病理改变过程[18],其中研究最为深入的是lncRNA与Aβ异常沉积的关系。
Aβ斑块的形成是淀粉样前体蛋白(amyloid precursor protein,APP)被β位点APP裂解酶1(βsite APP cleaving enzyme 1,BACE1)和 γ-分泌酶连续蛋白水解切割的结果,BACE1的失调可引起Aβ过度产生,导致AD发生[18]。β位点APP裂解酶1反义RNA(β-site APP cleaving enzyme 1 antisense RNA,BACE1-AS)是11号染色体(11q23.3)上BACE1基因的反义转录本。研究发现,BACE1-AS在mRNA和蛋白质水平上调节BACE1的表达,BACE1-AS可与BACE1 mRNA配对形成RNA双工,增强BACE1 mRNA稳定性,进而通过转录后前馈机制增强APP加工和毒性Aβ生成[19]。Liu等[20]发现,在AD患者及Aβ诱导的AD细胞模型中,BACE1-AS和BACE1 mRNA的表达较对照组均增加,BACE1-AS的沉默可使细胞中BACE1的表达在mRNA和蛋白质水平上显著降低。Feng等[21]对88名AD患者和72名健康对照血浆中的4个lncRNA水平进行了测定,发现BACE1在AD患者组特异性升高(P=0.006),受试者操作特征(receiver operating characteristic,ROC)曲线提示,相较于其他lncRNA,BACE1为最佳候选者。而Fotuhi等[22]比较了45名AD患者和36名健康对照血浆中的BACE1-AS水平,发现AD患者组BACE1-AS水平与对照组并无显著差异(P=0.41),这与上述Feng等[21]的研究结论并不一致,而且此研究还发现,AD患者BACE1-AS的水平与简易精神状态评价量表(mini-mental state examination,MMSE)评分高低有关,MMSE≥20的AD患者血浆BACE1-AS水平显著降低,而 MMSE<20的患者血浆BACE1-AS水平显著高于对照组。以上研究提示,BACE1和BACE1-AS在血浆中稳定存在,是AD非常有潜力的生物标志物;但是,可能与病情进展、样本量不足等因素相关,研究结果并未获得良好的一致性,未来需要更多的临床研究证实其临床价值。
51A是一种由RNA聚合酶Ⅲ(polymerase Ⅲ,pol Ⅲ)转录的长度约300 nt的lncRNA,由人sortilin相关受体1(sortilin-related receptor 1,SORL1)基因的反义构型转录而来[23~24]。SORL1亦称为LR11或SORLA,是低密度脂蛋白受体家族中一员,在神经元中大量特异性表达。AD患者脑脊液中SORL1的表达水平降低,SORL1表达的减少或缺失会影响APP的运输及蛋白水解切割,促进神经毒性Aβ的产生[24]。研究发现,51A在大脑皮质中高表达,其通过与SORL1前mRNA的内含子配对结合,发生选择性剪接(alternative splicing,AS)事件,导致典型SORL1蛋白产量减少和选择性变体产量增加,引起APP加工受损和Aβ生成增加[25]。一项研究表明,散发性AD患者血浆51A的表达较健康对照组明显上调(P<0.001),提示这种lncRNA有作为AD生物标志物的可能价值;而且,该研究还发现其表达水平与MMSE评分呈负相关(P<0.001),提示其与AD严重程度存在一定联系[26]。
神经母细胞瘤分化标志物29(neuroblastoma differentiation marker 29,NDM29)也是一种由RNA pol Ⅲ转录的lncRNA,炎症刺激可促使其表达增加,与年龄匹配的对照组相比,NDM29在AD患者的大脑皮质中表达增强,这表明NDM29与AD发病可能相关[19]。从机制上来说,高水平的NDM29会使APP在mRNA及蛋白质水平表达增加,同时可使BACE1的切割活性增强,进而促进两种主要的Aβ异构体Aβ42和Aβ40的产生,并且明显升高Aβ42/Aβ40比值,而Aβ42是AD病理斑块的主要组成成分[27]。综上可知,NDM29与AD发病机制有一定关联,可增加毒性Aβ的产生。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是哺乳动物大脑中非常重要的神经营养因子之一,与突触功能、神经发生和认知功能密切相关,可使神经元免受损伤并促进受损神经元修复[28]。相关证据表明,BDNF可能通过激发非淀粉样蛋白生成加工途径来调节APP生成,从而减少Aβ的产生[29]。lncRNA BDNF-AS是BDNF的天然反义转录物,可通过改变BDNF的染色质结构来抑制BDNF mRNA转录位点,使BDNF表达水平降低,促进神经毒性Aβ的产生[30]。针对BDNF-AS/BDNF mRNA/BDNF信号通路的研究或许能为AD的药物研发提供新的思路。
17A是依赖于RNA pol Ⅲ的lncRNA,可嵌入人G蛋白偶联受体51(G-protein-coupled receptor 51,GPR51)基因内含子3的反义方向,影响GPR51选择性剪接(AS),并促进γ氨基丁酸B型受体2(γ-aminobutyric acid type B receptor 2,GABABR2)可选择性和非功能性剪接异构体的形成,降低GABABR2典型异构体的转录,这一事件显著损害了GABAB信号通路,使Aβ分泌增强,并以增加Aβ42/Aβ40比值为主[18]。Massone 等[31]报道,17A 在AD患者脑中响应炎症刺激而表达增加,从而促进Aβ分泌并增加其积累,提示其可能直接或间接参与了AD的发病机制。
核富集丰富转录本1(nuclear paraspeckle assembly transcript 1,NEAT1)是人11号染色体特定位点转录产生的lncRNA,分为NEAT1-1(3.7 kb)和 NEAT1-2(22.7 kb)两种亚型[32]。Wang 等[33]研究发现,NEAT1下调通过抑制内吞相关基因的表达减少介导Aβ清除的神经胶质细胞。具体机制为:NEAT1-1沉默使得内吞相关基因转录起始位点附近组蛋白H3K27乙酰化(H3K27Ac)下调和H3-K27巴豆酰化(H3K27Cro)上调,并介导转录因子STAT3与H3K27Ac相互作用,降低多个相关基因的表达,从而削弱内吞作用,造成Aβ清除减少、沉积增加。但Zhao等[34]的研究却发现,NEAT1在AD小鼠模型中显著上调,而miR124显著下调,敲除NEAT1或过表达miR124对Aβ诱导的AD模型具有保护作用,说明NEAT1可能通过调节miR-124在AD的发展中发挥作用。Ke等[35]还发现,NEAT1可以作为miR-107的“分子海绵”,使Aβ诱导的神经元损伤加重。总之,以上研究提示,NEAT1通过多种作用机制参与Aβ的代谢过程,与AD发病密切相关,可能为AD的诊断及治疗提供新的研究靶点。
除此以外,脑胞质200(brain cytoplasmic 200,BC200)、Sox2重叠转录本(Sox2OT)等 lncRNA 也可通过特定的作用机制参与AD的发生发展[19]。总之,近几年来,针对lncRNA与AD关系的研究结果得到很多关注,lncRNA这一新型分子的发现对于揭示AD潜在发病机制具有极其重要的意义,有益于药物研究的发展和临床诊治水平的提升。
3.2 lncRNA与帕金森病
PD是第二常见的进展缓慢的NDDs,影响2%~3%的65岁以上人群。此病主要特征是黑质-纹状体系统多巴胺能神经元进行性变性,导致纹状体多巴胺缺乏,继而引起运动功能障碍。PD主要临床运动症状包括静止性震颤、肌张力增高、运动迟缓和姿势不稳,这也是其临床诊断的基石[36]。迄今为止,该疾病都不能得到充分的治疗,现用药物只能缓解症状和延缓进展[37]。近年来,研究发现,大量lncRNA在PD患者和PD实验模型中差异表达,它们通过影响α-突触核蛋白(α-synuclein,α-syn)沉积、溶酶体自噬系统、多巴胺神经元凋亡、神经炎症等方面参与PD发病机制[37~38]。
泛素羧基末端水解酶L1(ubiquitin carboxyterminal hydrolase L1,UchL1)是一种神经元限制性蛋白,作为去泛素化酶或单泛素稳定剂发挥作用,UchL1基因突变已被报道与家族性PD密切相关,并且有报道称PD患者脑中Uchl1蛋白出现氧化失活[39]。lncRNA UchL1-AS是UchL1的反义转录本,在多巴胺能神经元的细胞核中含量丰富,它是SINEUPs(上调翻译的SINEB2序列)的代表成员,可以在转录后水平增加UchL1的蛋白质合成,进而参与PD发病过程[40]。Zhang等[41]发现,在PD动物模型中lncRNA SNHG14的表达水平升高,沉默的SNHG14可以通过miR-133b下调α-syn生成和聚集,减轻多巴胺能神经元损伤,改善PD的病理状态。磷酸酶和张力素同源物诱导的激酶1(phosphatase and tensin homologue-induced kinase 1,PINK1)是PD相关的易感基因,其缺失或过表达可导致多巴胺释放受损和运动缺陷,naPINK1是PINK1基因座特异性反义转录本,可以稳定PINK1的表达,调控线粒体氧化应激[7]。Yan等[42]的研究发现,lncRNA NEAT1可通过稳定PINK1蛋白,促进1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的PD小鼠的自噬,从而减轻多巴胺能神经元的损伤。此外,MALAT1可与α-syn结合,增强其稳定性,导致α-syn表达增加;同时也能充当miR-124-3p与miR-129的“分子海绵”,参与调控PD神经元凋亡[37]。多种lncRNA通过特定的通路在PD的病理过程中发挥重要作用,这使得lncRNA有望成为PD早期检测的生物标志物,并可为PD靶向治疗的发展提供新思路。
3.3 lncRNA与多发性硬化
MS是一种主要由细胞免疫介导的CNS慢性炎性脱髓鞘疾病。MS发病机制不明,全球患病人数200~300万,是目前青壮年神经系统非创伤性残疾的最常见原因[43]。已有研究表明,lncRNA失调在炎症和自身免疫性疾病的发病机制中发挥关键作用[44]。近年来,研究人员在MS患者及体外模型中也发现了异常表达的lncRNA,并发现lncRNA主要通过调控CD4+辅助性T细胞(helper T cell,Th cell)的分化参与MS发病机制[45]。
linc-MAF-4是一种染色质相关的CD4+Th1特异性lincRNA,其表达水平与Th2相关的转录因子MAF的表达呈负相关[46]。Zhang等[47]对MS患者和健康对照组的外周血单个核细胞进行了微阵列分析,发现MS组的linc-MAF-4表达明显高于对照组;进一步将合成的linc-MAF-4转染初代CD4+T细胞,发现linc-MAF-4可通过抑制Th2细胞的转录因子MAF,促进Th1细胞分化,抑制Th2细胞分化,进而促进MS发生。DNA损伤诱导转录因子4(DNA-damage-inducible transcript 4,DDIT4)是一种高度保守的应激反应基因,为lncDDIT4顺式调控的候选靶点,MS大规模全基因组关联研究发现lncDDIT4高表达[48]。研究证明,lncDDIT4的过表达通过增加CD4+T细胞中DDIT4 RNA的表达并降低DDIT4-哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路的激活,抑制Th17细胞分化,而Th17细胞的异常分化与MS密切相关[49]。Cardamone等[50]的体外细胞实验显示了lncRNA MALAT1在调节MS相关的AS事件方面的作用,提示它参与了MS发病机制。MALAT1可参与炎症反应过程,CD4+T细胞中MALAT1低表达可刺激T细胞向致病性Th1和Th17表型分化,抑制调节性T细胞(regulatory T cell,Treg)分化,这有可能是其参与MS发病的作用机制,但需要相关研究进一步证实[45]。Shaker等[51]检测了MS患者血清MALAT1表达水平,发现患者血清MALAT1水平相较于对照组显著升高,并且在复发缓解型MS患者中升高得更明显,提示其水平可能与MS病程及进展相关。此外,HOX转录反义基因间RNA(HOX transcript antisense intergenic RNA,HOTAIR)、INK4位点的反义非编码RNA(antisense non-coding RNA in the INK4 locus,ANRIL)、生长抑制特异性转录本5(gowth arrestspecific transcript 5,GAS5)等lncRNA也与MS发病机制存在一定关联[45]。以上研究结果表明,lnc-RNA主要通过调控炎症细胞的分化参与MS的发病机制,提示lncRNA有作为MS生物标志物的潜力,相关信号通路的研究也可能为MS的靶向治疗提供理论依据。
3.4 lncRNA与亨廷顿病
HD是亨廷顿蛋白(huntingtin,HTT)编码基因的多聚谷氨酰胺区(polyglutamine,polyQ)胞嘧啶-腺嘌呤-鸟嘌呤(cytosine-adenine-guanine,CAG)重复序列的异常扩增导致的常染色体显性遗传病,临床以认知功能障碍、手足舞蹈病和精神障碍为特征[52]。一项微阵列数据分析显示,HD患者大脑中存在数个表达失调的lncRNA,比如HTT反义转录物(antisense transcript of HTT,HTT-AS)等,提示lncRNA可能与HD发病相关[53]。
HTT-AS可交替剪接成HTT-AS-v1和HTTAS-v2两种类型。内源性HTT-AS-v1已被证实在体内对HTT有直接的调节作用,降低HTT-AS-v1的表达可导致内源性HTT表达增加20%,相反,HTT-AS-v1的过表达使内源性HTT表达降低约25%,暗示提高HTT-AS表达可能是HD治疗的重要途径[54]。研究发现,lncRNA NEAT1在HD基因敲入小鼠和HD患者纹状体神经元中表达增加,其升高依赖于突变型亨廷顿蛋白(mutant huntingtin,mHTT),这些生物学结局可能与NEAT1和p53相互作用后改变p53稳定性或者NEAT1直接影响蛋白酶体降解有关[52,55]。牛磺酸上调基因1(taurine upregulated gene 1,TUG1)是一种剪接的lncRNA,为一种促生存因子,有研究提示,TUG1可作为p53的下游靶点被上调,从而产生神经元保护作用,使其免受mHTT引起的细胞毒性效应[53,56]。此外,人类加速区1(human accelerated region 1,HAR1)、母系表达基因3(maternally expressed gene 3,Meg3)等lncRNA也与HD发病存在一定联系,但是这些lncRNA在HD患者脑内的表达水平差异较大,具体作用机制也有待进一步研究[53]。2021年,Tan等[57]系统分析了HD患者的基因表达谱数据,筛选出差异表达的490个mRNA和94个lnc-RNA,并建立了mRNA与lncRNA的蛋白质相互作用网络谱,发现竞争性内源RNA(competing endogenous RNA,ceRNA)网络中存在多种转录因子的相互作用,提示lncRNA可能通过控制这些蛋白质编码基因的表达,特别是转录因子的表达,调控HD的发病。该研究为揭示lncRNA在HD中的作用机制提供了新的线索,未来需要进一步的实验来验证上述ceRNA调控网络谱,并阐明其在HD发病机制中的作用。
3.5 lncRNA与其他NNDs
ALS是一种以上、下运动神经元损害为突出表现的慢性进行性疾病,表现为肌肉萎缩、球麻痹和锥体束体征等[58]。2021年,Liu等[59]通过生物信息学分析发现,MALAT1参与调控的SYNRG、ITSN2、AAK1等基因可能与ALS发病机制有密切关系,这为ALS的研究提供了新的视角。额颞叶痴呆(frontotemporal dementia,FTD)是一组以大脑额叶和颞叶前部萎缩为特征的慢性进行性CNS变性疾病[60]。交互反应DNA结合蛋白43(transactive response DNA-binding protein 43,TDP-43)和肉瘤融合蛋白(fused in sarcoma,FUS)在胞浆内异常聚集是FTD的特征[61],充分了解导致TDP43和FUS异常沉积的通路可为FTD的研究提供新思路。脊髓小脑共济失调8型(spinocerebellar ataxia type 8,SCA8)与大脑特异表达的lncRNA ATXN8OS相关,推测与其参与调控临近的蛋白质编码基因KLHL1有关[62]。SCA7由ATXN7基因中胞嘧啶-腺嘌呤-鸟嘌呤(CAG)重复序列异常扩增引起,lncRNA ATXN7L3B可与ATXN7 mRNA相互作用,影响ATXN7表达,提示lncRNA可能参与调控SCA7 发病过程[63]。
4 总结与展望
综上所述,lncRNA作为一大类不编码蛋白质的 RNA,在 AD、PD、MS、HD 等多种 NDDs中发挥重要的调控功能,不同lncRNA可通过多种作用模式,在转录前、转录过程及转录后水平调节与上述疾病有关的基因表达过程,将lncRNA作为NDDs有价值的生物标志物或治疗靶点是值得期待的。虽然目前lncRNA在NDDs发病机制中的确切作用机制仍不甚清楚,但是随着基因调控研究的不断深入和更多生物学方法的涌现,lncRNA生物学功能和分子机制必将被进一步阐明,这将为NDDs的诊断及治疗提供更多的理论指导。