氯鼠酮暴露对斑马鱼胚胎/仔鱼的毒性效应研究
2022-11-05吴元钊俞逸娴徐菀忆应剑波王斌杰王继业姚伟宣
吴元钊,俞逸娴,徐菀忆,应剑波,王斌杰,王继业,姚伟宣*
(1.浙江警察学院浙江省毒品防控技术研究重点实验室,中国浙江 杭州 310051;2.杭州市公安局刑事科学技术研究所,中国浙江 杭州 310004)
抗凝血类灭鼠剂是指通过干扰肝脏对维生素K的利用,阻碍肝脏合成凝血酶原以及抑制凝血酶原和凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的合成,使机体凝血时间和凝血酶原时间延长,造成各个脏器及黏膜出血,从而达到毒杀鼠类的一种灭鼠剂[1~2]。相对于急性剧毒类灭鼠剂,抗凝血类灭鼠剂具有半衰期长、适口性好、灭鼠效率高、毒性作用较为平缓等优点,且对人畜较为安全[3]。我国从20世纪80年代开始大规模推广抗凝血类灭鼠剂,使之逐渐成为生产生活中使用最多的灭鼠剂[4]。尽管抗凝血类灭鼠剂对人畜毒性较低,但其危害也不能忽视。根据美国国家毒物控制中心统计,1987—2018年,抗凝血类灭鼠剂导致的中毒人数平均每年达11 021人[5~6]。在国内,抗凝血类灭鼠剂安全事件也频繁发生。四川大学华西医院在2008—2016年共诊断并治疗了65名抗凝血类灭鼠剂中毒儿童病例[7]。唐玲玲[8]对49例儿童抗凝血类灭鼠剂中毒事件进行了统计分析,发现儿童中毒病例数量呈逐年上升趋势,这可能与抗凝血类灭鼠剂普遍使用以及监管不力密切相关。此外,因使用不规范等,抗凝血类灭鼠剂对环境造成的污染问题也逐渐引起人们的重视。茅海琼等[9]报道了溴鼠灵在水环境突发性污染事故中的药物残留。Regnery等[10]发现,在德国巴伐利亚州,抗凝血类灭鼠剂在下水道排放的污水中普遍存在。
氯鼠酮(chlorophacinone)又称鼠顿停、氯敌鼠,作为抗凝血类灭鼠剂的典型代表,它是目前世界上使用范围最为广泛的灭鼠剂之一。正是由于氯鼠酮的大范围使用,其带来的二次暴露危害较为严重,在各种环保监测以及法医调查中,氯鼠酮甚至出现在了非靶标动物鸟类的肝脏组织中[11]。不仅如此,研究者在家畜体内也检测到了氯鼠酮,其有可能通过食物链进入人类体内[12~13]。因此,在目前建设美丽生态中国的大形势下,对前期大规模使用的抗凝血类灭鼠剂进行生态毒性评估显得尤为重要。然而,目前针对氯鼠酮的研究报道大多集中在含量检测等领域[14~16],关于氯鼠酮对非靶向水生生物的毒理学研究却鲜见报道。本文以斑马鱼为模式动物,研究氯鼠酮对斑马鱼胚胎/仔鱼的急性毒性及抗氧化系统的影响,以期为评价环境中氯鼠酮的生态毒性及其环境风险提供基础数据和理论依据。
1 材料与方法
1.1 试剂与仪器
二甲基亚砜(dimethyl sulfoxide,DMSO)(国药集团化学试剂有限公司);氯鼠酮(北京北方伟业计量技术研究院);过氧化氢酶(catalase,CAT)测定试剂盒、还原型谷胱甘肽(glutathione,GSH)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、总蛋白质定量测定试剂盒、乙酰胆碱酯酶(acetylcholinesterase,AChE)测试盒(南京建成生物工程研究所有限公司)。用DMSO做助溶剂,将氯鼠酮配制成质量浓度为2 000 mg/L的储备液,低温保存待用。
LBI-400生化培养箱(上海龙跃);Olympus-SZX7体式倒置显微镜(奥林巴斯,日本);DanioVision高通量鱼类行为系统(诺达斯思,荷兰);JXFSTPRP-CL全自动样品冷冻研磨仪(上海净信);LEGEND MICRO 21R离心机(赛默飞世尔,美国);FlexStation 3酶标仪(赛默飞世尔,美国)。
1.2 胚胎的获取
本实验采用的斑马鱼均为野生型AB系纯种斑马鱼(WT/AB),鱼龄为6~18个月,购于武汉中科院国家斑马鱼资源中心,饲养于恒温曝气自动水循环养殖系统内(带有28℃的温控系统和循环水泵),每日喂食新鲜孵化丰年虾两次。在实验前一天16时选择性成熟且健康稳定的斑马鱼成体进行配对,雄鱼和雌鱼的比例为2∶1。亚克力孵化盒中内置栅格内胆以过滤胚胎,并以透明亚克力隔板将雌雄斑马鱼分隔开。随后加入系统水,对孵化盒进行暗处理过夜。实验当天9时抽板,进行光照刺激,让雌雄斑马鱼进行交配受精,20 min后收集胚胎。挑除发育异常的胚胎,得到可用于实验的完整健康胚胎。
1.3 胚胎发育实验
用配置好的氯鼠酮储备液逐级稀释至所需应用液,确保应用液中DMSO的体积分数小于0.5%(预实验表明,DMSO的体积分数小于0.5%时对斑马鱼胚胎/仔鱼无明显毒性)。挑选受精后3 h发育正常的斑马鱼胚胎进行暴露实验,氯鼠酮质量浓度设置为 0.20 mg/L、0.30 mg/L、0.45 mg/L 和 0.67 mg/L,每个浓度设置3组平行实验。使用6孔细胞培养板为容器,每孔6 mL溶液,放置胚胎30枚,暴露液一天一换,实验期间孔板需盖板盖,以保证暴露组浓度保持不变。在96 h、120 h观察斑马鱼的死亡率等生理学终点情况,并计算半数致死浓度(median lethal concentration,LC50),及时挑出死亡个体以防止对其他胚胎造成影响。在24 h、48 h、72 h、96 h、120 h观察氯鼠酮染毒后各暴露组斑马鱼胚胎发育情况与形态变化,记录并拍照。48 h时斑马鱼胚胎开始挣破卵膜,72 h时胚胎开始陆续孵化,于96 h和120 h分别统计氯鼠酮染毒后各暴露组斑马鱼胚胎的孵化率,同时分别统计24 h、48 h、72 h、96 h、120 h 时斑马鱼胚胎/仔鱼的存活率。24 h时,统计各暴露组斑马鱼胚胎尾部的自主抽动次数。120 h时,统计各暴露组仔鱼30 s内心跳次数,同时,统计各暴露组斑马鱼胚胎发育畸形数量占比,测量各暴露组仔鱼体长,以mm为单位。
1.4 运动行为的记录与分析
随机挑选暴露120 h且具有运动行为能力的斑马鱼仔鱼,通过DanioVision高通量鱼类行为系统进行运动行为测试。根据Nery等[17]的实验方法,将挑选出的仔鱼放置在24孔细胞培养板中观察,每孔随机放置1尾斑马鱼仔鱼,并加入2 mL氯鼠酮暴露液。光刺激条件设定为前20 min黑暗适应,之后每5 min进行1次明暗交替,记录总时长为120 min的仔鱼运动行为实验数据,包括运动距离、平均速度、行为轨迹和运动热区图等。实验结束后利用斑马鱼行为分析系统EthoVision XT 14软件进行数据统计和分析。
1.5 生化指标测试实验
每个暴露组随机取100尾仔鱼,用去离子水清洗两次,加入300 μL预冷的0.1 mol/L磷酸盐缓冲溶液(phosphate buffer saline,PBS)和1颗磁珠,置于2.5 mL离心管内0℃匀浆400 s,加入PSB溶液(pH 7.4)700 μL进行清洗转移。0℃低温下,2 500 r/min离心5 min,取上清液,待测。参照文献[18],用考马斯亮蓝法测定总蛋白质含量。GSH、MDA含量的测定参照供应商提供的说明书进行操作。CAT、AChE活力的测定参照试剂盒说明书进行。
1.6 数据统计分析
采用GraphPad Prism 8.0中的非线性回归法对斑马鱼胚胎死亡毒性进行分析,得到氯鼠酮对斑马鱼的半数致死浓度LC50。在满足正态分布和方差齐性的前提下,采用单因素方差分析法(one-way ANOVA)和最小显著性检验法(LSD)分析各组间的差异显著性,否则采用非参数检验处理差异的显著性。与对照组比较,“*”表示P<0.05,记为统计学差异显著;“**”表示 P<0.01、“***”表示 P<0.001,记为统计学差异极显著。采用GraphPad Prism 8.0软件制图。
2 结果
2.1 氯鼠酮对斑马鱼胚胎/仔鱼存活率、孵化率的影响
图1A是斑马鱼胚胎暴露96 h和120 h的孵化率。从图中可以看出,氯鼠酮暴露96 h和120 h的斑马鱼胚胎孵化率变化趋势类似,0.20 mg/L、0.30 mg/L和0.45 mg/L暴露组斑马鱼胚胎的孵化率均达到95%以上,与空白对照组相比无显著差异,但0.67 mg/L暴露组的孵化率呈现一定的下降趋势。氯鼠酮暴露对斑马鱼胚胎/仔鱼存活率的影响如图1B所示,暴露至24 h时,与空白对照组相比,各浓度组斑马鱼胚胎/仔鱼的存活率并无显著差异;当暴露至48 h时,0.67 mg/L暴露组胚胎/仔鱼的存活率下降显著,差异具有统计学意义(P<0.05);当暴露至72~120 h时,各浓度组斑马鱼胚胎/仔鱼的存活率均呈下降趋势,其中,0.20 mg/L与0.30 mg/L暴露组的下降无统计学意义,0.45 mg/L与0.67 mg/L暴露组的下降均具有统计学意义(0.45 mg/L:P<0.01,0.67 mg/L:P<0.001)。不仅如此,随着暴露时间延长,LC50逐渐下降,氯鼠酮暴露96 h和120 h时,斑马鱼胚胎/仔鱼的LC50分别为0.73 mg/L和0.61 mg/L。
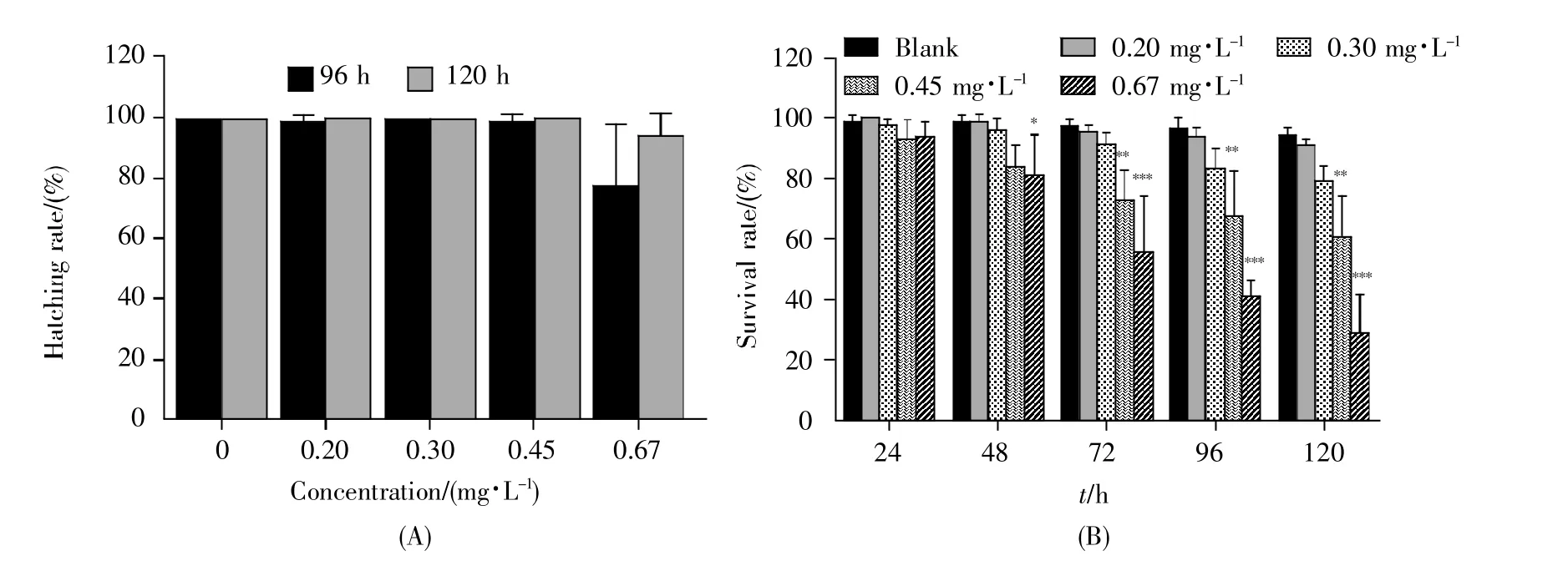
图1 氯鼠酮暴露对斑马鱼胚胎/仔鱼的孵化率与存活率的影响(A)孵化率;(B)存活率。Fig.1 Effects of chlorophacinone exposure on hatching and survival rates of zebrafish embryos/larvae(A)Hatching rate;(B)Survival rate.
2.2 氯鼠酮对斑马鱼胚胎/仔鱼自主抽动、心率的影响
由图2A可知,氯鼠酮暴露24 h时,斑马鱼胚胎每分钟自主抽动的次数随着氯鼠酮浓度的增大呈现出升高的趋势。相对于空白对照组,0.20 mg/L、0.30 mg/L暴露组的自主抽动次数无显著性差异,但0.45 mg/L和0.67 mg/L暴露组的自主抽动次数显著上升(0.45 mg/L:P<0.05,0.67 mg/L:P<0.01)。图2B是氯鼠酮暴露120 h后对仔鱼30 s内心跳次数的影响。由图可知,与空白对照组相比,0.20 mg/L、0.30 mg/L和0.45 mg/L暴露组的仔鱼心跳无显著差异,但0.67 mg/L暴露组的心跳次数显著下降(P<0.01)。暴露于氯鼠酮下的仔鱼心率随着氯鼠酮的浓度升高而下降,我们推测可能是氯鼠酮暴露导致了斑马鱼胚胎心脏发育不良,从而引起心脏功能失调。
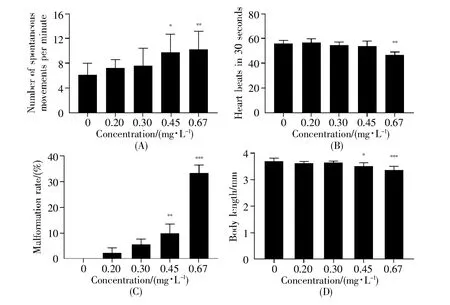
图2 氯鼠酮暴露对斑马鱼胚胎/仔鱼发育相关参数的影响(A)自主抽动;(B)心跳次数;(C)畸形率;(D)体长。Fig.2 Effects of chlorophacinone exposure on developmental parameters of zebrafish embryos/larvae(A)Spontaneous movement;(B)Heart beat;(C)Malformation rate;(D)Body length.
2.3 氯鼠酮对斑马鱼胚胎/仔鱼发育表型的影响
图2C是氯鼠酮暴露120 h后斑马鱼仔鱼发育的畸形情况。由图可知,斑马鱼仔鱼的畸形率随着氯鼠酮浓度的增加逐渐升高。与空白对照组相比,0.20 mg/L与0.30 mg/L暴露组的畸形率无显著变化,但0.45 mg/L与0.67 mg/L暴露组的畸形率显著增加,分别达到10.00%(P<0.01)和33.33%(P<0.001)。此外,由图3可知,0.20 mg/L与0.30 mg/L暴露组的斑马鱼仔鱼出现心包水肿与卵黄囊水肿;0.45 mg/L与0.67 mg/L暴露组则出现心包水肿、卵黄囊水肿、尾部弯曲等畸形。

图3 氯鼠酮暴露120 h后对斑马鱼仔鱼发育表型的影响(A)空白对照组;(B)0.20 mg/L;(C)0.30 mg/L;(D)0.45 mg/L;(E)0.67 mg/L。Fig.3 Effects of exposure to different concentrations of chlorophacinone on phenotypes of zebrafish larvae after 120 h(A)Blank;(B)0.20 mg/L;(C)0.30 mg/L;(D)0.45 mg/L;(E)0.67 mg/L.
2.4 氯鼠酮对仔鱼体内CAT活性和GSH、MDA含量的影响
图4是氯鼠酮暴露120 h后对斑马鱼仔鱼抗氧化相关指标的影响。实验结果表明,氯鼠酮暴露会引起仔鱼体内CAT活性(图4A)和MDA含量(图4C)升高,同时GSH含量(图4B)降低。由图4A可知,随着氯鼠酮浓度的增大,各暴露组仔鱼体内的CAT活性逐渐增加,存在较好的剂量-效应关系。与空白对照组相比,0.20 mg/L、0.30 mg/L和0.45 mg/L暴露组的CAT活性无显著性差异,0.67 mg/L暴露组的CAT活性显著增强(P<0.05)。由图4B可知,经氯鼠酮暴露120 h后,斑马鱼仔鱼体内的GSH含量随着氯鼠酮浓度的上升而下降,0.67 mg/L暴露组的GSH含量最低,与空白对照组相比具有极其显著的差异(P<0.001)。由图4C可知,随着氯鼠酮浓度的升高,斑马鱼仔鱼体内的MDA含量逐渐升高;与空白对照组相比,0.45 mg/L和0.67 mg/L暴露组的MDA含量均显著增加(P<0.05)。
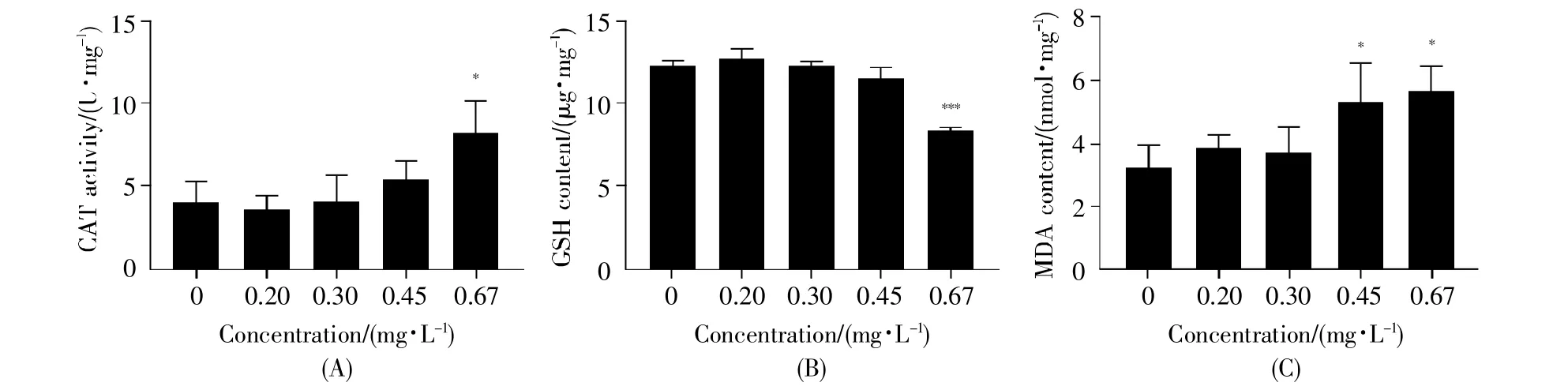
图4 氯鼠酮暴露120 h后对斑马鱼仔鱼体内抗氧化指标的影响(A)CAT活性;(B)GSH含量;(C)MDA含量。Fig.4 Effects of chlorophacinone exposure on antioxidant parameters of zebrafish larvae after 120 h(A)CAT activity;(B)GSH activity;(C)MDA content.
2.5 氯鼠酮对斑马鱼仔鱼体内AChE活性的影响
氯鼠酮暴露120 h后对斑马鱼仔鱼体内AChE活性的影响如图5所示。由图可知,随着氯鼠酮浓度的增加,斑马鱼仔鱼体内的AChE活性逐渐降低。与空白对照组相比,0.45 mg/L(P<0.001)和0.67 mg/L(P<0.001)暴露组的AChE活性具有极其显著的差异,这表明在氯鼠酮的作用下,斑马鱼仔鱼体内的AChE活性受到显著抑制。
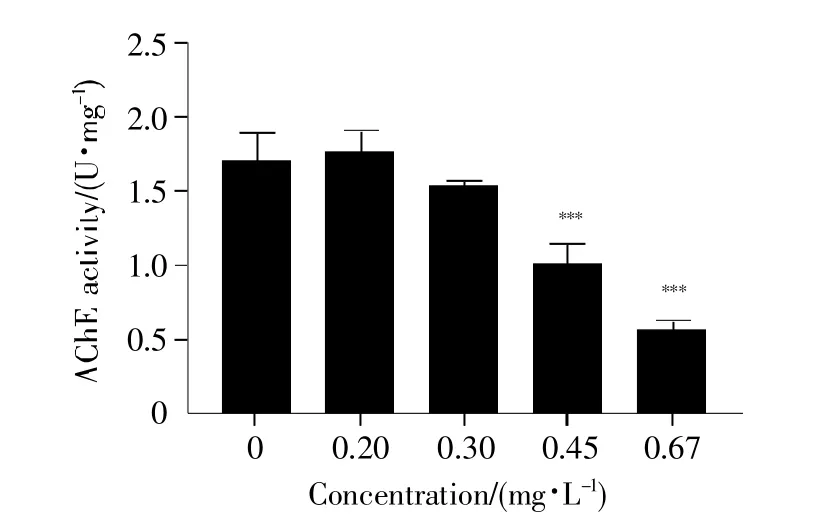
图5 氯鼠酮暴露120 h后对斑马鱼仔鱼体内AChE活性的影响Fig.5 Effects of chlorophacinone exposure on AChE activity of zebrafish larvae after 120 h
2.6 氯鼠酮对斑马鱼仔鱼运动行为的影响
由图6A和B可知,氯鼠酮暴露120 h后,随着暴露浓度的升高,斑马鱼仔鱼的运动总距离和平均速度均呈现逐渐下降的趋势。与空白对照组相比,0.20 mg/L、0.30 mg/L暴露组无显著性差异,0.45 mg/L和0.67 mg/L暴露组仔鱼的运动总距离及平均速度均显著下降(0.45 mg/L:P<0.01,0.67 mg/L:P<0.001),运动行为能力受到明显抑制。此外,由图6C可知,随着氯鼠酮浓度的升高,仔鱼在单位面积内的停滞时间逐渐延长,表明氯鼠酮暴露后,斑马鱼仔鱼的运动行为能力受到显著抑制。
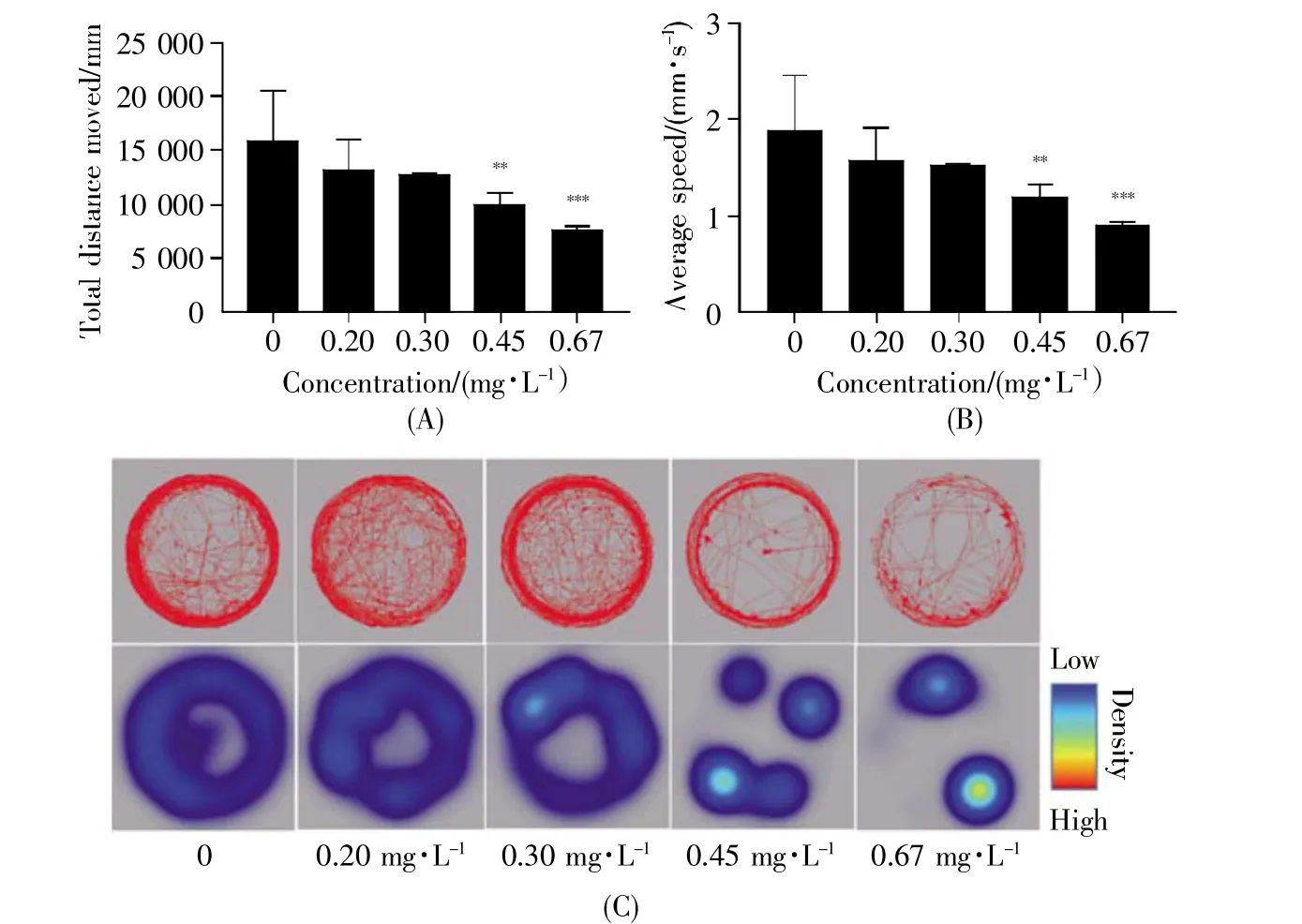
图6 氯鼠酮暴露120 h后对斑马鱼仔鱼运动行为的影响(A)总运动距离;(B)平均速度;(C)运动轨迹图和热区图。Fig.6 Effects of chlorophacinone exposure on locomotion behavior of zebrafish larvae after 120 h(A)Total distance;(B)Average speed;(C)Swimming trajectory and thermogram.
3 讨论
胚胎发育是鱼类生命过程中的一个重要阶段,相对于成年斑马鱼,斑马鱼胚胎/仔鱼对外来毒物的反应更加敏感,因此,药物处理下斑马鱼胚胎的存活率和孵化率是衡量药物急性毒性的重要生物毒理学指标之一。在本实验中,斑马鱼胚胎的孵化率随着氯鼠酮浓度的增加而呈现略微下降趋势,但并无显著差异,可能是由于胚胎期斑马鱼的卵膜能够起到一定的屏障作用,从而可以阻隔氯鼠酮的侵入,维持胚胎的正常发育[19]。斑马鱼胚胎/仔鱼的存活率随着氯鼠酮浓度的不断增大而逐渐下降,其中,0.45 mg/L与0.67 mg/L暴露组的存活率极其显著地低于空白对照组(图1B),说明氯鼠酮对斑马鱼胚胎/仔鱼具有较强的急性毒性。不仅如此,氯鼠酮暴露96 h和120 h时,斑马鱼仔鱼的LC50分别为0.73 mg/L和0.61 mg/L,随着暴露时间延长LC50值呈现下降趋势,表明氯鼠酮对斑马鱼胚胎/仔鱼的毒性随着时间的延长而增大。
自主抽动是指斑马鱼胚胎尾部不受大脑神经控制的左右摆动的运动,是能够检测到的最早的斑马鱼胚胎发育的神经行为,常常被作为评估斑马鱼早期神经发育毒性的重要指标之一[20~21]。本研究中,与空白对照组相比,0.45 mg/L和0.67 mg/L暴露组的胚胎自主抽动次数均显著升高(0.45 mg/L:P<0.05,0.67 mg/L:P<0.01)(图 2A),表明斑马鱼胚胎的神经系统发育受到显著抑制,这说明氯鼠酮暴露对斑马鱼胚胎/仔鱼具有一定的神经毒性。心脏是斑马鱼生长发育过程中首先形成并发挥作用的主要器官,单位时间内的心跳次数是反映心脏功能的重要指标。本研究发现,0.67 mg/L暴露组斑马鱼仔鱼30 s的心跳次数显著下降(图2B),这可能是氯鼠酮暴露导致了斑马鱼仔鱼的心脏发育不良,引起心脏生理功能失调。斑马鱼胚胎心脏发育异常还能影响血液循环,继而影响营养物质的正常运送,从而可能诱导胚胎在发育过程中出现心包水肿以及卵黄囊肿等畸形发育形态,甚至死亡[22]。
生物体在受到毒物侵入时会生成大量活性氧(reactive oxygen species,ROS),在正常生理状态下,机体将产生相应的抗氧化酶来清除ROS,降低氧化损伤,以保障机体的生理功能正常有序进行,并使两者保持动态平衡状态。但若外来入侵物质打破这种平衡状态,就会导致机体氧化损伤,甚至死亡[23]。CAT的主要作用是将生物体内的H2O2分解为O2和H2O,其是生物抗氧化防御体系的标志性酶之一[24]。在本研究中,0.67 mg/L暴露组的CAT活性显著增强(P<0.05)(图4A)。作为生物体内清除氧自由基的重要组成部分,CAT活性升高表明随着氯鼠酮浓度的升高,仔鱼体内产生的ROS也逐渐增多,提示氯鼠酮对斑马鱼仔鱼的毒性逐渐增强。生物体在受到外界刺激后能够诱导自身产生非酶抗氧化剂GSH,它能够快速有效地清除生物体内的有毒化学物质刺激所产生的ROS[25],当机体内的GSH逐渐减少甚至耗尽时,将导致机体产生中毒效应。在本研究中,经氯鼠酮暴露后的斑马鱼仔鱼体内的GSH含量随着氯鼠酮浓度的上升而下降(图4B),0.67 mg/L暴露组的GSH含量达到最低,这可能是机体为了维持体内ROS与抗氧化防御系统之间的动态平衡,GSH被消耗用于清除机体内多余的ROS造成的[26]。MDA是机体发生不可逆脂质过氧化的产物,其在机体内含量的变化通常也可以用来反映生物体内脂质过氧化的水平和损伤程度[27~28]。在本实验中,随着氯鼠酮暴露浓度的增大,斑马鱼仔鱼体内的MDA含量呈上升趋势(图4C),与空白对照组相比,0.45 mg/L与0.67 mg/L暴露组斑马鱼仔鱼体内的MDA含量显著升高(0.45 mg/L:P<0.05,0.67 mg/L:P<0.05),这表明高浓度的氯鼠酮暴露产生的ROS攻击斑马鱼体内的不饱和脂肪酸,进而形成了MDA。氧化应激实验表明,在氯鼠酮的刺激下,斑马鱼仔鱼的抗氧化防御系统被启动,但随着氯鼠酮浓度的不断升高,机体内多余的ROS不能被抗氧化系统完全清除,进而导致机体的氧化损伤程度不断加剧,最终产生毒性效应。
AChE是一种与生物神经传导密切相关的酶,对斑马鱼胚胎的神经发育至关重要,其活力的改变通常被认为是神经系统发育异常的重要指标之一[29]。在本实验中,0.45 mg/L和0.67 mg/L暴露组的AChE活性与空白对照组相比具有极其显著的差异(0.45 mg/L:P<0.001,0.67 mg/L:P<0.001)(图5),表明在氯鼠酮暴露下,斑马鱼仔鱼体内的AChE活性受到显著抑制。这可能是氯鼠酮暴露对斑马鱼仔鱼的神经系统具有毒性作用,导致神经突触间隙中乙酰胆碱数量减少,继而影响了兴奋的传递,使斑马鱼仔鱼的运动行为能力受到抑制。斑马鱼运动行为实验是在整体水平上对生命活动进行动态研究的一种重要手段,能够直观地检测各种因素对斑马鱼运动行为能力的影响[30~31]。本实验通过对仔鱼的运动行为进行分析发现,0.45 mg/L和0.67 mg/L暴露组仔鱼的运动总距离和平均速度受到显著抑制(图6A~B)。不仅如此,随着氯鼠酮浓度的升高,仔鱼在单位面积内的停滞时间逐渐延长,并出现呆滞现象(图6C)。这可能与斑马鱼仔鱼中枢神经系统发育相关基因mbp和突触蛋白基因syn2a的表达受到抑制有关[32]。
综上所述,经氯鼠酮暴露后,斑马鱼胚胎/仔鱼的自主抽动、孵化率、存活率、体长等发育相关指标受到显著影响,同时其体内抗氧化防御系统失衡,不仅如此,仔鱼的运动行为能力和体内神经递质AChE活性受到显著抑制。实验结果表明,氯鼠酮对斑马鱼胚胎/仔鱼具有急性毒性和神经毒性效应。该结论为今后继续开展以氯鼠酮为代表的第二代抗凝血类灭鼠剂对非靶向水生生物的毒性作用研究提供了借鉴和参考。