姜黄素抗肺纤维化作用的分子机制研究进展
2022-11-05张钧岚范伏元
郑 蕾,黄 红,吴 涵,张钧岚,蔡 雄*,范伏元
姜黄素抗肺纤维化作用的分子机制研究进展
郑 蕾1, 2,黄 红2#,吴 涵2,张钧岚2,蔡 雄1, 2*,范伏元1*
1. 湖南中医药大学第一附属医院,湖南 长沙 410007 2. 湖南中医药大学 科技创新中心,湖南 长沙 410208
肺纤维化是一种以成纤维细胞增殖分化、细胞外基质(extracellular matrix,ECM)过量沉积、肺结构及功能受损为主要病理特征的慢性肺间质疾病。虽然吡非尼酮和尼达尼布等抗肺纤维化药物已在临床应用,但仍未达到满意的治疗效果。因此,寻找一种高效低毒的抗纤维化药物一直是临床的迫切需要。姜黄素是从药用植物姜黄、郁金及莪术的块茎中提取的一种天然多酚化合物,具有抗炎、抗菌、抗氧化、调血脂、抗癌、抗纤维化等药理活性,研究表明其可通过抑制成纤维细胞增殖分化、调控细胞凋亡、抑制炎症反应、调节转化生长因子-β、抑制氧化应激、抑制ECM沉积等途径有效缓解肺纤维化进展。主要综述了姜黄素抗肺纤维化作用分子机制的研究进展,并讨论了临床治疗肺纤维化的新靶点和思路,以期为姜黄素进一步抗肺纤维化机制的研究及临床应用提供参考。
姜黄素;肺纤维化;炎症反应;转化生长因子-β;氧化应激
肺纤维化是以弥漫性非特异性肺泡炎症伴间质性纤维化为基本病变的疾病,具有慢性进行性加重不可逆、致残致死率高的特点,其中以特发性肺纤维化(idopathic pulmonary fibrosis,IPF)最常见,其预后最差,5年存活率仅有20%[1]。临床上肺纤维化主要表现为干咳、进行性呼吸困难,最终可发展为呼吸衰竭而导致死亡。近年来国内外大量研究显示,肺纤维化发病率呈逐年上升趋势,已成为全球亟待解决的人类健康问题[2]。尤其是新型冠状病毒肺炎的反复爆发和蔓延,大量患者治愈后检查出不同程度的肺纤维化病理改变[3]。因此,非常有必要寻找高效防治肺纤维化的策略和新型药物。
肺纤维化的发病过程与(肌)成纤维细胞、免疫细胞及肺泡上皮细胞中炎症反应、氧化应激、胶原蛋白异常生成等密切有关[4],病理过程涉及多种细胞及病理途径。吡非尼酮和尼达尼布是目前临床仅有的抗IPF药物。吡非尼酮主要通过抑制转化生长因子-β(transforming growth factor-β,TGF-β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和血小板源生长因子(platelet derived growth factor,PDGF)等功能蛋白活性而发挥抗肺纤维化作用;尼达尼布是一种小分子酪氨酸激酶抑制剂,可调节PDGF受体、纤维母细胞生长因子受体及血管内皮生长因子受体等功能蛋白活性,从而阻断纤维化进程。这2种药物只能减缓肺功能的退化,对于症状缓解及纤维化的逆转几乎没有作用且均具有严重的不良反应[5]。因此,亟待挖掘药效更为全面的新型抗肺纤维化药物分子,以更好地满足临床用药需求。天然植物活性成分一直以来都是药物挖掘的重要来源,很多天然植物活性成分经过一系列研究而被开发为成熟的临床药物,如青藤碱[6]、雷公藤多苷[7]、白芍总苷[8]等。姜黄素是从姜黄属植物姜黄L.、郁金Y. H. Chen et C. Ling及莪术Val.的块茎中提取出来的一种天然多酚化合物,化学结构见图1。其毒性低,具有抗炎、抗菌、抗氧化、调血脂、抗癌等广泛的药理活性[9]。姜黄具有通经止痛、破血行气等功效,多用于治疗血瘀证,而中医理论认为肺纤维化正是以血瘀为标。近年来众多学者逐渐认识到姜黄素在抗肺纤维化方面有着独特优势,其可通过多环节、多通路、多靶点有效控制纤维化的进展[10]。此外,姜黄素不良反应小,有望成为抗纤维化药物研究中的重要活性分子。本文主要从姜黄素抑制成纤维细胞的增殖分化、调控细胞凋亡、抑制炎性反应、调节促纤维化因子TGF-β、抑制氧化应激、抑制细胞外基质(extracellular matrix,ECM)沉积等方面对姜黄素发挥抗纤维化的作用机制进行综述,以期为姜黄素的进一步抗肺纤维化机制研究及临床应用提供参考。

图1 姜黄素的化学结构
1 抑制成纤维细胞的增殖分化
成纤维细胞是肺纤维化的关键效应细胞,是ECM的主要来源。成纤维细胞被细胞因子及生长因子激活诱导增殖,然后分化为肌成纤维细胞。肌成纤维细胞分泌大量的胶原蛋白、纤维连接蛋白和弹性蛋白,导致ECM的积累而形成肺纤维化,故抑制成纤维细胞的增殖分化具有作为抗纤维化治疗靶点的潜力。
高蔚等[11]在体外培养肺纤维化大鼠肺成纤维细胞,发现姜黄素呈剂量、时间相关性地抑制细胞的存活率。郝小惠等[12]进一步研究显示姜黄素可导致成纤维细胞G2/M期的阻滞和S期细胞的合成减少,从而抑制其增殖。缺氧肺成纤维细胞中I型胶原(collagen I,Col-I)α1前体蛋白及磷酸化的p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的表达与纤维化密切相关,姜黄素能明显抑制其增殖,推测调节肺成纤维细胞的MAPK信号通路相关蛋白磷酸化表达水平可能是姜黄素抗纤维化的机制[13]。分化的肌成纤维细胞的特征在于α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的形成,以及产生胶原蛋白、波形蛋白的能力增加[14]。姜黄素的干预能降低成纤维细胞中α-SMA、Col-I、Col-II的水平,抑制其分化,而这种作用是通过组织蛋白酶B、L的上调来介导[15]。Liu等[16]研究显示核过氧化物酶体增殖物激活受体γ(nuclear peroxisome proliferator-activated receptor γ,PPARγ)配体激活剂罗格列酮和姜黄素以剂量和时间相关性方式抑制小鼠肺成纤维细胞的增殖、α-SMA的表达、Col-I的分泌,此外还上调mRNA表达和下调PDGF受体β(PDGF receptor β,)mRNA表达,说明姜黄素抑制成纤维细胞的增殖和分化作用与PPARγ/PDGFRβ信号通路的激活有关。在人胚肺成纤维细胞WI-38模型及博来霉素诱导的小鼠肺纤维化模型中,Chen等[17]发现,姜黄素可降低α-SMA和波形蛋白的表达,抑制成纤维细胞的增殖和分化,其机制可能与抑制MAPK[包括细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)、c-Jun氨基末端激酶(c-Jun-terminal kinases,JNK)和p38 MAPK]蛋白磷酸化有关。综上表明,姜黄素对成纤维细胞增殖分化的抑制作用可能与调控PPARγ/PDGFRβ信号通路、MAPK信号通路及蛋白酶B、L有关。
2 调控细胞凋亡
肺纤维化患者肺泡上皮细胞容易凋亡,但成纤维细胞/肌成纤维细胞具有细胞凋亡抵抗性。在动物模型实验中,诱导上皮细胞的凋亡足以引起肺纤维化,但诱导成纤维细胞凋亡可以改善纤维化[18],说明抑制肺泡上皮的凋亡与促进成纤维细胞的凋亡可防治肺纤维化。在肺纤维化疾病中,细胞凋亡主要通过2个途径激活:外在途径由细胞膜上的死亡受体(如TNF受体)及其相关的配体(如TNF-α)构成,配体诱导受体激活,从而激活促凋亡的死亡诱导信号转导复合体的形成,它们募集并激活效应因子如活化的半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)以启动细胞凋亡;内在途径是由于线粒体通透性的增加,各种压力因素导致抗凋亡线粒体蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-xL的表达降低,并导致促凋亡线粒体蛋白Bcl-2相关X蛋白(Bcl-2-associated X,Bax)的表达增加[19]。
博来霉素的气管内给药可诱导肺泡上皮细胞的凋亡增加,使用凋亡抑制剂钙/钙调蛋白依赖性蛋白酶II可以减少胶原蛋白沉积和改善纤维化[20-21],表明抑制肺泡上皮凋亡可成为治疗肺纤维化的靶点。既往体内实验发现,通过降低Caspase-3蛋白的表达及减少活化的Caspase-3阳性细胞的数量,姜黄素以拮抗肺泡上皮细胞凋亡通路的激活来改善肺纤维化[22]。Gouda等[23]利用姜黄素干预博来霉素诱导的肺泡上皮A549细胞,发现细胞迁移和细胞凋亡明显减少,Caspase-3的激活被抑制,细胞因子白介素-17A(interleukin-17A,IL-17A)的分泌及其介导的、纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,)mRNA表达降低。综上表明,姜黄素抑制肺上皮细胞凋亡的作用可能与调控凋亡蛋白、IL-17A-p53-PAI-1有关。
肺成纤维细胞/肌成纤维细胞具有抗凋亡的能力[24]。如活性氧生成酶还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide phosphate-reduced,NADPH)氧化酶-4(NADPH oxidase 4,Nox4)可介导成纤维细胞抗凋亡活性,而靶向Nox4可减弱抗凋亡的成纤维细胞表型并导致纤维化的逆转[25],故促进成纤维细胞的凋亡亦是治疗肺纤维化的靶点。高蔚等[26]发现姜黄素明显促进成纤维细胞凋亡,其机制可能与直接促进Caspase-3、Caspase-8和Caspase-9的表达升高有关。并且,姜黄素干预可增加原代成纤维细胞中凋亡基因和的表达[27]。而Tourkina等[28]研究发现姜黄素促进硬皮病肺成纤维细胞凋亡,但不影响正常肺成纤维细胞,这归因于姜黄素可使正常肺成纤维细胞的血红素加氧酶-1(heme oxygenase 1,HO-1)和谷胱甘肽硫转移酶P1(glutathione-transferase pi-1,GSTP1)表达增加,防止细胞凋亡,而硬皮病肺成纤维细胞中存在蛋白激酶C的ε异构体(epsilon isoform of protein kinase C,PKCε)信号传导异常,姜黄素不能上调HO-1和GSTP1,从而促进细胞凋亡。同时,Zhang等[29]研究发现博来霉素诱导的肺纤维化模型小鼠经姜黄素干预后,肺组织胶原沉积减少,组织蛋白酶L、K的表达水平增加;而在细胞模型中发现人成纤维细胞凋亡率增加,Caspase-3的表达和Bax/Bcl-2分别呈剂量相关性增加;但在组织蛋白酶抑制剂预处理后,姜黄素促进成纤维细胞中Caspase-3表达和增加Bax/Bcl-2的功能减弱。综上表明,姜黄素可通过调控凋亡蛋白和基因、PKCε信号通路及组织蛋白酶L/K促进成纤维凋亡进而抑制肺纤维化(图2)。
3 抑制炎症反应
炎症反应贯穿肺纤维化全过程。在肺纤维化早期,炎症损伤刺激肺泡上皮细胞释放TGF-β1和IL等细胞因子,并诱导免疫反应,招募炎症细胞和免疫细胞到受损部位进行修复;随后持续的炎症刺激导致炎症浸润,诱导巨噬细胞和中性粒细胞过度分泌细胞因子,如细胞因子TNF-α、γ干扰素(interferon-γ,IFN-γ)等,可引发纤维化;过度的细胞因子释放促进肺泡上皮细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)和成纤维细胞的活化,加速纤维化的进展[30]。因此,减少炎症损伤纠正免疫障碍和是预防和治疗肺纤维化的有效方法。
Xu等[31]研究表明姜黄素250或500 mg/kg在治疗肺纤维化大鼠方面具有与氢化可的松相当的效果,其能显著抑制博来霉素诱导的肺部炎性损伤,并且减少诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)及TGF-β1的表达。因而推测姜黄素与皮质类固醇一样,可调节炎症反应中相同的关键细胞因子,在肺纤维化治疗中发挥相似的作用。在胺碘酮诱导大鼠肺纤维化模型中,姜黄素通过抑制肺泡巨噬细胞、中性粒细胞、嗜酸性粒细胞浸润肺组织来改善肺纤维化[32]。外界刺激可导致中性粒细胞聚集,从而释放髓过氧化物酶(myeloperoxidase,MPO)。在环磷酰胺诱导肺纤维化大鼠模型中,姜黄素干预能显著降低肺组织MPO活性,减少支气管肺泡灌洗液中IL-1β的蛋白表达[33],同时阻断肺泡巨噬细胞释放TNF-α[34]。辅助T细胞(helper T cell,Th)1/Th2参与肺纤维化的形成,调节Th1/Th2平衡能够对肺纤维化起到保护作用[35];姜黄素可通过降低IL-4、提高INF-γ、纠正Th1/Th2失衡从而延缓大鼠肺纤维化进程[36]。前列腺素J2(prostaglandin J2,PGJ2)是一种抗炎前列腺素,研究发现姜黄素可通过诱导PGJ2而激活PPARγ和cAMP应答元件结合蛋白(cAMP response element bound protein,CREB)途径来促进肝细胞生长因子(hepatocyte growth factor,HGF)进入肺部并发挥抗肺纤维化作用[37]。

图2 姜黄素调控细胞凋亡
核因子-κB(nuclear factor-κB,NF-κB)信号通路是一条经典的炎症通路,在肺纤维化中起关键作用,驱动T细胞和巨噬细胞分泌炎症细胞因子,加重炎症损伤,促进肺纤维化的进展[38-39]。在呼肠孤病毒1/L诱导的急性病毒性肺炎模型中出现胶原蛋白沉积及肺间质纤维化,姜黄素可逆转这种改变,并通过降低NF-κB/p65的磷酸化抑制肺组织的细胞因子IL-6、IL-10、IFN-γ和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的表达[40]。在肺泡上皮细胞实验中,Biswas等[41]发现姜黄素可以抑制NF-κB的逆转录和与核内DNA的结合来减少IL-8的释放。杨茂宪等[42]研究表明姜黄素可以逆转脂多糖诱导的急性呼吸窘迫综合征大鼠气道杯状细胞化生,改善肺组织纤维化,抑制Toll 样受体4(Toll-like receptor 4,TLR4)/NF-κB信号通路蛋白表达及其下游的TNF-α的过表达,减轻炎症反应,从而发挥抗肺纤维化的作用。此外,姜黄素还可以通过调节其他炎症靶点如Janus激酶/信号转导子和转录激活子(Janus kinase/signal transducers and activators of transcription,JAK/STAT)来调节肺纤维化[22]。综上表明,姜黄素通过抑制炎症细胞分泌炎症因子、抗炎前列腺素和NF-κB信号通路来发挥抗肺纤维化作用(图3)。
4 调节TGF-β
TGF-β是一种调节性细胞因子,是目前发现最强的致纤维化因子,可诱导许多促纤维化生长因子和细胞因子的表达增加;在肺纤维化小鼠模型和IPF患者的支气管肺泡灌洗液中,TGF-β水平升高,升高的TGF-β显著促进成纤维细胞和其他间充质细胞的增殖和肺泡上皮细胞经历间充质特征的表型转变。此外,TGF-β信号传导在介导肌成纤维细胞活化以及随后产生胶原蛋白和其他ECM成分方面起核心作用[43]。
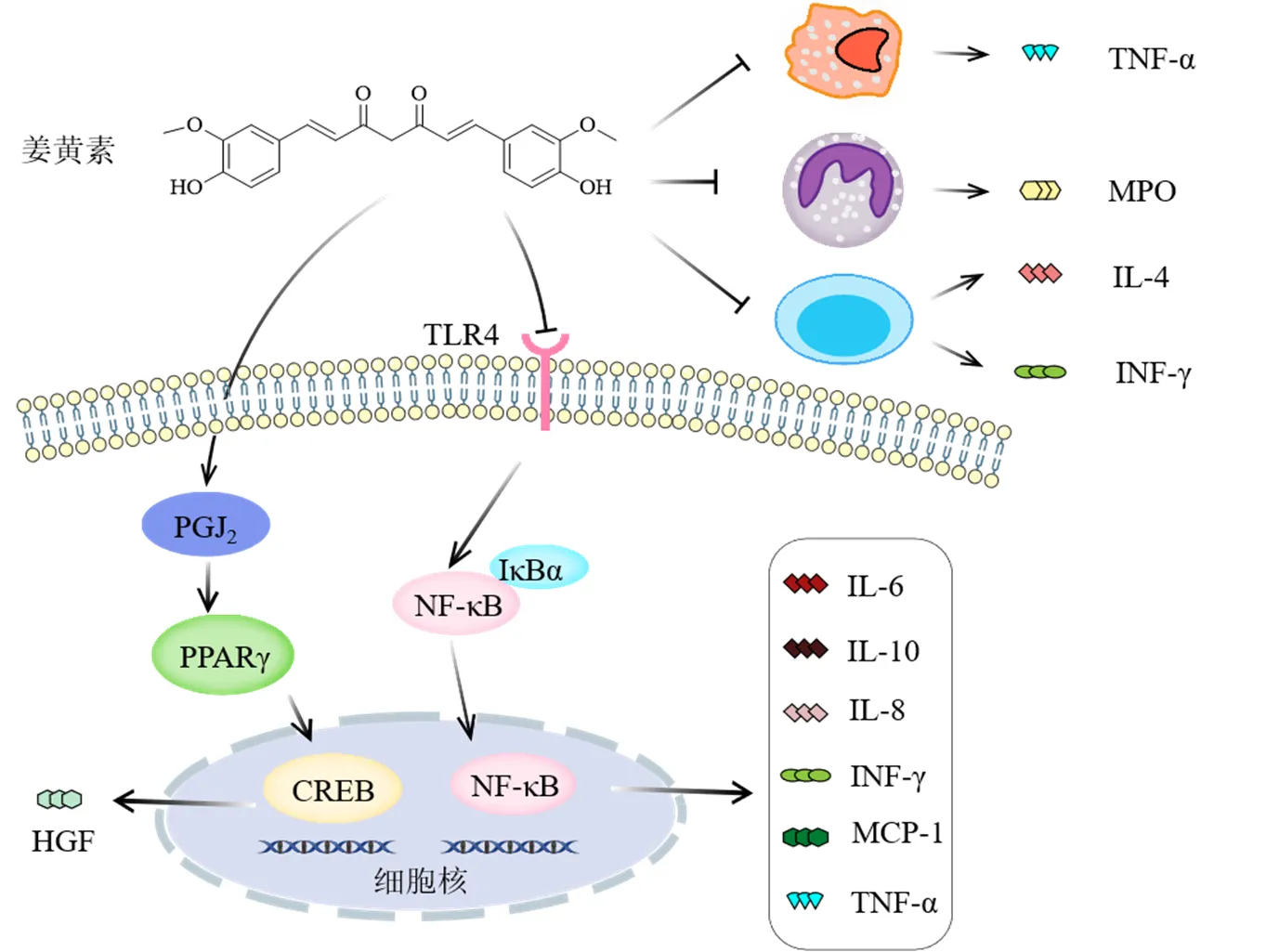
图3 姜黄素抑制炎症作用
Zhang等[29]发现在博来霉素诱导肺纤维化的小鼠和人肺上皮细胞中加入姜黄素可导致TGF-β1的生成减少,从而减少肺组织中胶原的沉积,增加人肺上皮细胞的凋亡率,影响人肺上皮细胞的增殖和迁移速率。Shaikh等[44]用博来霉素干预肺泡上皮A549细胞导致了TGF-β1的激活,TGF-β1信号的激活可以下调过氧化物酶如氧异构体生物发生因子13(eroxisomal biogenesis factor 13,PEX13)、PEX14、PEX19和酰基辅酶a氧化酶1(acyl-CoA oxidase 1,ACOX1),从而使炎症加重损害肺泡上皮,最终导致肺纤维化,而姜黄素能够逆转这一过程,并且分子对接研究显示,姜黄素能与TGF-β1蛋白结合,表明姜黄素表现出抑制TGF-β1介导的肺泡上皮损伤的能力。过度的EMT被认为在IPF的发展中起着至关重要的作用,大约1/3的肺纤维化成纤维细胞被确定为上皮起源,故抑制肺泡EMT可以治疗肺纤维化。Tyagi等[45]在细胞实验中也观察到TGF-β参与了百草枯诱导的成纤维细胞标记α-SMA产生增加和上皮标记E-钙黏蛋白的表达减少,从而促进肺EMT,姜黄素干预后可以逆转这一过程,并降低TGF-β和基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的表达。Shaikh等[46]研究表明姜黄素还可降低卵圆形肺泡上皮细胞变成纺锤形间充质细胞的比列,并且下调EMT相关的锌指转录因子SNAIL和SLUG的表达。
Smad家族蛋白是TGF-β家族受体下游的信号转导分子,TGF-β/Smad通路在纤维化发展中也起着重要作用,敲除小鼠的基因能够抑制EMT,并抑制和延缓肺纤维化的发生发展[47]。Chen等[36]在百枯草诱导大鼠肺纤维化实验中发现,姜黄素升高动脉血中氧分压,降低二氧化碳分压,减少血清中Smad4、Smad泛素化调节因子2(Smad ubiquitination regulatory factor,Smurf2)等水平,说明姜黄素能够改善肺纤维化大鼠的呼吸功能,其机制涉及到抑制Smad介导的信号通路。朱杨阳等[48]研究发现姜黄素通过下调TGF-β1、Smad2/3蛋白和上调Smad7蛋白,抑制TGF-β1/Smads信号传导,进而缓解大鼠肺炎症浸润和胶原沉积。Smith等[49]研究表明,姜黄素能使S期肺成纤维细胞数量呈剂量相关性减少,G0/G1期细胞成比例增加;减少肺纤维小鼠肺组织中的总细胞、单核细胞和多形核细胞数目,降低肺羟脯氨酸、α-SMA表达;抑制TGF-β诱导的Smad2/3和ERK1/2的磷酸化,说明姜黄素能够通过抑制TGF-β/Smad2/3和ERK1/2通路降低肺成纤维细胞的增殖分化、炎症和减少胶原沉积而抗肺纤维化。综上表明,姜黄素可通过抑制TGF-β分泌及其信号通路发挥抗肺纤维化作用(图4)。
5 抑制氧化应激
氧化应激是由于机体氧化和抗氧化之间的不平衡而产生活性氧(reactive oxygen species,ROS)增多,最终引起细胞功能障碍和组织损伤。谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)是体内重要的抗氧化酶,能清除机体自由基,丙二醛(malondialdehyde,MDA)是脂质过氧化的代谢产物,研究显示IPF患者中氧化应激的主要标志物SOD、GSH等抗氧化酶活性降低,以及MDA和ROS积累。氧化应激介导的肺泡上皮细胞损伤、成纤维细胞的增殖和分化、细胞凋亡抵抗和ECM的沉积参与肺纤维的疾病过程,ROS清除剂和调节剂已经在临床前体内外实验中作为肺纤维化的潜在治疗方法进行了研究[50]。
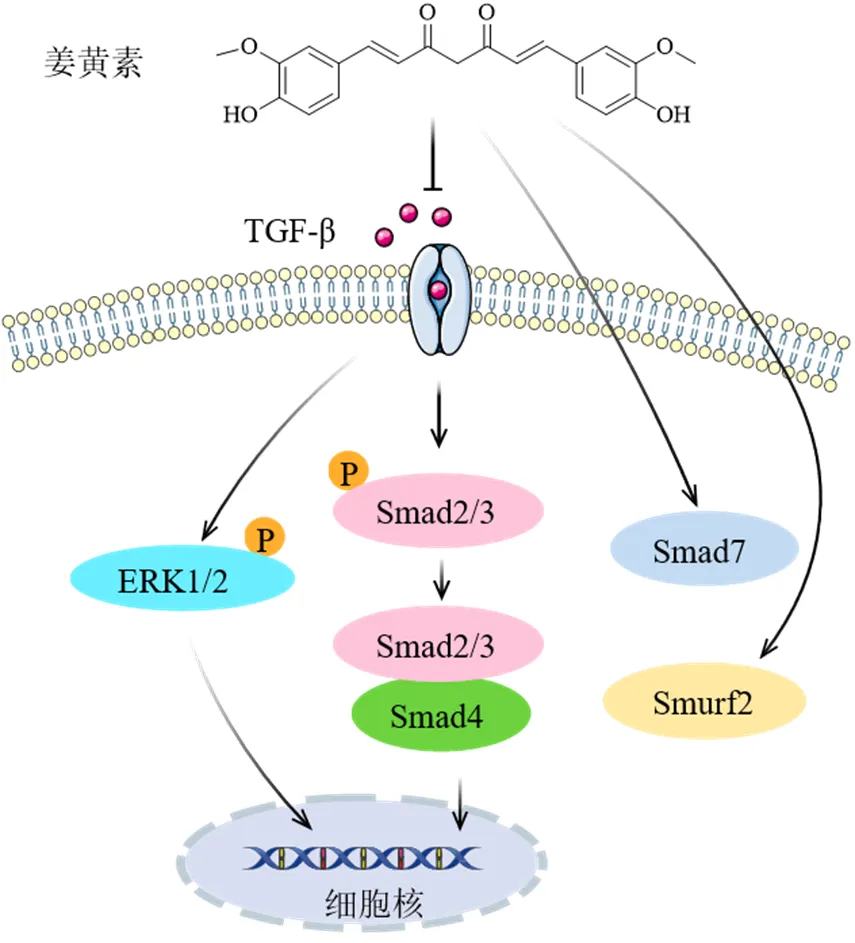
图4 姜黄素调节TGF-β
姜黄素的分子结构中同时具有酚基团和β-二酮基团,可以消除活性氧自由基和含氧化合物、螯合金属离子等,是天然的抗氧化剂。双氧化酶(dual oxidase,DUOX)是一种专门产生ROS的酶,能够受细胞信号转导等过程的调控来产生ROS。在辐射诱导的大鼠肺纤维化模型实验中发现肺匀浆中基因表达增加41倍、的表达增加则超过60倍,而姜黄素的干预能够有效抑制基因表达[51]。姜黄素能促进GSH水平上升并下调MDA表达水平,以减轻二氧化硅或博来霉素诱导的肺纤维化大鼠的氧化应激状态,从而保护肺脏[52-53]。HO-1是一种重要的抗氧化酶,姜黄素能增加原代肺内皮和成纤维细胞中HO-1的水平并阻断辐射诱导ROS的产生,抑制氧化应激[54]。核因子E2相关因子2(nuclear erythroid 2-related factor 2,Nrf2)受Kelch样环氧氯丙烷相关蛋白1(kelch like-ECH-associated protein 1,Keap1)的调控,是细胞氧化应激反应中的关键因子。在氧化应激条件下,Nrf2从Keap1中分离,然后进入细胞核与抗氧化反应元件结合,增加了II相解毒酶如HO-1的表达,保护细胞免受氧化损伤。IPF微环境中的氧化应激会降低肺间充质干细胞的存活率,从而导致疾病进展;而Ke等[55]研究显示姜黄素对小鼠肺间充质干细胞具有抗氧化保护作用,减少了细胞内ROS的产生,抑制细胞凋亡,这可能与姜黄素促进蛋白激酶B(protein kinase B,Akt)磷酸化,增加p-Akt/Akt和Nrf2表达,最终导致HO-1释放增加有关。姜黄素抑制氧化应激的机制见图5。
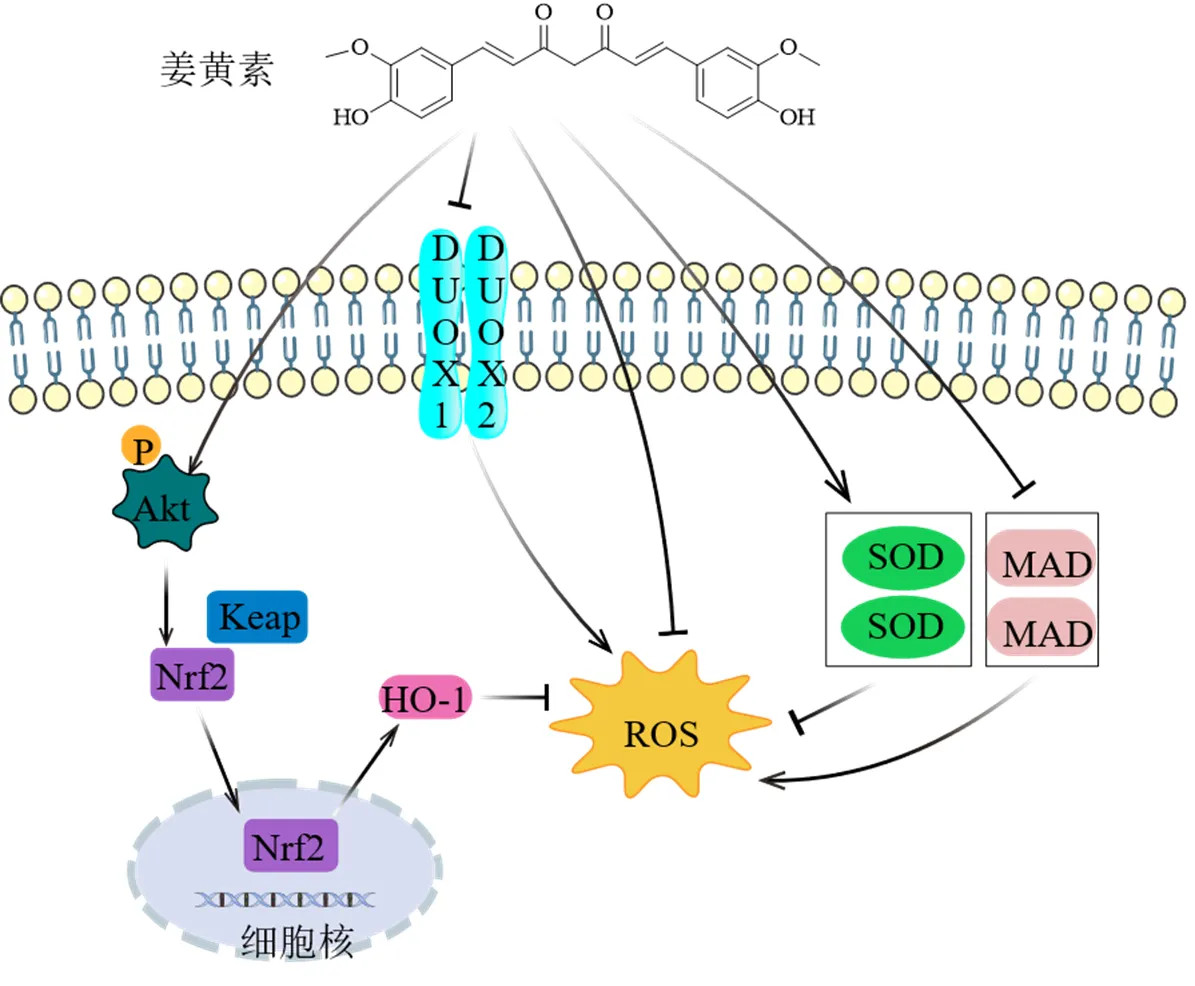
图5 姜黄素抑制氧化应激
Fig. 5 Oxidative stress suppressed by curcumin
6 抑制ECM的沉积
ECM主要成分包括胶原蛋白、糖蛋白和蛋白聚糖,其大量堆积是肺纤维化组织重构混乱的标志,可使肺泡结构消失,进而形成或加重纤维化。Sun等[56]在肺成纤维细胞实验中检测胶原蛋白水平,经姜黄素处理后羟脯氨酸、脯氨酸羟化酶、Col-I、Col-III、Col-I N端前肽、Col-III N端前肽的含量均有不同程度的降低;同时,姜黄素可降低博来霉素大鼠血清中Col-III、Col-IV、层黏连蛋白和透明质酸的水平,并刺激纤维组织的增殖[57]。进一步研究表明,姜黄素抑制病毒诱导的急性呼吸窘迫综合征小鼠模型中的后续纤维化,减少了α-SMA和腱糖蛋白-C的表达[40]。与正常肺相比,博来霉素肺中糖蛋白的含量和参与糖蛋白代谢的酶活性增加,而姜黄素可抑制博来霉素诱导的糖蛋白代谢[58]。
MMPs和金属蛋白酶的组织抑制剂(tissue inhibitor of matrix metalloproteinases,TIMPs)参与ECM的合成与降解,其中MMPs的主要作用是降解ECM,而TIMPs能特异性抑制其活性。Chauhan等[59]发现姜黄素可以通过降低MMP-9的活性和表达来抑制肺纤维化的发展。而在百枯草诱导的肺纤维化小鼠中发现,姜黄素不止可降低MMP-9的水平,且可调节肺组织中TIMP-1的表达,进而改变MMP-9/TIMP-1之间的平衡来缓解肺纤维化[60]。研究表明肺结核分枝杆菌感染会导致肺纤维化,从而导致肺功能不可逆地降低。Lee等[61]研究发现肺结核分枝杆菌刺激TLR2以激活JNK信号级联,进而增加激活蛋白-1与结缔组织生长因子(connective tissue growth factor,CTGF)启动子区域的结合能力,最终诱导人肺成纤维细胞中CTGF和ECM的表达;而姜黄素可以抑制肺结核分枝杆菌诱导的CTGF表达,推测其可通过抑制TLR2信号通路介导的ECM沉积发挥抗肺纤维化作用。综上表明,姜黄素可以通过减少ECM中的各种成分来缓解肺纤维化。
7 结语与展望
肺纤维化的发病率呈逐年升高趋势,其最终导致呼吸衰竭,严重影响患者生存质量和生存率。肺纤维化的发病机制尚不完全清楚,目前临床上尚无有效的治疗手段。因此,寻找更加有效的治疗靶点及药物研发是当下的首要任务。姜黄素在体内外实验研究中都表现出较好的抗纤维化作用[62],可抑制成纤维细胞的增殖分化、调控细胞凋亡、抑制炎性反应、调节TGF-β、抑制氧化应激、抑制ECM沉积等,其作用机制主要与调控TGF-β信号通路、NF-κB信号通路、MAPK信号通路、TLRs信号通路、PPARγ/PDGFβ的信号传导通路有关,提示姜黄素在防治肺纤维化方面具有良好的研究开发价值。但是,姜黄素抗肺纤维化作用和分子机制研究中多数信号通路研究尚不完整,大多停留在检测蛋白或基因表达的层面,进一步的研究需要借助转基因和基因敲除动物、细胞模型激动或抑制关键蛋白的表达,并结合结构药理学研究方法明确其抗肺纤维化的作用靶点和结合位点。更多研究表明Wnt/β-连环蛋白信号通路、音猬因子蛋白信号通路、Notch信号通路参与了肺纤维化的发生与发展,但姜黄素是否可调控这些信号通路还未见报道,后续可以借助于代谢组学、转录组学及蛋白质组学等探究其与疾病之间潜在而复杂的关系,通过体内外实验进一步验证研究。此外,姜黄素的水溶性较差,阻碍其口服吸收利用,以姜黄素作为先导化合物,研发其衍生物、类似物或全合成产物及其构建纳米递药系统[63],使其性能优良、溶解性能好、生物利用度高、代谢稳定、不良反应小、生物活性显著,将为姜黄素开发成治疗肺纤维化的新药提供临床科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Richeldi L, Collard H R, Jones M G. Idiopathic pulmonary fibrosis [J]., 2017, 389(10082): 1941-1952.
[2] Hutchinson J, Fogarty A, Hubbard R,. Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review [J]., 2015, 46(3): 795-806.
[3] Monguió-Tortajada M, Bayes-Genis A, Rosell A,. Are mesenchymal stem cells and derived extracellular vesicles valuable to halt the COVID-19 inflammatory cascade? Current evidence and future perspectives [J]., 2021, 76(2): 196-200.
[4] Thannickal V J, Zhou Y, Gaggar A,. Fibrosis: Ultimate and proximate causes [J]., 2014, 124(11): 4673-4677.
[5] Justet A, Klay D, Porcher R,. Safety and efficacy of pirfenidone and nintedanib in patients with idiopathic pulmonary fibrosis and carrying a telomere-related gene mutation [J]., 2021, 57(2): 2003198.
[6] Lin Y, Yi O Y, Hu M Y,. Multifunctional nanoparticles of sinomenine hydrochloride for treat-to-target therapy of rheumatoid arthritis via modulation of proinflammatory cytokines [J]., 2022, 348: 42-56.
[7] 张敏, 王守安, 刘黎星. 雷公藤多苷干预TLR-NF-κB通路发挥免疫抑制作用 [J]. 中草药, 2014, 45(9): 1288-1292.
[8] 葛冰景, 曹红燕, 戴彦成, 等. 白芍总苷对葡聚糖硫酸钠诱导的IBD模型小鼠炎症因子水平的影响 [J]. 湖南中医药大学学报, 2020, 40(8): 957-963.
[9] Nelson K M, Dahlin J L, Bisson J,. The essential medicinal chemistry of curcumin [J]., 2017, 60(5): 1620-1637.
[10] Lelli D, Sahebkar A, Johnston T P,. Curcumin use in pulmonary diseases: State of the art and future perspectives [J]., 2017, 115: 133-148.
[11] 高蔚, 张德平, 华云峰. 姜黄素对大鼠肺成纤维细胞增殖和凋亡的影响 [J]. 实用医学杂志, 2008, 24(14): 2393-2396.
[12] 郝小惠, 郭志义, 张银红, 等. 姜黄素对人肺成纤维细胞凋亡及细胞周期的影响 [J]. 中国工业医学杂志, 2011, 24(6): 411-413.
[13] 何正平, 谢敏. 姜黄素对低氧下肺成纤维细胞增殖及I型胶原表达的抑制作用研究 [J]. 四川大学学报: 医学版, 2010, 41(4): 621-625.
[14] Bernard M, Yang B, Migneault F,. Autophagy drives fibroblast senescence through MTORC2 regulation [J]., 2020, 16(11): 2004-2016.
[15] Saidi A, Kasabova M, Vanderlynden L,. Curcumin inhibits the TGF-β1-dependent differentiation of lung fibroblasts via PPARγ-driven upregulation of cathepsins B and L [J]., 2019, 9(1): 491.
[16] Liu D S, Gong L, Zhu H L,. Curcumin inhibits transforming growth factor β induced differentiation of mouse lung fibroblasts to myofibroblasts [J]., 2016, 7: 419.
[17] Chen Y C, Chen B C, Huang H M,. Activation of PERK in ET-1- and thrombin-induced pulmonary fibroblast differentiation: Inhibitory effects of curcumin [J]., 2019, 234(9): 1-12.
[18] Sauler M, Bazan I S, Lee P J. Cell death in the lung: The apoptosis-necroptosis axis [J]., 2019, 81: 375-402.
[19] Drakopanagiotakis F, Xifteri A, Polychronopoulos V,. Apoptosis in lung injury and fibrosis [J]., 2008, 32(6): 1631-1638.
[20] Burman A, Tanjore H, Blackwell T S. Endoplasmic reticulum stress in pulmonary fibrosis [J]., 2018, 68/69: 355-365.
[21] Winters C J, Koval O, Murthy S,. CaMKII inhibition in type II pneumocytes protects from bleomycin-induced pulmonary fibrosis by preventing Ca2+-dependent apoptosis [J]., 2016, 310(1): L86-L94.
[22] Gouda M M, Rex D A B, Es S P,. Proteomics analysis revealed the importance of inflammation-mediated downstream pathways and the protective role of curcumin in bleomycin-induced pulmonary fibrosis in C57BL/6 mice [J]., 2020, 19(8): 2950-2963.
[23] Gouda M M, Prabhu A, Bhandary Y P. Curcumin alleviates IL-17A-mediated p53-PAI-1 expression in bleomycin-induced alveolar basal epithelial cells [J]., 2018, 119(2): 2222-2230.
[24] Moodley Y P, Caterina P, Scaffidi A K,. Comparison of the morphological and biochemical changes in normal human lung fibroblasts and fibroblasts derived from lungs of patients with idiopathic pulmonary fibrosis during FasL-induced apoptosis [J]., 2004, 202(4): 486-495.
[25] Hecker L, Logsdon N J, Kurundkar D,. Reversal of persistent fibrosis in aging by targeting Nox4-Nrf2 redox imbalance [J]., 2014, 6(231): 231.
[26] 高蔚, 张德平, 陈碧. 姜黄素对肺纤维化大鼠肺成纤维细胞凋亡的诱导作用[J]. 中华结核和呼吸杂志, 2009(1): 37-41.
[27] Rodriguez L R, Bui S N, Beuschel R T,. Curcumin induced oxidative stress attenuation by-acetylcysteine co-treatment: A fibroblast and epithelial cellstudy in idiopathic pulmonary fibrosis [J]., 2019, 25(1): 27.
[28] Tourkina E, Gooz P, Oates J C,. Curcumin-induced apoptosis in scleroderma lung fibroblasts: Role of protein kinase cepsilon [J]., 2004, 31(1): 28-35.
[29] Zhang D W, Huang C F, Yang C F,. Antifibrotic effects of curcumin are associated with overexpression of cathepsins K and L in bleomycin treated mice and human fibroblasts [J]., 2011, 12(1): 154.
[30] Shenderov K, Collins S L, Powell J D,. Immune dysregulation as a driver of idiopathic pulmonary fibrosis [J]., 2021, 131(2): e143226.
[31] Xu M, Deng B, Chow Y L,. Effects of curcumin in treatment of experimental pulmonary fibrosis: A comparison with hydrocortisone [J]., 2007, 112(2): 292-299.
[32] Punithavathi D, Venkatesan N, Babu M. Protective effects of curcumin against amiodarone-induced pulmonary fibrosis in rats [J]., 2003, 139(7): 1342-1350.
[33] Hamdy M A, El-Maraghy S A, Kortam M A E A. Modulatory effects of curcumin and green tea extract against experimentally induced pulmonary fibrosis: A comparison with-acetyl cysteine [J]., 2012, 26(11): 461-468.
[34] Punithavathi D, Venkatesan N, Babu M. Curcumin inhibition of bleomycin-induced pulmonary fibrosis in rats [J]., 2000, 131(2): 169-172.
[35] Cao H, Zhou X H, Zhang J P,. Hydrogen sulfide protects against bleomycin-induced pulmonary fibrosis in rats by inhibiting NF-κB expression and regulating Th1/Th2 balance [J]., 2014, 224(3): 387-394.
[36] Chen H G, Yang R J, Tang Y,. Effects of curcumin on artery blood gas index of rats with pulmonary fibrosis caused by paraquat poisoning and the expression of Smad 4, Smurf 2, interleukin-4 and interferon-Γ [J]., 2019, 17(5): 3664-3670.
[37] Miao Y M, Zhang Y J, Qiao S M,. Oral administration of curcumin ameliorates pulmonary fibrosis in mice through 15d-PGJ2-mediated induction of hepatocyte growth factor in the colon [J]., 2021, 42(3): 422-435.
[38] Fujimoto H, D'alessandro-Gabazza C N, Palanki M S S,. Inhibition of nuclear factor-kappaB in T cells suppresses lung fibrosis [J]., 2007, 176(12): 1251-1260.
[39] Conron M, Andreakos E, Pantelidis P,. Nuclear factor- κB activation in alveolar macrophages requires IκB kinase- β, but not nuclear factor-κB inducing kinase [J]., 2002, 165(7): 996-1004.
[40] Avasarala S, Zhang F F, Liu G L,. Correction: Curcumin modulates the inflammatory response and inhibits subsequent fibrosis in a mouse model of viral-induced acute respiratory distress syndrome [J]., 2015, 10(8): e0134982.
[41] Biswas S K, McClure D, Jimenez L A,. Curcumin induces glutathione biosynthesis and inhibits NF-kappaB activation and interleukin-8 release in alveolar epithelial cells: Mechanism of free radical scavenging activity [J]., 2005, 7(1/2): 32-41.
[42] 杨茂宪, 姚明, 徐龙生, 等. 姜黄素对急性呼吸窘迫综合征大鼠肺组织及气道重塑的影响 [J]. 中华危重症医学杂志: 电子版, 2021, 14(5): 368-373.
[43] Hewlett J C, Kropski J A, Blackwell T S. Idiopathic pulmonary fibrosis: Epithelial-mesenchymal interactions and emerging therapeutic targets [J]., 2018, 71/72: 112-127.
[44] Shaikh S B, Najar M A, Prabhu A,. The unique molecular targets associated antioxidant and antifibrotic activity of curcumin inmodel of acute lung injury: A proteomic approach [J]., 2021, 47(4): 627-644.
[45] Tyagi N, Singh D K, Dash D,. Curcumin modulates paraquat-induced epithelial to mesenchymal transition by regulating transforming growth factor-β (TGF-β) in A549 cells [J]., 2019, 42(4): 1441-1455.
[46] Shaikh S B, Prabhu A, Bhandary Y P. Curcumin targets p53-fibrinolytic system in TGF-β1 mediated alveolar epithelial mesenchymal transition in alveolar epithelial cells [J]., 2021, 21(8): 1441-1452.
[47] Tian R, Zhu Y, Yao J Y,. NLRP3 participates in the regulation of EMT in bleomycin-induced pulmonary fibrosis [J]., 2017, 357(2): 328-334.
[48] 朱杨阳, 李银生, 雷素英, 等. 姜黄素对急性肺损伤大鼠肺组织转化生长因子-β1/Smads信号通路的影响 [J]. 新乡医学院学报, 2015, 32(7): 603-605.
[49] Smith M R, Gangireddy S R, Narala V R,. Curcumin inhibits fibrosis-related effects in IPF fibroblasts and in mice following bleomycin-induced lung injury [J]., 2010, 298(5): L616-L625.
[50] Estornut C, Milara J, Bayarri M A,. Targeting oxidative stress as a therapeutic approach for idiopathic pulmonary fibrosis [J]., 2022, 12: 794997.
[51] Amini P, Saffar H, Nourani M R,. Curcumin mitigates radiation-induced lung pneumonitis and fibrosis in rats [J]., 2018, 7(4):212-219.
[52] Barsan M, Rajnoveanu A G, Cocarla A,. A study of oxidative stress and pulmonary damage after silica instillation in rats and the effect of curcumin administration [J]., 2021, 72(3): 239-247.
[53] 周刚, 牛建昭, 王继峰, 等. 姜黄素抗肺纤维化大鼠自由基损伤作用的实验研究[J]. 中国中药杂志, 2006, 31(8): 669-672.
[54] Lee J C, Kinniry P A, Arguiri E,. Dietary curcumin increases antioxidant defenses in lung, ameliorates radiation-induced pulmonary fibrosis, and improves survival in mice [J]., 2010, 173(5): 590-601.
[55] Ke S W, Zhang Y B, Lan Z H,. Curcumin protects murine lung mesenchymal stem cells from H2O2by modulating the Akt/Nrf2/HO-1 pathway [J]., 2020, 48(4): 1-11.
[56] Sun C B, Ying Y, Wu Q Y,. The main active components ofreduces collagen deposition in human lung fibroblast via autophagy [J]., 2020, 124: 109-116.
[57] 周刚, 王继峰, 牛建昭, 等. 姜黄素抗肺纤维化大鼠细胞外基质过度形成的实验研究[J]. 中国中药杂志, 2006, 31(7): 570-573.
[58] Durairaj P, Venkatesan S, Narayanan V,. Protective effects of curcumin on bleomycin-induced changes in lung glycoproteins [J]., 2020, 469(1/2): 159-167.
[59] Chauhan P S, Dash D, Singh R. Intranasal curcumin inhibits pulmonary fibrosis by modulating matrix metalloproteinase-9 (MMP-9) in ovalbumin-induced chronic asthma [J]., 2017, 40(1): 248-258.
[60] Tyagi N, Dash D, Singh R. Curcumin inhibits paraquat induced lung inflammation and fibrosis by extracellular matrix modifications in mouse model [J]., 2016, 24(6): 335-345.
[61] Lee H S, Hua H S, Wang C H,. Mycobacterium tuberculosis induces connective tissue growth factor expression through the TLR2-JNK-AP-1 pathway in human lung fibroblasts [J]., 2019, 33(11):12554-12564.
[62] 张少波, 孔艳玲, 赵云峰. 姜黄素对肺纤维化小鼠的保护作用及其机制研究[J]. 药物评价研究, 2019, 42(11): 2141-2146
[63] 刘肖莹, 杨婷惠, 尚广亮, 等. 姜黄素纳米递药系统的构建及性能表征 [J]. 中草药, 2019, 50(16): 3802-3807.
Research progress on molecular mechanism of curcumin against pulmonary fibrosis
ZHENG Lei1, 2, HUANG Hong2, WU Han2, ZHANG Jun-lan2, CAI Xiong1, 2, FAN Fu-yuan1
1. The First Hospital, Hunan University of Chinese Medicine, Changsha 410007, China 2. Institute of Innovation and Applied Research in Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410208, China
Pulmonary fibrosis is a chronic lung interstitial disease characterized by fibroblast proliferation and differentiation, excessive deposition of extracellular matrix (ECM), and impaired lung structure and function. Although some anti-fibrotic drugs such as pirfenidone and nintedanib have been used in clinic, they have not achieved satisfactory therapeutic effects. Therefore, there is an increasingly urgent need to develop anti-fibrotic drugs with promising clinical efficacy and favorable safety profile. Curcumin is a natural polyphenolic compound isolated from the medicinal plants,, and, and demonstrates significant anti-inflammatory, anti-bacterial, antioxidant, anti-lipid, anti-fibrotic and other pharmacological activities. Curcumin alleviates the progression of pulmonary fibrosis by inhibiting fibroblast proliferation and differentiation, regulating cell apoptosis, inhibiting inflammatory response, regulating transforming growth factors, inhibiting oxidative stress, and inhibiting ECM deposition. Research progress on molecular mechanism of curcumin against pulmonary fibrosis was summarized, and new targets and ideas for treatment of fibrotic diseases in clinic were discussed in this paper, in order to provide reference for further study of mechanism of curcumin against pulmonary fibrosis and its clinical application.
curcumin; pulmonary fibrosis; inflammatory response; transforming growth factor-β; oxidative stress
R282.710.5
A
0253 - 2670(2022)21 - 6909 - 10
10.7501/j.issn.0253-2670.2022.21.030
2022-08-08
湖南省科技创新重大项目(2020SK1020);湖南省“芙蓉学者奖励计划”资助项目(湘教通[2020]58号);湖南省121创新人才培养工程资助项目(湘人社函[2019]192号);湖南省“刘良院士专家工作站”资助项目(湘科协通[2020]34号);湖南中医药大学中医学国内一流建设学科项目(校行科字[2018]3号)
郑 蕾(1990—),女,博士研究生,研究方向为中医药防治急重呼吸疾病研究。E-mail: 578574340@qq.com
范伏元(1962—),男,教授,博士生导师,研究方向为中医药防治急重呼吸疾病研究。E-mail: ffy023@163.com
蔡 雄(1976—),男,博士生导师,湖南省“芙蓉学者”特聘教授,研究方向为中药抗炎免疫药理研究。E-mail: caixiong@hnucm.edu.cn
#共同第一作者:黄 红(1998—),女,硕士研究生,研究方向为中药抗炎免疫药理研究。E-mail: aquakcc@qq.com
[责任编辑 崔艳丽]
