基于ISSR和SRAP分子标记的黄精种质遗传多样性研究
2022-11-05李亚萍陈家栋陶正明
姜 武,李亚萍,陈家栋,陶正明, *
基于ISSR和SRAP分子标记的黄精种质遗传多样性研究
姜 武1,李亚萍2,陈家栋1,陶正明1, 2*
1. 浙江省亚热带作物研究所,浙江 温州 325005 2. 浙江农林大学 省特色中药资源保护与创新利用重点实验室,浙江 临安 311300
研究黄精居群遗传多样性,为黄精药材资源保护和新品种培育提供依据。以4个居群22个种源47份黄精种质资源为材料,选用14条ISSR和11对SRAP分子标记进行多态性检测、遗传多样性比较和聚类分析,揭示黄精种质的遗传多样性及地理分布特征。ISSR引物和SRAP引物分别扩增出186和142条清晰带数,其中多态性条带数分别为185和140,多态性比率(percentage of polymorphic bands,PPB)分别为99.46%和98.59%;遗传多样性分析显示,ISSR和SRAP标记下基因分化系数(st)分别为0.279 9和0.231 6,即黄精遗传变异主要发生在种群内,居群间基因流(m)分别为1.286 4和1.659 3,遗传相似系数在0.053 3~0.948 1和0.032 8~0.967 7。聚类结果显示,相同黄精药材基原种质聚在一起,ISSR和SRAP标记分别将黄精居群分为5和3大类群,且以ISSR标记的聚类结果更符合实际地域分布。黄精种质遗传多样性丰富,ISSR和SRAP标记可适用于黄精亲缘性鉴定,研究结果可为黄精资源的保护和育种提供一定参考。
黄精;分子标记;遗传多样性;种质资源;ISSR;SRAP
黄精为百合科黄精属多年生草本植物,我国对黄精的食用和药用历史已逾2000年[1]。黄精历来被视为益寿延年的珍品,又名“仙人余粮”[2]。传统中医学认为黄精具有补中益气、润心肺、强筋骨等功能。现代药理学研究证明,黄精具有增强免疫功能、调血脂、降血糖、延缓衰老等多种药理作用[3]。据《中国药典》年2020版收载,药材黄精为黄精Delar. ex Redoute、滇黄精Coll. et Hemsl或多花黄精Hua的干燥根状茎[4]。黄精主产于河北、内蒙古、陕西等省;滇黄精主产于贵州、广西、云南等省;多花黄精主产于贵州、湖南、云南、安徽、江西、福建、浙江等省[5-6]。黄精药材的需求量及栽培规模逐年递增,已是林药种植产业重要发展品种。因此,黄精不仅具有极高的保健价值,而且经济效益和生态效益显著[7]。
当前,研究人员对不同基原黄精药材的种子休眠机制、有效成分合成途径、药理功效等方面已有较多研究[8-13],而对黄精药材品种选育研究相对缺乏。优良品种选育研究的滞后,不仅易导致黄精栽培种质混乱,部分基地存在使用非药典规定物种混杂栽培,且以消耗大量的药材资源为代价存在种性退化问题,不利于黄精产业的健康可持续发展。黄精种质资源是其优良品种选育的基础材料,育种成效不仅取决于种质资源圃的数量,还取决于对各种质资源多样性的遗传规律掌握。分子标记能够直接在DNA水平检测个体间差异,具特异性强、准确度高及微量、快速等优点[14],已广泛应用于中药材相关育种工作中,是资源遗传多样性研究的重要手段[15-16]。本研究基于分子标记技术阐明黄精药材遗传多样性和地理分布特征,有助于深入开展黄精药材的新品种选育研究。
近年来,已有较多科研人员将各种分子标记技术应用在黄精属植物亲缘关系和遗传多样性研究领域,吴世安等[17]运用限制性片段长度多态性技术(restriction fragment length polymorphism,RFLP)对黄精属13个物种进行系统发育分析;王世强等[18]采用简单序列重复(simple sequence repeat,SSR)对鉴定32个野生黄精种质亲缘关系;陈友吾等[19]基于转录组数据开发鉴定多花黄精优良品种SSR标记;刘跃均等[20]利用目标起始密码子多态性分子标记(start codon targeted polymorphism,SCoT)对19份不同种源黄精材料进行遗传多样性分析;刘新等[21]采用简单重复序列(inter simple sequence repeat,ISSR)对20个种源多花黄精进行了遗传多样性和遗传变异规律研究。然而,尚未见相关序列扩增多态性(sequence related amplified polymorphism,SRAP)在黄精属资源分析中的应用,对同时使用多个分子标记进行黄精种质遗传多样性分析比较也未见报道。本研究基于ISSR和SRAP分子标记技术,对采自10省22个种源47份黄精种质的遗传多样性进行比较和综合分析,后续可有针对性选择具有优良性状亲本并进行基因型鉴别,对进一步利用分子标记缩短育种年限有现实意义。研究结果将为黄精药材的植物资源鉴定、科学保护和新品种开发选育提供一定参考。
1 材料与仪器
1.1 材料
2016年4月至2019年10月,收集浙江、福建、江西、安徽、云南、贵州、湖南、四川、陕西、河北省的3种黄精药材基原植物带芽根茎,浙江省亚热带作物研究所经陶正明研究员鉴定为黄精为黄精Delar. ex Redoute、滇黄精Coll. et Hemsl或多花黄精Hua,具体信息见表1。样品根据采集地来源分4个居群:华东(HD)29个;华中(HZ)4个;西南(XN)11个;北方(BF)3个。
1.2 仪器
ETC821型东胜龙PCR仪(苏州东胜兴业科学仪器有限公司);Gel Doc XR型凝胶成像系统(美国BIO-RAD公司);NanoDrop One型微量核酸蛋白浓度测定仪(美国Thermo Scientific公司);JY300型电泳仪(北京君意东方电泳设备有限公司);JY-SPCT型水平电泳槽(北京君意东方电泳设备有限公司);Milli-Q Academic A10型超纯水系统(美国Millipore公司);H3-18KR型台式高速冷冻离心机(湖南可成仪器设备有限公司)。
1.3 试剂
PlantDNAzol植物基因组DNA提取试剂(杭州莱枫生物科技有限公司);引物由有康生物科技有限公司合成;DL2000 DNA marker(Takara Bio公司);2×PCR Solution Premix PrimerSTAR HS高保真聚合酶(R010A,Takara Bio公司);琼脂糖(111806,西班牙Biowest Agrose);Gelred核酸染料(41003,美国Biotium);乙醇(AR)、异丙醇(AR)、三氯甲烷(AR)等购自上海贤鼎生物科技有限公司。
表1 黄精种质采集信息
Table 1 Collected informations of Polygonati Rhizoma germplasm
编号采样点样品数基原经度(E)纬度(N)海拔/m居群 ZJTS1浙江泰顺1多花黄精119.79°27.70° 229华东 ZJCA2~3浙江淳安2多花黄精118.95°29.50° 169华东 ZJYJ4浙江永嘉1多花黄精120.79°28.44° 919华东 ZJJD5浙江建德1多花黄精119.15°29.43° 300华东 ZJOH6浙江瓯海1多花黄精120.64°28.00° 10华东 ZJYQ7浙江乐清1多花黄精121.06°28.39° 123华东 ZJQY8~14浙江庆元7多花黄精119.24°27.59° 943华东 ZJSY15浙江松阳1黄精119.15°28.23° 606华东 ZJSY16~17浙江松阳2多花黄精119.15°28.24° 145华东 ZJLQ18~20浙江龙泉3多花黄精119.08°28.30° 671华东 ZJJN21~22浙江景宁2多花黄精119.69°27.89°1190华东 HBBD23~24河北保定2黄精115.36°39.16° 103北方 FJZH25~26福建政和2多花黄精118.53°27.21° 519华东 FJFZ27福建福州1多花黄精119.40°26.06° 789华东 SXLT28陕西临潼1多花黄精109.19°34.36° 454北方 HNAH29~32湖南安化4多花黄精111.43°28.35° 149华中 SCBZ33~34四川巴中2多花黄精106.45°31.25° 441西南 GZTR35~36贵州同仁2多花黄精108.49°27.74°1394西南 YNDG37~40云南大关4多花黄精103.53°27.64°2611西南 AHQM41~42安徽祁门2多花黄精117.57°29.68° 487华东 JXWY43~44江西婺源2多花黄精117.51°29.19° 183华东 YNPE45~47云南普洱3滇黄精101.30°24.00°1280西南
2 方法
2.1 样品的处理
每个种质10份单株以上,采挖间隔5 m以上,带采集地土移栽统一种于泰顺县司前镇溪口村浙江省亚热带作物研究所黄精种质资源圃。结合花型、根茎、叶片等形态学指标,采集生长良好的黄精幼嫩叶片于变色硅胶密封袋中干燥保存,用于后续DNA提取,一个样品为同一采样地的5丛不同植株叶片共同研磨提取所得。
2.2 基因组DNA提取
黄精药材基因组DNA采用plant DNAzol试剂进行提取。取100~500 mg叶片加液氮破碎后进行DNA沉淀、DNA清洗、DNA溶解去杂,每份黄精样品逐一提取DNA,稀释至20 ng/μL后用1.2%琼脂糖凝胶电泳检测质量后置于−20 ℃保存备用。
2.3 引物筛选及PCR扩增
在加拿大哥伦比亚大学UBC公司公布100条ISSR随机引物中的50条引物中和近年来已发表论文中较常用的88对SRAP引物中,分别筛选得到扩增条带多、背景清晰、多态性强、稳定性好的14条ISSR引物和11对SRAP引物,引物序列见表2。
ISSR和SRAP-PCR反应体系设定:12.5 μL的takara公司2×预混型Taq酶,1 μL浓度为10 mmol/L的引物,模板DNA含量40~60 ng,补水至25 μL。引物最佳退火温度设52 ℃。PCR扩增程序为:94 ℃、5 min;94 ℃、30 s,52 ℃、30 s,72 ℃、2 min,共计35个循环。72 ℃延伸7 min,4 ℃保存。取反应产物5 μL,1.2%琼脂糖凝胶电泳,5×TBE缓冲液,150 V跑胶40 min,紫外凝胶成像系统观测、保存。
2.4 数据统计与分析
选取清晰可辨的电泳条带,在相同迁移位点有条带的记“1”,缺失记“0”,分别统计ISSR、SRAP和二者混合数据(ISSR+SRAP)的0/1矩阵。采用PopGen 32.0软件计算多态位点百分率(PPB)、等位基因数(number of alleles,a)、有效等位基因数(effective number of alleles,e)、Nei′s基因多样性指数(gene diversity,)、Shannon′s多态性信息指数(Shannon′s information index,)、Nei′s基因分化系数(coefficient of gene differentiation,st)、居群总基因多样性(total gene diversity,t)、居群内基因多样性(gene diversity with provenances,s)、基因流(estimate of gene flow fromst,m)和Mantel检验地理距离和遗传距离相关性,采用Ntsys 2.1软件进行UPGMA聚类分析。
3 结果与分析
3.1 ISSR、SRAP多态性分析
ISSR多态性研究结果如表2所示,共扩增出186条条带,其中多态性条带185条,14条引物扩增出9~20条数目不等的条带,平均每条引物扩增13.29条,各引物检测到的PPB为92.86%~100%,平均为99.46%。13条引物多态性比例达100%,中UBC835扩增多态性比例最低,为92.86%。在SRAP多态性研究中(表2),11对引物扩增结果显示,各引物检测到的PPB为87.50%~100%,共检测得到142条特异性条带,其中多态性条带140个,平均PPB为98.59%,且以ME6+EM9组合的多态性位点最少,仅6个。
基于14条ISSR引物和11对SRAP引物建立了相应的黄精药材DNA指纹图谱,以ISSR中的引物UBC840和SRAP中引物ME2+EM3为例,扩增条带清晰,DNA片段相对分子质量大多为100~2000 bp,多态性信息丰富(图1)。
表2 ISSR引物和SRAP引物组合的扩增结果
Table 2 Amplification results of ISSR primers and combinated SRAP primers
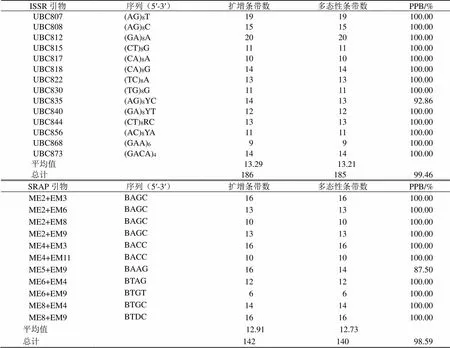
ISSR引物序列(5′-3′)扩增条带数多态性条带数PPB/% UBC807(AG)8T1919100.00 UBC808(AG)8C1515100.00 UBC812(GA)8A2020100.00 UBC815(CT)8G1111100.00 UBC817(CA)8A1010100.00 UBC818(CA)8G1414100.00 UBC822(TC)8A1313100.00 UBC830(TG)8G1111100.00 UBC835(AG)8YC1413 92.86 UBC840(GA)8YT1212100.00 UBC844(CT)8RC1313100.00 UBC856(AC)8YA1111100.00 UBC868(GAA)6 9 9100.00 UBC873(GACA)41414100.00 平均值 13.29 13.21 总计 186185 99.46 SRAP引物序列(5′-3′)扩增条带数多态性条带数PPB/% ME2+EM3BAGCAGCD1616100.00 ME2+EM6BAGCDGCA1313100.00 ME2+EM8BAGCDAGC1010100.00 ME2+EM9BAGCDACG1313100.00 ME4+EM3BACCDGAC1616100.00 ME4+EM11BACCDTCG1010100.00 ME5+EM9BAAGDACG1614 87.50 ME6+EM4BTAGDTGA1212100.00 ME6+EM9BTGTDACG 6 6100.00 ME8+EM4BTGCDTGA1414100.00 ME8+EM9BTDCDACG1616100.00 平均值 12.91 12.73 总计 142140 98.59
R=(A, G); Y=(C, T); B=TGAGTCCAAACCGG; D=GACTGCGTACGAATT
3.2 ISSR、SRAP遗传多样性分析
基于分子标记的“0/1”赋值矩阵统计黄精居群遗传多样性,结果如表3、4所示。在ISSR研究中,总体物种水平的a为1.994 6,e为1.343 1,为0.224 2,为0.363 4。4个居群的a变化幅度1.397 8~1.908 6,平均1.592 7;e变化幅度1.246 6~1.310 1,平均1.280 8;变化幅度0.145 5~0.200 2,平均0.172 7;变化幅度0.217 9~0.326 6,平均0.267 4;PPB变化幅度39.78%~90.86%,以华东居群多态位点比率最高,22个种源平均PPB为59.27%,小于物种多态性比率99.46%。4个居群之间的t为0.239 8,s为0.172 7,st为0.279 9,即居群间遗传变异占居群遗传变异的27.99%,72.01%的遗传变异在种内进行;种群间的m为1.286 4,表明黄精居群间存在一定的基因流动。

图1 ISSR引物UBC840 (A)和SRAP引物ME2+EM3 (B) 对47份黄精DNA的扩增结果
表3 黄精居群遗传多样性
Table 3 Genetic diversity of Polygonati Rhizoma
居群NaNeHIPPB/% ISSR 华东(HD)1.908 6±0.289 01.302 9±0.282 40.200 2±0.152 00.326 6±0.208 390.86 北方(BF)1.397 8±0.490 81.263 4±0.364 50.152 6±0.197 40.225 9±0.286 039.78 华中(HZ)1.403 2±0.491 91.246 6±0.348 20.145 5±0.190 80.217 9±0.277 340.32 西南(XN)1.661 3±0.474 51.310 1±0.329 20.192 4±0.179 80.299 0±0.257 666.13 居群水平1.592 71.280 80.172 70.267 459.27 物种水平1.994 6±0.073 31.343 1±0.287 40.224 2±0.148 90.363 4±0.195 099.46 SRAP 华东(HD)1.887 3±0.317 31.266 2±0.287 30.176 4±0.152 80.292 4±0.209 888.73 北方(BF)1.408 5±0.493 31.289 5±0.387 90.163 5±0.206 50.239 3±0.296 440.85 华中(HZ)1.507 0±0.501 71.286 8±0.348 30.172 9±0.189 20.262 5±0.275 350.70 西南(XN)1.676 1±0.469 61.316 9±0.332 20.196 1±0.180 30.304 7±0.257 367.61 居群水平1.619 71.289 90.177 20.274 761.97 物种水平1.985 9±0.118 31.311 0±0.287 40.205 4±0.148 50.337 5±0.196 798.59 ISSR+SRAP 华东(HD)1.899 4±0.301 31.287 0±0.284 70.189 9±0.152 60.311 8±0.209 3 89.94 北方(BF)1.402 4±0.491 11.274 7±0.374 50.157 4±0.201 10.231 7±0.290 240.24 华中(HZ)1.448 2±0.498 11.264 0±0.348 30.157 4±0.190 30.237 2±0.276 944.82 西南(XN)1.667 7±0.471 81.313 0±0.330 00.194 0±0.179 80.301 5±0.257 166.77 居群水平1.604 41.284 70.174 70.270 6 物种水平1.990 9±0.095 31.329 2±0.287 40.216 1±0.148 80.352 2±0.195 899.09
表4 黄精居群基因多样性
Table 4 Gene diversity of Polygonati Rhizoma
分子标记HtHsGstNm ISSR0.239 80.172 70.279 91.286 4 SRAP0.230 60.177 20.231 61.659 3 ISSR+SRAP0.235 80.174 60.259 41.427 3
在SRAP研究中,4个居群多态位点比率PPB变化幅度40.85%~88.73%,平均61.97%,小于物种多态性位点比率98.59%。与ISSR结果一致,PPB由高到低顺序为华东>西南>华中>北方;总的基因多样度t为0.230 6,种源内基因多样度s为0.177 2,基因分化系数st为0.231 6,即76.84%的遗传变异发生在种内。
为揭示更精细的黄精种质基因遗传多样性,本研究继续采用ISSR+SRAP的“0/1”矩阵数据相结合分析基因变异。结果显示,物种水平的a为1.990 9,e为1.329 2,为0.216 1,为0.352 2,PPB为99.09%;各居群的a变化幅度1.402 4~1.899 4,平均1.604 4;e变化幅度1.264 0~1.313 0,平均1.284 7;变化幅度0.157 4~0.194 0,平均0.174 7;变化幅度0.231 7~0.311 8,平均0.270 6;居群之间的t为0.235 8,高于种间遗传多样性s为0.174 6,st为0.259 4,即居群间遗传变异占居群遗传变异的25.94%,74.08%的遗传变异在种内进行,居群间的m为1.427 3(m>1)。
3.3 遗传距离及聚类分析
Nei′s遗传相似系数及遗传距离和UPGMA聚类图结果分别如图2和表5所示。ISSR数据中居群之间的遗传距离变化范围为0.053 3~0.194 5,遗传相似系数0.823 3~0.948 1,华东居群和西南居群相似系数最大,表明这2个居群的亲缘关系较近,遗传相似程度最高,而北方居群和华中居群相似系数最小。利用ISSR矩阵数据得到的UPGMA聚类图(图2-A)显示,47份种质被分成5类。分类结果有较显著的地域特征,来自浙江、福建、安徽和江西的华东居群紧紧聚成一类,来自云南、贵州、四川的西南居群聚成一类,来自河北的北方居群单独成一类,而来自浙江松阳居群ZJSY15单独为一类。

图2 42份栀子种质居群的UPGMA分析(ISSR,A;SRAP,B;ISSR+SRAP,C)
表5 基于ISSR和SRAP分子标记黄精4个居群的Nei′s遗传相似系数(右上角)和遗传距离(左下角)
Table 5 Nei′s genetic identity (above diagonal) and genetic distance (below diagonal) of four Polygonati Rhizoma populations based on ISSR and SRAP molecular markers
居群华东(HD)北方(BF)华中(HZ)西南(XN) ISSR 华东(HD)****0.870 80.948 10.946 4 北方(BF)0.138 3****0.823 30.855 8 华中(HZ)0.053 30.194 5****0.911 5 西南(XN)0.055 10.155 70.092 7**** SRAP 华东(HD)****0.894 10.945 60.967 7 北方(BF)0.111 9****0.847 70.910 0 华中(HZ)0.055 90.165 2****0.917 5 西南(XN)0.032 80.094 40.086 1**** ISSR+SRAP 华东(HD)****0.880 90.946 90.955 7 北方(BF)0.126 8****0.833 70.879 1 华中(HZ)0.054 60.181 9****0.914 0 西南(XN)0.045 30.128 80.089 9****
基于SRAP数据的遗传距离结果与ISSR数据类似,遗传距离变化范围为0.032 8~0.165 2,遗传相似系数0.847 7~0.967 7,相似系数以华东居群和西南居群最高,北方居群和华中居群遗传距离最大。UPGMA聚类图(图2-B)显示,47份种质被分成3类,分类结果基本按黄精药材基原植物聚类。来自华东、华中、西南居群的多花黄精聚在一起,且四川巴中(SCBZ33~34)和云南大关(YNDG39)的亲缘性更紧密,北方居群河北保定(HBBD23~24)的黄精聚在一起。
基于ISSR+SRAP数据,居群间的遗传相似系数和遗传距离结果与ISSR和SRAP的结果一致,但UPGMA聚类图则有更精细科学的分类(图2-C)。47份种质被分成3大类,第I大类是以华东、华中居群的多花黄精种质为主,云南普洱(YNPE45~47)的滇黄精种质则紧密聚合在一起,嵌在第I大类中;第II类为西南居群(SCBZ33~34、GZTR36、YNDG37~40)多花黄精种质,第III大类是北方居群河北保定(HBBD23~24)。遗传相似系数值为0.696时,第I大类的种质有较明显的地域特征,可分为4小类。以皖、赣、浙的黄精种质为分析对象,浙北地区淳安(ZJCA2~3)和建德(ZJJD5)聚在一起,属于千里岗山脉种质;分别来自皖南和赣北的安徽祁门(AHQM41~42)和江西婺源(JXWY43~44)居群聚在一起,属于皖赣交界处的五龙山脉种质;来自浙江松阳(ZJSY17)和景宁(ZJJN22)居群聚在一起,属于洞宫山脉种质;雁荡山脉的浙南(温州乐清、永嘉、泰顺、瓯海,丽水庆元、景宁、龙泉)和武夷山脉种质的闽北(福建政和)多花黄精聚成一小类,种质亲缘性近。
4 讨论
本研究对来自华东、华中、西南和北方4个居群22个种源47份黄精种质进行分子标记分析,选用14条ISSR和11对SRAP分别扩增出185和140条多态性性条带,PPB分别达到99.46%和98.59%,表明黄精种群间有丰富的遗传多样性。从扩增的多态性位点上看,ISSR标记更优于SRAP标记。华东居群的黄精种质遗传多样性变异水平最高,北方居群变异性最低。一方面这可能与采样数量有关,另一方面是北方居群的黄精药材基原植物主要是黄精,而华东居群的黄精居群,以浙江为例,基原植物以多花黄精为主外,还有引种的滇黄精和未入药典黄精药材目录的长梗黄精,且浙西南和皖、赣交界处山脉众多,丰富的气候、土壤和环境形成了华东居群丰富的遗传多样性,也预示这该产区的黄精种质抗逆性和抗风险能力强。
遗传分化系数st可用于判断种群间的遗传分化程度,且在st>0.25时,居群间分化程度则较高。基于ISSR+SRAP数据,4个居群st=0.259 4,说明25.94%的遗传分化存在于居群内,各居群之间有较高程度的分化。基因流m=1.427 3,表明基因流防止了遗传漂流引起的种群之间的遗传分化。一方面地理隔离,另一方面可能和黄精的授粉方式相关,黄精药材尤其是多花黄精,属于自花授粉,花丝比花柱稍长,花冠较长使得花柱不伸出[22]。因此,自然迁移和自然杂交率程度都较低。
从聚类结果看,ISSR标记的聚类结果更符合实际地域分布,SRAR标记的聚类结果则将北方居群黄精与其他黄精药材区分开。基于两标记混合数据(ISSR+SRAP)的聚类结果不仅能较好的区分不同基原植物,而且呈现一定地域性分布规律:华东多花黄精居群和华中多花黄精居群聚成一类,西南居群和北方黄精居群则分别聚成一类。聚类结果显示华东居群和华中居群亲缘性近,这一研究结果和近年来2个产区大力发展林药种植有关。黄精产业是践行“两山”理念,助力乡村振兴的重要载体,华东产区和华中产区交流较为密切,可能存在较多的种源引种交流。另一方面,华东产区的黄精种质聚类结果显示存在较明显的地域分布特征,主要被分成千里岗山脉系(浙西北)、五龙山脉系(皖南赣北)、洞宫山脉系(浙西南)、雁荡山脉系(浙东南)、武夷山脉系(浙西南+闽北)。其中浙西南的黄精种质具有丰富的遗传多样性,松阳、龙泉、庆元、景宁虽同属丽水产区,但由于山脉众多可能产生一定地理隔离,导致一定程度遗传分化。
黄精为我国药食两用药材,来源3种基原植物,产区分布广泛,近年来全国范围内大力发展林下经济,林下黄精的栽培面积逐渐扩大,相互引种也逐渐频繁,因此黄精的种质资源遗传多样性高。本研究首次基于2种分子标记方法研究主要黄精产区各居群的遗传多样性,揭示了黄精重点产区华东居群的种质地域分布特征,明确了浙西南地区黄精种质和武夷山脉系的闽北居群亲缘关系近,且遗传多样性丰富,本研究结果可为浙产黄精资源保护和选育开发提供一定的理论基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 姜程曦, 洪涛, 熊伟. 黄精产业发展存在的问题及对策研究 [J]. 中草药, 2015, 46(8): 1247-1250.
[2] 苏文田, 刘跃钧, 蒋燕锋, 等. 黄精产业发展现状与可持续发展的建议 [J]. 中国中药杂志, 2018, 43(13): 2831-2835.
[3] 姜程曦, 张铁军, 陈常青, 等. 黄精的研究进展及其质量标志物的预测分析 [J]. 中草药, 2017, 48(1): 1-16.
[4] 中国药典 [S]. 一部. 2020: 23.
[5] 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 2006: 126.
[6] 姜武, 叶传盛, 吴志刚, 等. 黄精的本草考证 [J]. 中药材, 2017, 40(11): 2713-2716.
[7] Chen D H, Han Z G, Si J P. Huangjing () is an emerging crop with great potential to fight chronic and hidden hunger [J]., 2021, 64(9): 1564-1566.
[8] 陈怡, 杨赋祺, 陈松树, 等. 多花黄精种子萌发过程的内源激素含量变化研究 [J]. 中药材, 2020, 43(3): 523-527.
[9] 姜武, 翁国杭, 陈家栋, 等. 基于LC-MS代谢组学的红杆与绿杆型多花黄精化学成分比较研究 [J]. 中国农学通报, 2021, 37(17): 32-38.
[10] Li L, Thakur K, Liao B Y,. Antioxidant and antimicrobial potential of polysaccharides sequentially extracted from[J]., 2018, 114: 317-323.
[11] Wang S, Wang B, Hua W,. De novo assembly and analysis oftranscriptome and identification of genes involved in polysaccharide biosynthesis [J]., 2017, 18(9): E1950.
[12] Shen W D, Li X Y, Deng Y Y,.Hua polysaccharide exhibits anti-fatigue activity via regulating osteocalcin signaling [J]., 2021, 175: 235-241.
[13] Wang C K, Peng D Y, Zhu J H,. Transcriptome analysis ofHua: Identification of genes involved in polysaccharide biosynthesis [J]., 2019, 15: 65.
[14] 王刚, 曹佩, 韦学敏, 等. 分子标记技术在药用植物种质资源研究中的应用 [J]. 中国现代中药, 2019, 21(11): 1435-1444.
[15] 姜武, 吴志刚, 陶正明, 等. 基于ISSR和SRAP标记的栀子种质遗传多样性研究[J]. 中草药, 2019, 50(2): 510-516.
[16] 岑晓霞, 孙健, 沈晓霞, 等. 基于SRAP和ISSR标记的栽培麦冬起源和遗传多样性研究 [J]. 中药材, 2021, 44(3): 555-561.
[17] 吴世安, 吕海亮, 杨继, 等. 叶绿体DNA片段的RFLP分析在黄精族系统学研究中的应用 [J]. 植物分类学报, 2000, 38(2): 97-110.
[18] 王世强, 王立儒, 刘帅, 等. 基于SSR标记的黄精品种(系) DNA指纹图谱库构建 [J]. 分子植物育种, 2018, 16(6): 1878-1887.
[19] 陈友吾, 廖荣俊, 叶碧欢, 等. 多花黄精转录组SSR位点分析及分子标记开发 [J]. 中草药, 2020, 51(1): 182-189.
[20] 刘跃钧, 张媛, 蒋燕锋, 等. 黄精种质资源遗传多样性研究 [J]. 浙江农林大学学报, 2016, 33(6): 1085-1091.
[21] 刘新, 斯金平, 段承俐, 等. 多花黄精遗传多样性和遗传变异规律研究 [J]. 中草药, 2020, 51(10): 2835-2841.
[22] 刘佳, 王文祥, 朱翔, 等. 多花黄精开花动态及传粉方式研究 [J]. 种子, 2017, 36(4): 41-45.
Genetic diversity analysis ofbased on ISSR and SRAP molecular markers
JIANG Wu1, LI Ya-ping2, CHEN Jia-dong1, TAO Zheng-ming1, 2
1. Zhejiang Institute of the Subtropical Crops, Wenzhou 325005, China 2. Zhejiang Provincial Key Laboratory of Resources Protection and Innovation of Traditional Chinese Medicine, Zhejiang A&F University, Lin′an 311300, China
To analysis the genetic diversity of Huangjing (), and to provide the evidences for resource protection and new variety breeding of.Taking 47 germplasm resources from 22 provenances of four community as materials, 14 ISSR and 11 SRAP markers were used for polymorphism detection, genetic diversity comparison and cluster analysis, to reveal the genetic diversity and geographical distribution characteristics of germplasm.A total of 186 and 142 clear bands were amplified by ISSR and SRAP primers, and the number of polymorphic bands was 185 and 140, respectively;The percentage of polymorphic bands (PPB) was 99.46% and 98.59%, respectively. The genetic diversity analysis showed that the coefficient of gene differentiation (st) of ISSR and SRAP markers were 0.279 9 and 0.231 6, respectively, indicating that the genetic variation was mainly within the population, and the interpopulation gene flow (m) value was 1.286 4 and 1.659 3, respectively. The genetic similarity coefficients ranged from 0.053 3 to 0.948 1 and 0.032 8 to 0.967 7. The clustering results showed that the populations were divided into five and three groups by ISSR and SRAP markers, respectively, and the clustering results of ISSR markers were more consistent with the actual regional distribution.The germplasm ofis rich in genetic diversity, ISSR and SRAP markers can be used to identify the phylogeny of. The results can provide some reference for the conservation and breeding of.
; molecular labeling; genetic diversity; gemplasm resources; ISSR; SRAP
R286.12
A
0253 - 2670(2022)21 - 6865 - 09
10.7501/j.issn.0253-2670.2022.21.025
2022-03-06
浙江省中药资源保护与创新利用重点实验室项目(2021E10013);温州市农业新品种选育协作组项目(2019ZX003-1)
姜 武(1987—),男,助理研究员,研究方向为中药材新品种选育及开发。E-mail: jiangwu8888@163.com
陶正明(1970—),男,研究员,研究方向为药用植物资源评价利用。Tel: (0577)88526876 E-mail: zmtao2002@aliyun.com.cn
[责任编辑 时圣明]
