仿刺参昼夜节律相关基因的筛查和表达分析
2022-11-04刘晓鲁孙景春高焕鑫林承刚
刘晓鲁,孙景春,高焕鑫,林承刚*
(1.中国科学院海洋生态与环境科学重点实验室,山东 青岛 266071;2.中国海洋大学海洋生命学院,山东 青岛 266003;3.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266237;4.中国科学院海洋大科学研究中心,山东 青岛 266071;5.中国科学院海洋牧场工程实验室,山东 青岛 266071;6.中国科学院大学,北京 100049)
引 言
大多数生物体内都存在生物节律(biorhythm),又称为生物钟(biological clock),不论是真菌、细菌亦或是人类,生物钟都会影响其一生中各项生命活动。生物节律可按照其循环周期分为近年节律(circannual rhythm)和昼夜节律(circadian rhythm)等[1-2]。近年节律包括与生物季节性周期变化相关的行为,如动物的生理行为(鱼类洄游、候鸟迁徙),植物的四季变化(发芽、开花、结果、落叶)等[2];昼夜节律是研究的最为深入生物节律,包括哺乳动物的睡醒周期、血压变化等生理活动[3-5],甚至近年来有研究表明,人体内淋巴细胞在血液和淋巴系统中的生理节律运动与日月交替同步,一天中不同时间点的适应性免疫反应的强度不一样[6];在昆虫中发现成虫羽化节律(adult emergence rhythms)周期约为24 h,果蝇Drosophilapseudoobscura集中在黎明前后羽化,随着光周期的变化其羽化高峰会发生转移[7];蜜蜂伴随着太阳升起探采花蜜,蚊虫在傍晚成群出没都属于昼夜节律运动[8]。
仿刺参(Apostichopusjaponicus,Selenka)又称为刺参,属棘皮动物门,海参纲,刺参科[9],是我国重要的海水养殖品种[10]。仿刺参作为一种底栖动物,长期处于一种黑暗、光照强度较低的环境中,在白天光照强度较高时,会躲避并栖息于礁石、大型海藻叶片等隐蔽处;而在日落之后直至凌晨天亮之前,活动较为活跃,表现出较为典型的负趋光性特征。张硕等[11]在研究不同光照以及人工礁模型对仿刺参行为影响时发现,在只有光照没有人工礁的条件下,大部分的仿刺参会停留在光照强度比较低的区域但个别仿刺参仍具有活动的现象;在光照和人工礁都存在的条件下,大部分仿刺参会停留并聚集在人工礁内或人工礁的阴影区域,且会长时间保持。由此可见,光照对于刺参来说是一种影响其活动节律的重要环境因子,光照周期的变化可能形成了仿刺参的昼夜活动节律。因其活跃的摄食活动发生在夜晚所以仿刺参被认为是一种昼伏夜出的动物。孙佳敏等[12]研究表明,给予仿刺参近似于自然光照周期(12L:12D)的条件,在光照阶段时其摄食活动比例较低,而在黑暗阶段,仿刺参从20:00的摄食活动开始活跃,比例迅速增加,在0—2:00时间段达到摄食高峰,随后黑暗阶段转入光照条件下时,仿刺参的摄食比例迅速下降,比例几乎为0,这佐证了仿刺参昼夜活动节律。光照是否为影响刺参昼夜活动节律的唯一环境因子?孙佳敏等[12]发现在全光照条件下(24 L),仿刺参仍然会从20:00开始增大摄食比例,到0:00和02:00之间达到峰值(13%),随后下降;而在全黑暗条件下(24 D)仿刺参一直处于活跃状态,但整体夜晚较白天更为活跃。可见在改变光照条件下仿刺参仍然能够保持其昼夜摄食节律,推测是由于其体内的生物钟所控制的内源性节律。昼夜节律受相关生物钟基因的节律性表达调控,生物钟基因编码的蛋白作为转录因子调控其靶基因的节律性表达,而形成自主调控的循环,其中一小部分被称为经典生物钟基因(clock gene,CG),包括CLOCK、TIM、PER、CYC(一种果蝇基因,相当于哺乳动物中的BAML1)等[13]。生物钟基因与启动子区域的特殊位点结合进而通过转录—翻译多反馈环路彼此之间相互作用,促进蛋白磷酸化形成、构建或破坏二聚体结构等方式形成一个24 h的时钟环路[14-15]。本研究将初步探究仿刺参全基因组中的生物钟基因,并利用不同光照条件下仿刺参触手的转录本数据[16]以表征光照对仿刺参生物钟基因表达变化。
1 方法
1.1 生物钟基因的筛查
在KEGG(Kyoto Encyclopedia of Genes and Genomes)搜索哺乳动物(Circadian rhythm,map04710)和果蝇(Circadian rhythm-fly,map04711)的昼夜节律通路,在KEGG Genes数据库中下载通路中的每一个基因的蛋白序列。在NCBI下载仿刺参的蛋白质序列(Genbank accession number: MRZV00000000),用于仿刺参相关基因的筛查。
1.2 基因同源比对
利用本地Blastp(https://trace.ncbi.nlm.nih.gov/Traces/sra/sra.cgi?view=software.NCBI SRA Toolkit, version 2.7.1)将下载的同源基因序列与仿刺参基因组蛋白序列进行双向对比,得到刺参中相应的候选同源基因,序列对比的E-value设为1e-10,并选取最小E-value的同源基因认为是最佳仿刺参生物钟候选同源基因。
1.3 生物钟基因的表达分析
根据作者已有不同光照条件下(黑暗对照组,120 lx光照5 min,120 lx光照1 h)仿刺参触手的RNA-Seq数据[16](SRA accession number:PRJNA590004),分析仿刺参生物钟基因的表达量变化情况。
具体而言,9只健康的成体仿刺参(体重103.59~120.84 g),购买于山东东方海洋科技有限公司。实验前,将仿刺参暂养在循环储水桶中适应1周,每天喂食一次,暂养温度为13.8 ℃至16.5 ℃。实验开始前,所有仿刺参随机分为三组,其中一组为黑暗条件对照组(“Dark”)。其他两组的仿刺参暴露于大约120 lx的光强环境下,一组暴露5 min(“Lt5m”),另一组暴露1 h(“Lt1h”)。三组在黑暗条件下的实验玻璃水缸中适应1 d。实验开始于早晨8点,在暴露于不同环境条件后,立即解剖仿刺参并收集触手样品,经液氮速冻并保存与-80 ℃以用于后续的RNA提取和测序。从三组仿刺参触手中提取RNA样品(3组×3个重复)并进行RNA质量检测。1 ug的total RNA为建库起始RNA,纯化后的cDNA文库在Illumina Novaseq 6000平台进行2×150bp paired-end测序。
2 结果
昼夜节律是一种内源性生物钟,在无外环境诱导下可大约维持24 h。通过整理KEGG Pathway数据库中哺乳动物和果蝇的昼夜节律通路每个基因,共筛选得到参考生物钟成员基因18个,其中CLOCK、BAML1/CYC和PER基因被认为是两个通路中共存基因。根据数据库的记录,部分基因有多个同工酶或由不同亚基组成,总计筛选得到29个参考基因,其KEGG基因编号列于表1中。Blastp搜索结果发现,绝大部分昼夜节律通路成员同源基因在仿刺参基因组中被鉴定出来,包括经典生物钟基因的CLOCK和BMAL1/CYC基因;少数基因虽然匹配到候选基因,但并非目标同源基因,如RORA(RAR-related orphan receptor alpha)和VRI(Vrille)基因,并且未鉴定出仿刺参中CKI1的epsilon亚基。除此之外,未能鉴定出任何一条DEC、PER基因的同源基因。总的来说,18个生物钟基因共鉴定出15个同源基因,但均未完全覆盖任何一种通路。
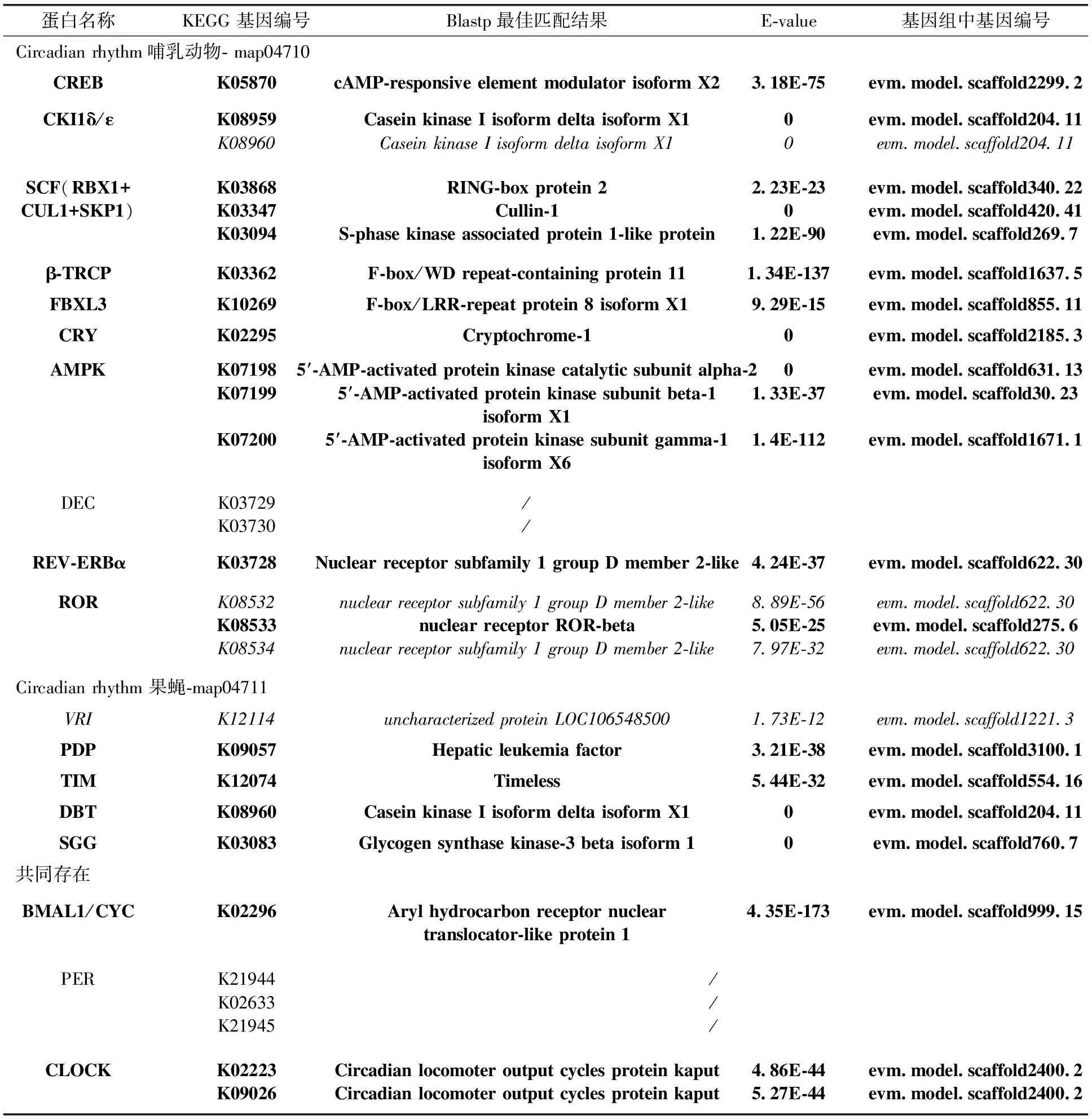
表1 仿刺参基因组中昼夜节律通路成员基因的同源性匹配结果

表2 不同光照下仿刺参触手转录本数据中部分生物钟基因表达情况
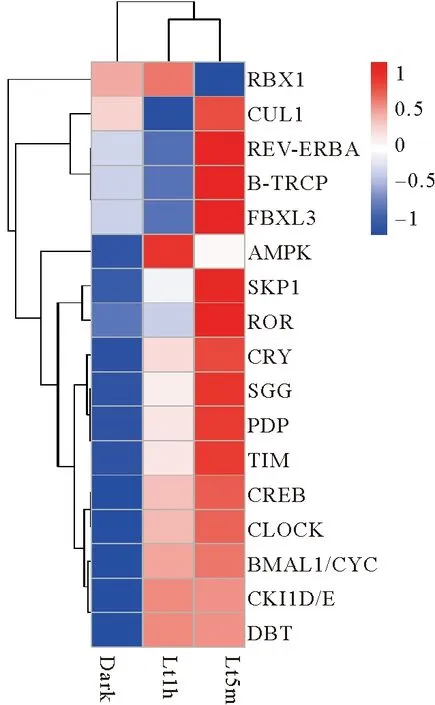
图1 仿刺参生物钟基因在不同光照下的表达模式
重新分析不同光照环境下仿刺参触手转录本数据中上述生物钟基因的表达变化以初步探究光照条件改变是否影响仿刺参节律。结果发现,在此转录本数据中只有CLOCK基因在Lt1h:Lt5m组具有显著下调表达(log2FC=-1.120 9,q-value=0.007 3),除此之外在Lt1h:Lt5m中还发现BMAL1/CYC(log2FC=-0.274 74)和TIM(log2FC=-0.792 95)也具有下调表达趋势。未发现有生物钟基因在Dark:Lt1h或Dark:Lt5m组有显著差异表达情况。随后将所有生物钟基因在不同光照条件下的表达量绘制聚类热图以直观表示光照对生物钟基因表达量的影响。结果表明,Dark组和Lt5m具有较相似的表达模式;除RBX1和AMPK以外,几乎所有的生物钟基因均在Lt5m组上调表达,在Lt1h组下调表达,就表达模式而言,光照能够在一定程度上影响生物钟基因在仿刺参中的表达量。
3 讨论
生物节律普遍存在于生物的各级水平,是生命科学的重大基础理论问题[17]。生物节律由机体的内源性生物钟驱动和调控,生物钟不停地自激振荡,同时根据接收到的外界环境周期性变化的信号来调控自振激荡,使机体生命活动的节律与环境同步,随外界环境的昼夜变化有节奏地、协调地进行[18]。生物钟存在机体的几乎所有细胞中,其在细胞功能中产生节律,使生物过程24 h与环境保持一致[2,19]。生物体的光受体接受光-暗周期信号,通过一系列生物钟基因表达变化,调节效应器的活动并与环境周期保持同步,是不同生物的生物钟运作的普遍分子机制[17,20]。尽管不同生物的生物钟基因的表达调控模式有所区别,但目前研究表明,从果蝇到哺乳动物的生物钟基因具有同源性[21-22],分化性[23],结构多态性[24-25],基因结构保守性[26]。本研究结果也表明,针对哺乳动物和果蝇的昼夜节律通路成员基因,在仿刺参基因组中找到了绝大多数的同源基因,支持了仿刺参的昼伏夜出的习性是其内源性生物钟调控结果,但大多数模式生物为昼行性昼夜节律,且PER等关键基因未能匹配到同源基因说明仍需要对仿刺参的昼夜节律调控机制进行深入探究。
在果蝇中,CLOCK和CYC均为转录因子,通常以异二聚体形式发挥正性调节作用。PER和TIM两种基因启动子的E-框是其作用的目标靶。CLOCK:CYC异二聚体能够激活PER和TIM基因转录生成相应蛋白,而且也激活VRI、PDF、CCG等基因生成蛋白质或引起相应生物学效应[27]。昆虫的行为节律受光周期制约,而在这种制约机制中光周期所起的作用是给内源性行为节律提供所需的时间信号[8]。转录本数据表明,在Lt1h:Lt5m组,CLOCK表达量显著下调,BMAL1/CYC也具有下调的趋势,CLOCK:CYC异二聚体下调表达可能会减弱这种正向调节作用,除了未检索到的PER同源基因,CLOCK:CYC异二聚体激活的TIM在Lt1h:Lt5m也具有下调趋势。上述生物钟基因下调表达能够减弱生物体的生物学效应,说明人为施加光源刺激能够在一定程度上干扰仿刺参节律,减弱其活动。仿刺参本是一种昼伏夜出的生物,在白天光照充足下活动较弱,栖息于自然界中光强较低的阴影处。孙佳敏等[12]的行为学实验也表明非正常的自然光照能够影响仿刺参摄食节律,结合转录本数据发现,生物钟基因在光照后5 min先上调表达,在光照1 h又下调表达,推测可能是仿刺参对突如其来的非常规光照刺激的一种应激表达现象;但是在5 min到1 h之间,生物钟基因受光照刺激后恢复正常的调控表达模式,下调表达以给予机体减弱活动的信号。
因目前尚未有任何关于仿刺参昼夜节律基因的研究,且大多数关于仿刺参自然状态下的行为研究集中于摄食活动与光照影响的行为特征,关于昼夜节律参考较少。本研究仍存在一定局限性,参考了人和果蝇昼夜节律通路,两者与仿刺参亲缘性仍较远,是否存在仿刺参特有昼夜节律基因仍需要系统和全面的研究;本文选取的为仿刺参触手只是仿刺参的局部组织,其它重要组织如体壁、管足等是否为重要的昼夜节律调节组织仍待考究,且本实验未进行生理实验验证,需要更全面和更深入的进一步探究,以填补经典生物钟基因的空白部分,阐明仿刺参的昼夜节律。
