Bacillus sp.JY-23 发酵制备胶原蛋白酶工艺优化
2022-11-04凌晓宁李昆太
张 荣,凌晓宁,邱 露,李昆太,2*
(1.江西农业大学 生物科学与工程学院/江西省农业微生物资源开发与利用工程实验室,江西 南昌 330045;2.广东海洋大学 食品科技学院,广东 湛江 524088)
【研究意义】近年来,我国渔业迅速发展,鱼类加工过程所产生的鱼骨、鱼皮、鱼鳞等副产物也随之逐年增加。然而这些鱼加工副产物的综合利用水平还较低,除一小部分用于生产鱼粉、肥料和鱼油,或直接用作水产养殖饲养的原料外,大部分作为废弃物被丢弃,造成严重的资源浪费与环境污染[1-2]。研究表明,鱼骨、鱼皮、鱼鳞等副产物是一种较为优质的蛋白质资源,富含胶原蛋白,具备开发活性胶原多肽的应用价值,同时也是鱼类副产物高值化利用领域的研究热点之一[3]。【前人研究进展】胶原蛋白分子结构是由3 条多肽链相互缠绕形成的三螺旋结构体,普通蛋白酶难以降解,只能被特定的胶原蛋白酶水解[4-5]。胶原蛋白可通过酸碱等方式水解,但该方式存在一定的环境污染和食品安全隐患,而胶原蛋白酶降解法更为人们所认可和接受。另外,胶原蛋白酶在适宜条件下可以特异性的水解天然胶原蛋白,而不损伤其他蛋白质和组织的酶类[6]。在微生物所产胶原蛋白酶作用下,胶原蛋白可转化为小分子生物活性胶原多肽[7],具有相对分子质量小、易吸收、抗氧化、降血压、增强免疫力等诸多生理功能活性[8-9]。胶原蛋白活性多肽现已广泛应用于食品工业、医药和化妆品等领域[10-12]。【本研究切入点】目前,报道的产胶原蛋白酶微生物菌株有梭菌[13]、短小芽孢杆菌[14]、蜡样芽孢杆菌[15]、枯草芽孢杆菌[16]、白色念珠菌[17]、放线菌[18]等。微生物可以将胶原蛋白酶分泌到胞外,利于通过发酵方式规模化生产[19]。微生物发酵产酶水平不仅取决于生产菌种自身特性,而且与发酵条件密切相关。其中,培养基组成、培养时间、pH、温度、接种量等多个因素都会对微生物产酶过程产生重要影响。因此,分离筛选新的胶原蛋白酶产生菌并开展其发酵工艺研究,对于实现鱼骨、鱼皮、鱼鳞等副产物的高值化利用具有重要研究价值。【拟解决的问题】本研究采用课题组前期筛选培育的一株能够产胶原蛋白酶的Bacillussp.JY-23,通过单因素试验、Plackett-Burman(PB)设计和响应面法对其产酶发酵条件和培养基组分进行优化,以提高菌株产胶原蛋白酶的能力,为鱼类加工副产物高值化开发生物活性胶原多肽提供研究基础。
1 材料与方法
1.1 材料与仪器
1.1.1 试验菌株芽孢杆菌JY-23(Bacillussp.JY-23)系本课题组自行分离鉴定,现保存于江西省农业微生物资源开发与利用工程实验室。
1.1.2 培养基LB 液体培养基:蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 10 g/L,pH 7.0,121°C 灭菌20 min。基础发酵培养基:葡萄糖10 g/L、蛋白胨10 g/L、NaCl 5 g/L、CaCl20.05 g/L、K2HPO43H2O 2.50 g/L、NaH2PO42H2O 0.50 g/L、自然pH(pH为6.0左右),121°C灭菌20 min。
1.2 实验方法
1.2.1 摇瓶发酵方法Bacillussp.JY-23 新鲜斜面以10 mL 无菌水刮下菌体,充分摇匀制备菌悬液。吸取1 mL 菌悬液接种于装量为50 mL/250 mL 三角瓶的LB 液体培养基中,37 ℃、160 r/min 摇床(全温振荡培养箱,DJS-2016R,上海世平实验设备有限公司)震荡培养12 h 作为种子液。将培养好的种子液接种于基础发酵培养基中,摇瓶震荡培养,取样测定发酵液的胶原蛋白酶活力。
1.2.2 发酵工艺的单因素优化以胶原蛋白酶活力为指标,采用单因素试验分别考察培养时间、温度、初始pH、接种量、装液量及外加碳氮源和金属离子等因素对Bacillussp.JY-23发酵产胶原蛋白酶的影响。
1.2.3 发酵工艺的PB实验设计利用Design-expert软件设计PB试验。在单因素试验基础上,选取4个发酵培养基组分(葡萄糖、酵母浸粉、氯化钠、Fe2+),以及4个发酵条件(培养时间、接种量、装液量、温度)共8个因素作为考察对象。其中,为计算试验误差,实际3个虚拟因素,试验次数N=12,各因素高低水平分别用1和-1表示,具体因素水平见表1 所示。
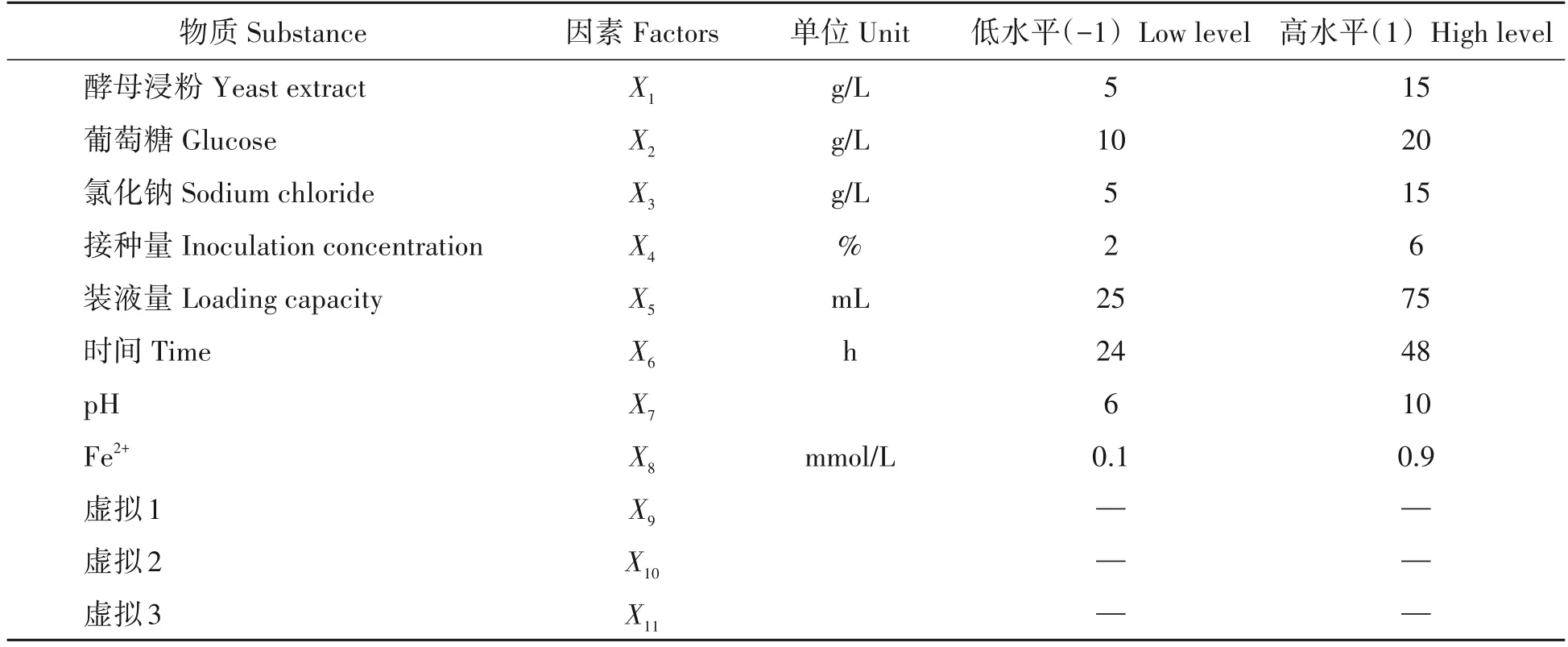
表1 PB试验设计Tab.1 PB expe rimental design
1.2.4 发酵工艺的响应面中心组合试验优化根据PB 试验结果筛选出对胶原蛋白酶酶活影响显著的因子,以酶活为响应值,利用中心组合实验(central composite design,CCD)进行4 因素5 水平共30 组试验,优化获得Bacillussp.JY-23发酵产胶原蛋白酶的最佳组合。具体的因素及其水平设置见表2。

表2 中心组合试验设计Tab.2 Experimental design of central combination
1.2.5 胶原蛋白酶酶活测定方法将培养好的种子液接种于基础发酵培养基中,37 ℃,160 r/min,震荡培养48 h,发酵液8 000 r/min,离心20 min,收集上清液,即获得胶原蛋白粗酶液。胶原蛋白酶酶活采用茚三酮显色法进行测定[20]。
1.2.6 数据统计与分析使用Excel 2019进行数据统计,使用Design-expert 8.0软件对PB试验和中心组合试验进行方差分析,使用Origin 2018对数据进行作图分析。
2 结果与分析
2.1 培养条件的确定
分别考察了培养时间、温度、培养基初始pH 值、接种量和装液量等培养条件对Bacillussp.JY-23 发酵产胶原蛋白酶活的影响(图1)。

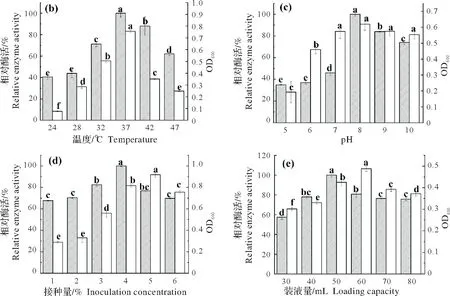
图1 不同培养条件下Bacillus sp.JY-23所产胶原蛋白酶的相对酶活变化Fig.1 Changes of relative enzyme activity of collagen proteinase produced by Bacillus sp.JY-23 under different culture conditions
由图1(a)可知,胶原蛋白酶活力随着发酵时间的延长先升高后降低,在第36 h时达到最高。36 h后酶活开始下降可能是由于发酵培养基中营养物质消耗过多,导致有害代谢物积累所致[21]。因此,Bacillussp.JY-23摇瓶发酵产胶原蛋白酶的最佳发酵时间为36 h。
对于微生物来说,温度是影响菌体生长及其产酶的一个重要因素。由图1(b)可知,随着发酵温度的上升,胶原蛋白酶的酶活力先升高后降低,在37 ℃时相对酶活达到最大值。因此,Bacillussp.JY-23摇瓶发酵产胶原蛋白酶的最适温度为37 ℃。
由图1(c)可知,随着发酵培养基初始pH值的不断增加,胶原蛋白酶活力先升高后降低。在初始pH值为8.0时,胶原蛋白酶相对酶活达到最大值,因此确定Bacillussp.JY-23发酵培养基的最佳初始pH为8.0。
由图1(d)可知,随着接种量的增加,胶原蛋白酶活力先升高后降低。当接种量为4%时,胶原蛋白酶活力最大。一般而言,接种量偏小会导致菌体延滞期拉长,进而影响菌体正常代谢[22-23];当菌种接种量过高时,菌体生长过快,培养基营养成分更多用于菌体生长[24],反而不利于胶原蛋白酶的产生。因此,Bacillussp.JY-23 摇瓶发酵产胶原蛋白酶的最佳接种量为4%。
由图1(e)可知,随着装液量的增加,胶原蛋白酶活力先升高后降低。当装液量较少时,发酵液中溶氧量较大,致使营养物质消耗过快,反而不利于产生胶原蛋白酶;随着装液量的增加,发酵液中溶氧量过低,限制菌体正常生长,进而影响到菌体产酶。因此,Bacillussp.JY-23摇瓶发酵产胶原蛋白酶的最适装液量为50 mL。
2.2 培养基组分的确定
分别考察了不同氮源种类对Bacillussp.JY-23 产酶的影响,图2(a)表明该菌株可以利用多种氮源,其中最佳氮源为酵母浸粉。随后对酵母浸粉浓度做进一步的优化,图2(b)显示25 g/L 酵母浸粉添加量下的胶原蛋白酶相对酶活达到最大。
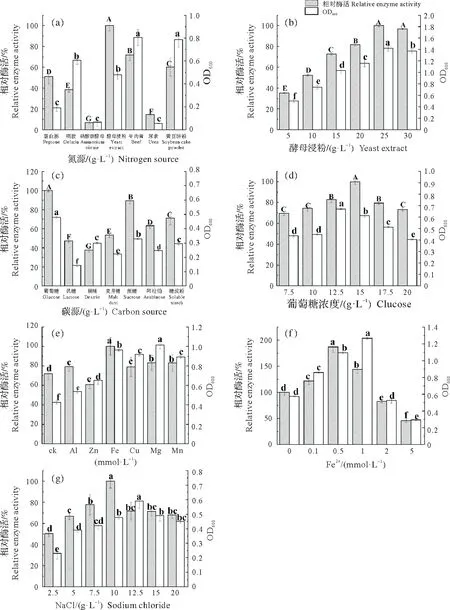
图2 发酵培养基组分单因素筛选结果Fig.2 Single factors screening of the components in fermentation medium
碳源是微生物产酶必需的营养成分,能够为菌体的生长及产物合成提供必要的能量和物质基础。在初始培养基中,分别加入10 g/L 的不同碳源,由图2(c)可知,当葡萄糖作为碳源时,相对酶活达到最高。接着对葡萄糖的浓度做进一步优化,由图2(d)可知,葡萄糖的最佳浓度为15 g/L。
在初始培养基中,分别加入不同种类的金属离子。由图2(e)可知,Al3+、Mg2+、Mn2+、Fe2+对产酶均有促进作用,其中Fe2+的促进作用最为显著,其相对酶活达到最高。接下来对Fe2+浓度进行优化,由图2(f)可知,随着Fe2+浓度的增加,胶原蛋白酶活呈现先升高后降低的趋势,Fe2+的最适浓度为0.5 mmol/L。由图2(g)可知,NaCl 浓度对菌体产酶也有显著影响,当NaCl 浓度为10 g/L 时,相对酶活达到最大值,因此确定NaCl浓度为10 g/L。
2.3 PB试验分析
PB试验设计与结果见表3,利用Design-expert 8.0软件对结果进行方差分析,结果见表4。模型的P值在95%的置信区间内小于0.05,其决定系数R2=0.991 6,校正系数为0.954 3,证明此模型合理。由表4 可知,酵母浸粉、葡萄糖、接种量、Fe2+的P值小于0.05,差异显著,因此选择酵母浸粉、葡萄糖、接种量、Fe2+作为显著因素进行后续优化。

表3 PB试验设计与结果Tab.3 PB design and results
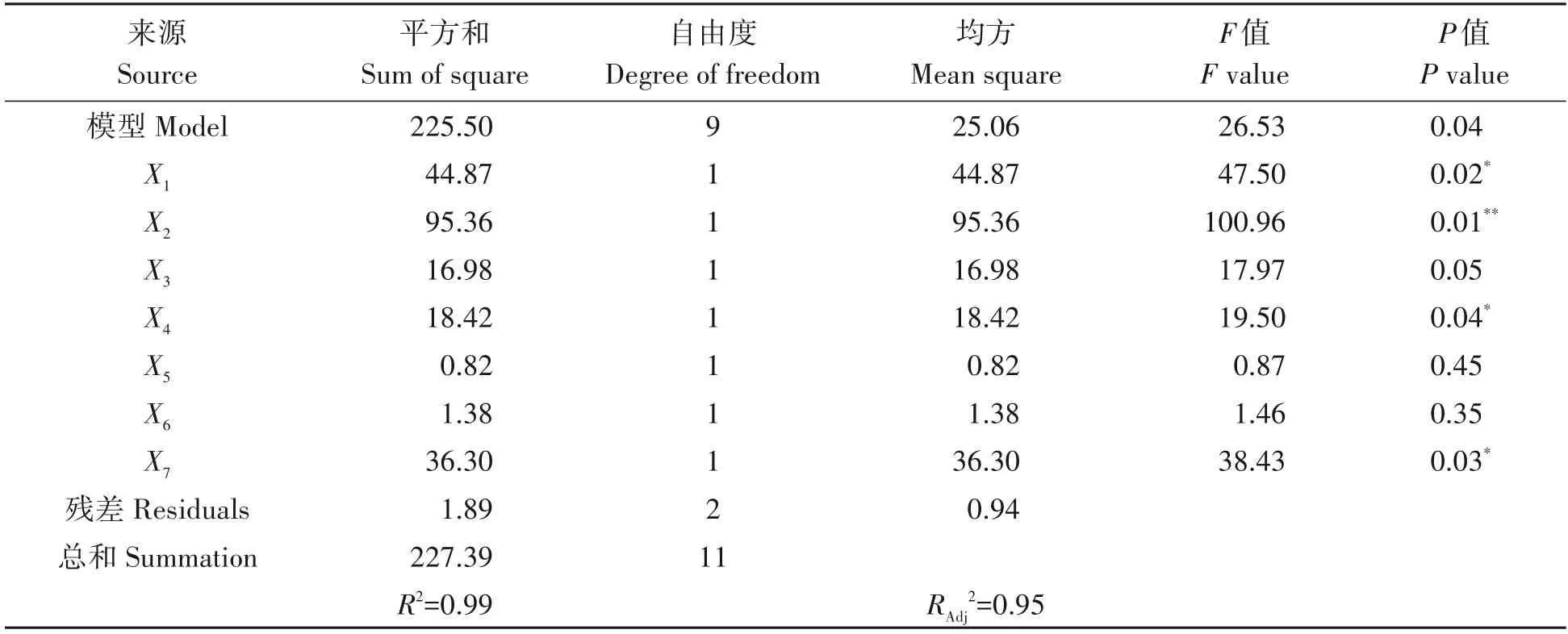
表4 PB试验方差分析Tab.4 Analysis of variance for the PB design
2.4 响应面中心组合试验分析
经PB试验筛选的酵母浸粉(X1)、葡萄糖(X2)、接种量(X3)、Fe2+(X4)进行了四因素五水平共30组的中心组合试验,具体实验设计与结果如图表5所示。

表5 CCD法实验设计及对应的响应值Tab.5 CCD design variable/leves with butanol production as response
以胶原蛋白酶的酶活为响应值,对中心组合试验结果进行多元回归拟合,得到胶原蛋白酶的二次回归模型方程为:Y=+20.80+3.39X1+1.88X2-0.15X3+0.55X4+2.59X1X2+0.041X1X3+0.020X1X4-0.61X2X3+0.016X2X4-0.75X3X4-0.20X12-0.50X22-0.47X32-0.89X42。回归模型方差分析和系数显著性结果如表6 所示。
由表6 可知,该模型P值小于0.01,极显著,由此可见该模型对胶原蛋白酶具有较好的预测;并且失拟项p值为0.283 4,不显著,说明方差拟合良好,可以用此数学模型推测试验的结果。根据F值大小,影响胶原蛋白酶的因素由大到小依次为酵母浸粉(X1)、葡萄糖(X2)、Fe2+(X4)、接种量(X3)。

表6 CCD试验方差分析Tab.6 Analysis of variance for the CCD
2.5 最佳产酶条件的确定及验证试验
从图3 可知,胶原酶活力响应值存在最大值,由回归方程求得的酶活力达到最大值时的最优组合为:葡萄糖19.60 g/L、酵母浸粉25.80 g/L、接种量2.97%、Fe2+0.75 mmol/L,此时预测的最大酶活力为27.84 U/mL。为检验试验结果的可靠性,采用优化后的培养基进行3 次验证试验。胶原蛋白酶活平均值为(28.13±0.66)U/mL,非常接近模型的预测值,表明试验得到的模型可以用于预测实际值,而且与优化前的酶活(5.94±0.22)U/mL 相比提高了4.73倍。
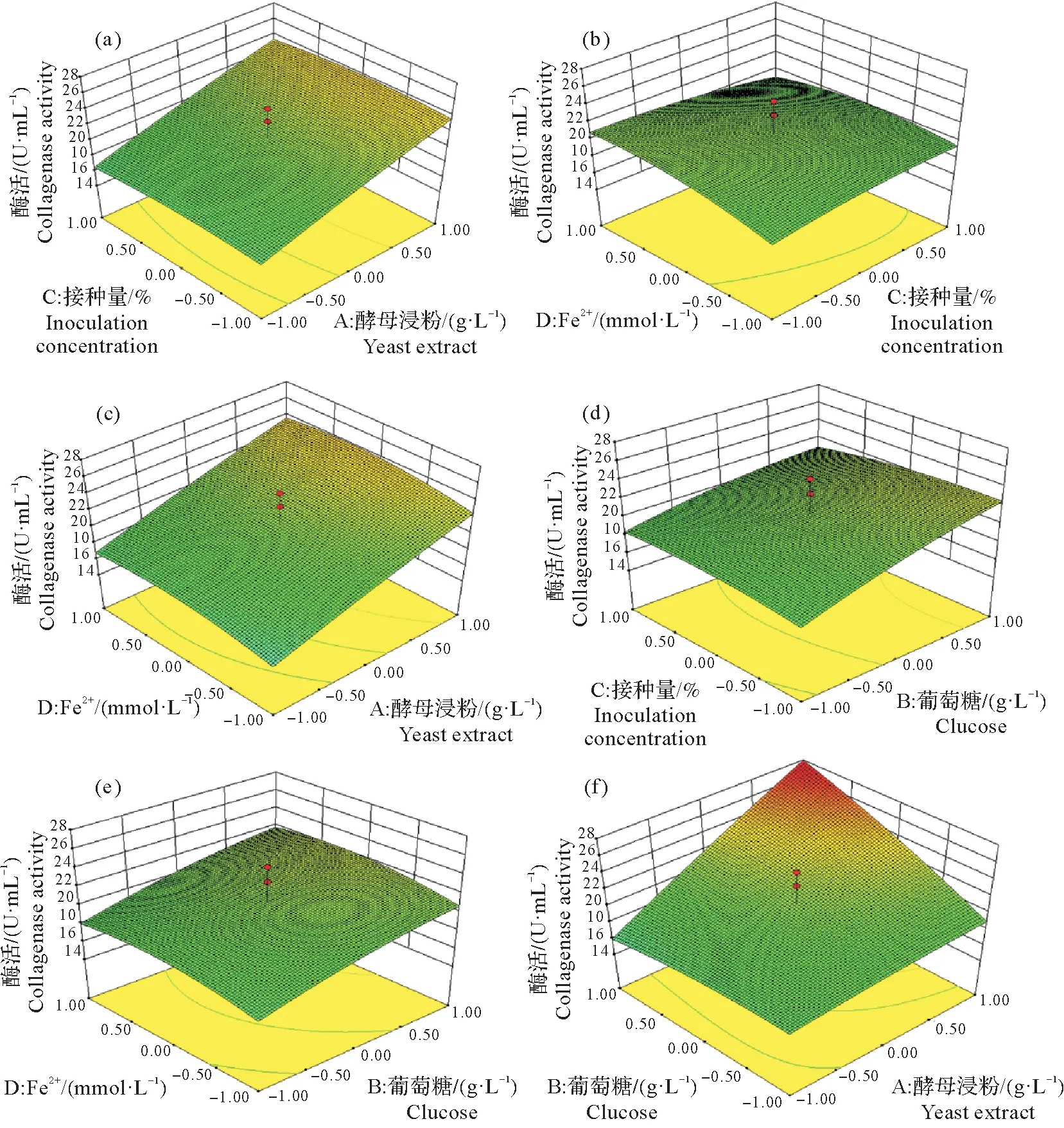
图3 不同因素之间对胶原蛋白酶活性影响的响应图Fig.3 Curves of response between different factors affecting collagenase activity
3 结论和讨论
优化发酵培养基组分以及发酵条件,是提高微生物产酶能力的有效手段。李文静等[25]筛选到一株耐盐的蛋白酶产生菌Bacillus subtilis,经响应面优化其发酵条件,蛋白酶活力比优化前提高了6.15 倍;Yang 等[26]采用PB 设计和响应面法对胶原蛋白酶产生菌Pseudoalteromonassp.SJN2 的发酵条件进行优化,使得胶原蛋白酶产量增加了2.2倍。
本研究通过对Bacillussp.JY-23产胶原蛋白酶的发酵培养基进行单因素筛选,得出葡萄糖为最适碳源,与李茂琳[27]在研究侧孢短芽孢杆菌AL-13产胶原蛋白酶的最适碳源一致;筛选出最适氮源为酵母浸粉,与宋立立等[28]对枯草芽孢杆菌发酵产蛋白酶的最适氮源一致。而李星硕等[29]等在利用胰蛋白胨、酵母浸粉、牛肉膏、明胶这4种氮源分别诱导Bacillus cereus产酶时,发现以胰蛋白胨作诱导时的胶原蛋白酶活性高于其它条件,推测可能不同的菌株有各自最适的诱导条件。笔者进一步通过PB试验和响应面设计等方法优化Bacillussp.JY-23 产胶原蛋白酶的发酵工艺,所得最适条件为葡萄糖19.60 g/L、酵母浸粉25.80 g/L、接种量2.97%、Fe2+0.75 mmol/L。在此优化条件下,Bacillussp.JY-23 胶原蛋白酶的酶活达到28.13 U/mL,较未优化前提高了4.95倍,而且显著高于Bhagwat等[30]筛选出的Pseudomonassp.SUK胶原蛋白酶酶活(13.81 U/mL)。
本研究采用单因素、PB设计、响应面设计对Bacillussp.JY-23产胶原蛋白酶的发酵培养基组分和发酵条件逐级优化,大幅提高了产酶水平,研究结果可为该菌株工业化发酵产胶原蛋白酶提供基础和参考。
致谢:江西省研究生创新专项资金资助项目(YC2020-S234),广东省普通高校重点领域专项(编号2021ZDZX4010)同时对本研究给予了资助,江西农业大学生物科学与工程学院彭帅英老师对研究给予了帮助,谨致谢意!
