齐墩果酸联合5氟尿嘧啶通过调控JNK信号通路影响肝癌细胞中钙离子的表达
2022-11-04吕艳欣李鹏辉任晓旭刘雅楠
董 静,王 玉,陈 萍,吕艳欣,李鹏辉,张 嵩,任晓旭,刘雅楠
肝癌是常见的恶性肿瘤之一,全球每年肝癌新增确诊病例多达84万[1]。近年来,虽然肝癌的治疗已取得了重大进展,但肝癌患者的病死率仍较高[2-3]。目前,天然抗肿瘤药物在临床应用中受到了广泛关注[4]。齐墩果酸(oleanolic acid, OA)是从女贞子、白花蛇舌草等中药材中提取的五环三萜类化合物,可增强化疗药物的敏感性,因此在癌症的预防和治疗方面具有独特潜力[5-6]。其与5氟尿嘧啶(5-fluorouracil, 5FU)协同对肝癌细胞中Ca2+表达水平及JNK通路影响的分子机制尚未明确。因此,本实验在前期研究基础上进一步探讨肝癌细胞中OA/5FU协同用药前、后Ca2+表达变化及其与JNK信号通路的相关性,为天然药物的临床应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞株 肝癌细胞株BEL-7402购于中国科学院动物研究所(中国北京)细胞库。
1.1.2药物与试剂 OA(SO8030)、5FU(IF0170)购自北京索莱宝公司;Mag-fluo-4 Ca2+指示剂(美国Thermo Fisher Scientific公司,M14206);Rhod-2AM Ca2+荧光探针(英国Abcam公司,ab142780);山羊抗小鼠IgG(北京中杉金桥公司,ZB-2305);SP600125(美国Med Chem Express公司,HY-12041)。
1.1.3仪器 IX83倒置荧光显微镜(日本Olympus公司);5200型化学发光成像系统(上海天能公司);全自动680酶标仪(美国BIO-RAD公司)。
1.2 方法
1.2.1细胞培养和分组 将细胞在含10%胎牛血清的培养基中培养。根据前期实验基础将细胞分为空白组、OA/5FU协同组(OA 100 μmol/L、5FU 40 μmol/L)、抑制剂组(SP600125 10 μmol/L)、抑制剂+OA/5FU协同组(SP600125 10 μmol/L、OA 100 μmol/L、5FU 40 μmol/L)。
1.2.2MTT法测定细胞活力 将细胞按照5 000个/孔接种在96孔板中,置于CO2培养箱中。给药24、48和72 h后,将20 μL MTT(5 mg/mL)加入各孔中,孵育4 h。将200 μL DMSO加入各孔中10 min。利用酶标仪检测490 nm处的吸光度值。
1.2.3集落形成实验 将单细胞悬浮液按200个/孔铺在6孔板中,孵育14天。4%多聚甲醛将细胞固定15 min。Giemsa染色30 min。拍摄菌落图像,并计数。
1.2.4胞质和线粒体Ca2+水平检测 24孔板中的BEL-7402细胞经药物处理后,分别加入500 μL线粒体Ca2+荧光探针Rhod-2AM和胞质Ca2+荧光探针Mag-fluo-4,37 ℃避光孵育30 min。D-Hanks液洗涤后每孔加入DMEM培养液,荧光显微镜检测胞质和线粒体中Ca2+水平。同时收集经药物处理的细胞,分别加入1 000 μL的Rhod-2AM和Mag-fluo-4,避光孵育30 min。收集细胞,洗涤后使用流式细胞仪进行检测分析。
1.2.5免疫荧光实验 细胞在4%多聚甲醛中固定10 min。使用0.3%Triton X-100封闭1 h。将Grp75抗体稀释于1%BSA/PBS/0.3%Triton X-100中,加入到细胞中4 ℃孵育过夜。将细胞与荧光染料标记的二抗室温下孵育1 h。DAPI复染,使用荧光显微镜检测信号。
1.2.6Hoechst 33342染色 将单细胞悬浮液按200个/孔铺在6孔板中,给药后各孔加入4%多聚甲醛1 mL,10 min后弃固定液。各孔分别加入Hoechst 33342染液1 mL(浓度为10 mg/L)室温作用30 min。洗涤后在荧光显微镜下拍照。
1.2.7Western blot分析 蛋白质裂解,冰上孵育30 min。4 ℃、15 000 r/min离心,收集上清液。分离蛋白质样品并转移到PVDF膜。将膜封闭2 h后与一抗4 ℃孵育过夜。用TBST将膜洗涤3次。将膜与结合HRP的二抗在室温下孵育2 h。使用荧光成像系统对结果进行定量分析。
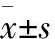
2 结果
2.1 OA/5FU协同对肝癌细胞活力的影响与空白组比较,OA/5FU协同显著降低了体外肝癌细胞的生存活力(P<0.05);在JNK通路抑制剂SP600125作用下,OA/5FU协同对体外肝癌细胞的生存活力有显著抑制作用(P<0.05,图1)。

图1 OA/5FU协同对肝癌细胞细胞活力的影响:*P<0.05
2.2 OA/5FU协同对肝癌细胞集落形成能力的影响与空白组比较,OA/5FU协同显著降低了肝癌细胞的集落形成能力(P<0.01)。在JNK通路抑制剂SP600125作用下,OA/5FU协同使肝癌细胞集落形成能力下降,抑制了肝癌细胞增殖(P<0.01,图2)。
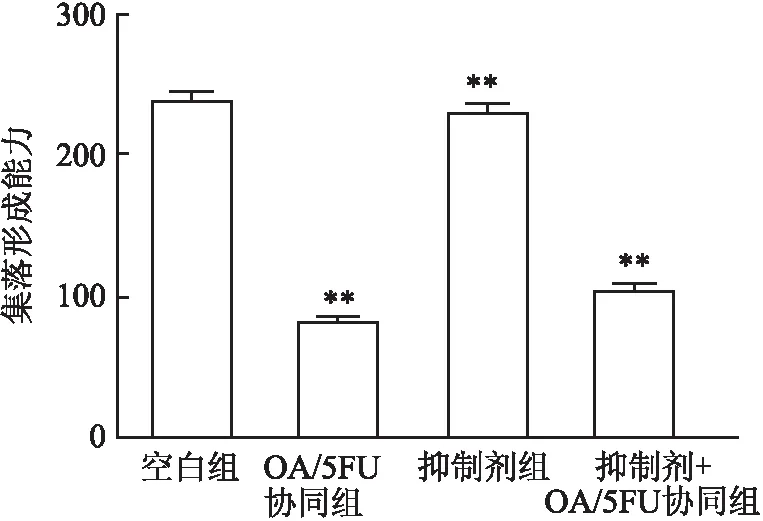
图2 集落形成实验检测OA/5FU协同对肝癌细胞增殖的影响:与空白组相比,**P<0.01
2.3 OA/5FU协同对肝癌细胞中Ca2+水平的影响通过线粒体Ca2+荧光探针Rhod-2AM和胞质Ca2+荧光探针Mag-fluo-4检测肝癌细胞中Ca2+水平,并通过流式细胞术分析Ca2+荧光强度。结果表明:与空白组相比,OA/5FU协同可增加肝癌细胞中Ca2+的表达;在JNK通路抑制剂SP600125作用下,OA/5FU协同促进肝癌细胞内Ca2+的释放且作用显著(图3)。提示OA/5FU协同可能是通过调控JNK信号通路影响肝癌细胞中Ca2+的表达水平。
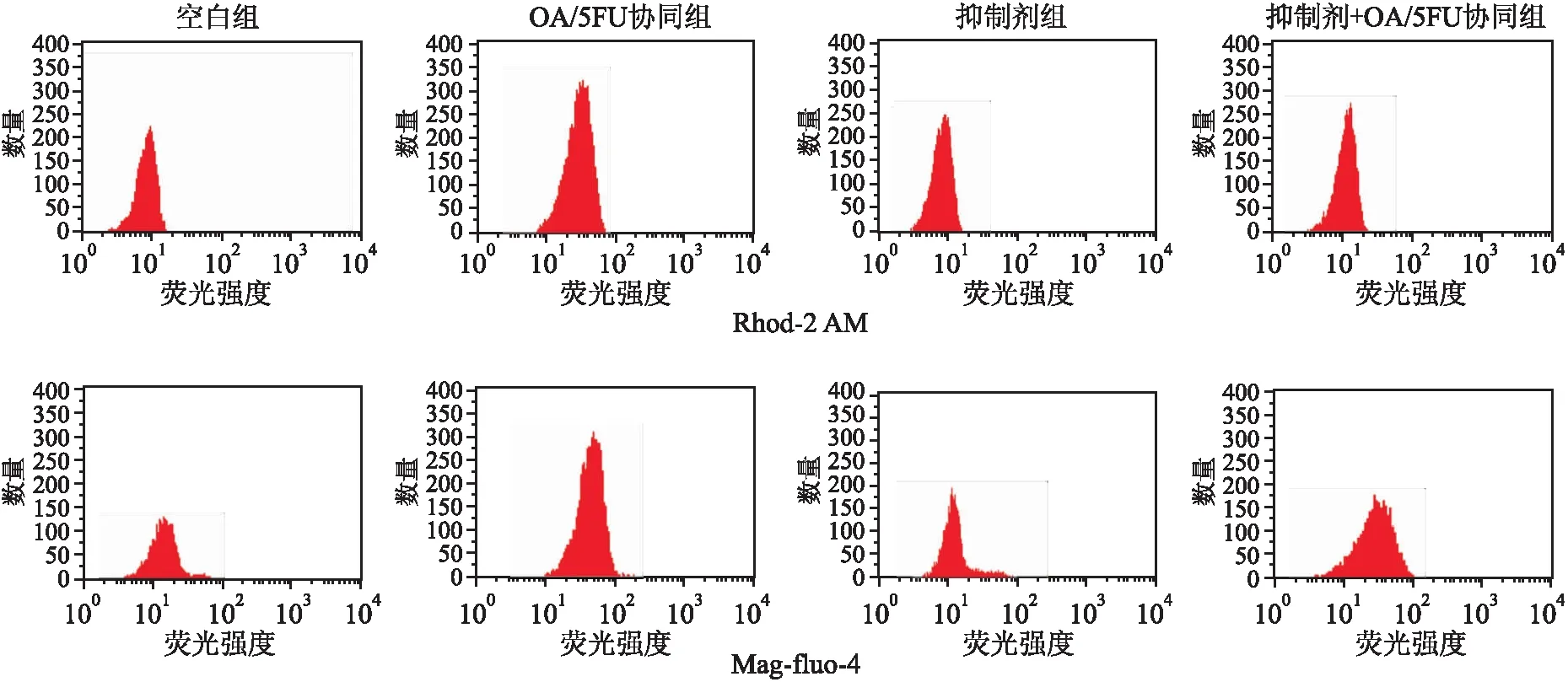
图3 OA/5FU协同对肝癌细胞中Ca2+水平的影响
2.4 OA/5FU协同对Ca2+通道Grp75蛋白的影响通过免疫荧光染色检测Ca2+通道相关蛋白Grp75的表达情况。结果表明,Grp75蛋白主要位于细胞质,在JNK通路抑制剂的影响下,OA/5FU协同可显著降低Grp75的表达(图4)。
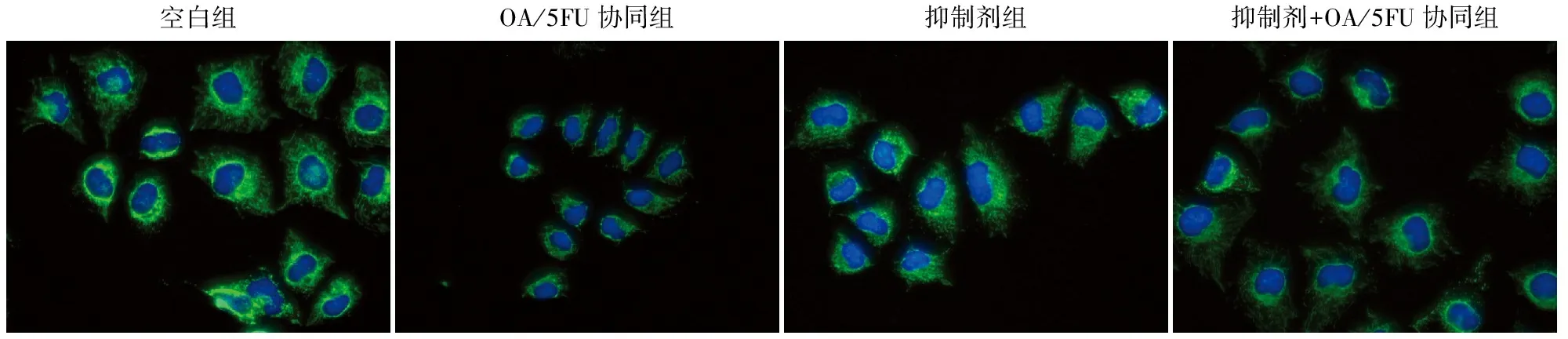
图4 肝癌细胞中Ca2+通道相关蛋白Grp75的IF染色:蓝色表示DAPI,绿色表示Grp75
2.5 OA/5FU协同对肝癌细胞凋亡的影响与空白组比较,OA/5FU协同可诱导肝癌细胞发生凋亡。在JNK通路抑制剂SP600125作用下,OA/5FU协同对肝癌细胞凋亡有明显诱导作用(图5)。
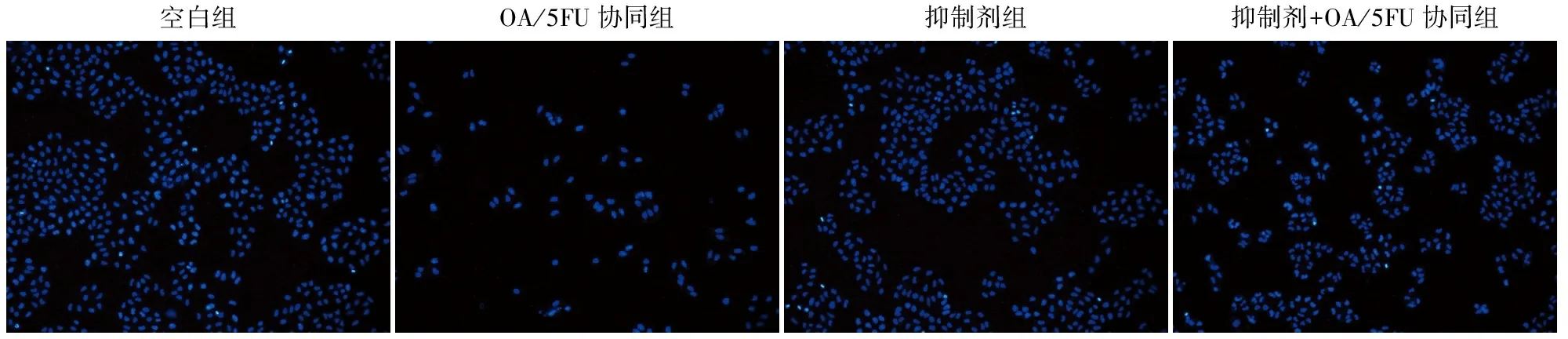
图5 OA/5FU协同对BEL-7402肝癌细胞凋亡的影响
2.6 OA/5FU协同对肝癌细胞中Ca2+通道相关蛋白和JNK通路相关蛋白表达的影响与空白组比较,OA/5FU协同降低了Grp75和PDI、BCL-2蛋白表达,而VDAC1、Bax和cl-Caspase3蛋白表达明显增多。上述结果提示,在JNK通路抑制剂SP600125作用下,OA/5FU协同可调控Ca2+通道相关蛋白的表达并通过调控JNK通路诱导细胞凋亡(图6)。
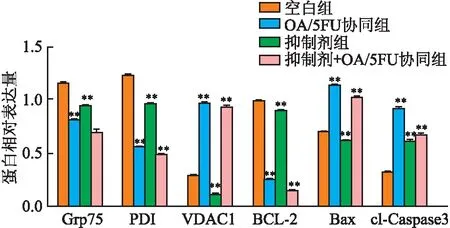
图6 Western blot检测OA/5FU协同对Ca2+通道相关蛋白和JNK通路相关蛋白的影响:与空白组相比,**P<0.01
3 讨论
OA是最常见的五环三萜化合物之一,主要存在于女贞子、白花蛇舌草等草本植物中,是一种著名的2期异种生物转化酶诱导剂。OA能有效地预防肝癌、胰腺癌和肺癌等多种疾病,因此受到广泛关注[7]。大量研究表明,联合用药可以提高抗癌药物的疗效并降低抗癌药物的细胞毒性。例如,在肝癌细胞中OA与常规化疗药物索拉非尼协同处理可诱导DNA片段和Caspase-3/7裂解[8];瑞格非尼片与OA联合可以进一步增强抗EMT的作用[9]。上述研究提示,OA可能具有调节肿瘤细胞敏感性的作用,具有成为增敏剂的潜力[10]。
JNK是MAPK家族成员之一,在DNA损伤修复、细胞自噬及细胞的增殖、凋亡中都起着重要的调控作用,其功能失调被认为与多种疾病的发病机制关系密切[11]。目前研究已证实,JNK信号通路可调控肝癌细胞周期及细胞凋亡。如肝癌耐药细胞中JNK1、JNK2及JNK3活性与肝癌细胞耐药程度呈负相关[12]。另外,激活JNK可使BCL-2磷酸化致使其活性受抑制,激活线粒体途径的主要介导者Bax,使细胞色素C等促凋亡线粒体蛋白释放至胞质内从而形成线粒体Ca2+内流和细胞色素C外流的交换通道,使下游Caspases活化启动凋亡通路。相反,在一定的刺激因素下JNK通路被抑制,BCL-2等抗凋亡活性蛋白失去了JNK磷酸化的激活,同样会加速细胞凋亡的发生。
近年来,肿瘤的形成过程与Ca2+生物学功能的研究逐渐成为热点。Messenger等[13]报道细胞内Ca2+升高对肿瘤的发生和转移至关重要。Flourakis等[14]也报道前列腺癌中Ca2+水平失调,并与TRPM8(冷感应)蛋白高表达有关,Ca2+信号传导在细胞增殖中发挥重要作用。Ca2+通道1,4,5-三磷酸肌醇受体作为细胞内唯一的钙释放通道,在其作用下Ca2+信号广泛参与基因表达、细胞分化等生理功能[15]。本实验中OA/5FU协同影响肝癌细胞中Ca2+水平,并影响着细胞凋亡相关蛋白的表达。上述结果提示,OA/5FU协同可能是通过调控Ca2+表达水平诱导细胞凋亡。
Ca2+信号在内质网和线粒体的联系中发挥关键作用,如参与脂质运输、能量代谢,对细胞存活率也有影响。两种细胞器之间的作用依赖于互补的膜蛋白,如电压阴离子通道VDAC1等。线粒体外膜的VDAC1与内质网的IP3R受体通过绑定Grp75、PDI等分子伴侣调控Ca2+从内质网转移到线粒体[16]。本实验发现,OA/5FU协同可以调控肝癌细胞中Ca2+通道相关蛋白Grp75和VDAC1的表达。此外,最近有研究发现抑制BCL-2能调控内质网与线粒体之间Ca2+通信,参与调节肿瘤细胞的药物敏感性[17-18]。
综上所述,OA/5FU协同通过调控JNK信号通路影响肝癌细胞内Ca2+的表达水平,可诱导细胞凋亡。但OA/5FU协同是否调节Ca2+通道开关及其调控JNK信号通路抑制肝癌细胞增殖的具体分子机制还需要进一步确认。OA/5FU协同对Ca2+水平的影响可能成为肝癌潜在的治疗方向,为临床治疗提供一些可供选择的策略。
