黄绵土中石油烃污染对蚯蚓的生态毒性风险研究
2022-11-04吴蔓莉肖贺月贺豪华王琪高敬华
吴蔓莉,肖贺月,3,贺豪华,王琪,高敬华
(1.西安建筑科技大学环境与市政工程学院,西安 710055;2.西北水资源与环境生态教育部重点实验室,陕西省环境工程重点实验室,西安 710055;3.西安建筑科技大学安德学院,西安 710311)
石油被誉为“工业的血液”和“黑色的金子”[1],是工业发展的主要能源物质。在石油的开采、冶炼、运输、装卸、加工和使用过程中,漏油事故会引起土壤污染和生态环境恶化[2]。对土壤中石油烃的生态毒性进行研究是治理和管控土壤污染的重要依据,只有基于真实的生态毒性效应确定石油污染的防治和治理技术,才能以优化模式进行污染土壤的修复治理和保护工作[3-5]。
蚯蚓是陆地生态系统中生物量最大的无脊椎动物之一,对土壤过程的物质循环和能量传递具有十分重要的作用[6]。蚯蚓对环境毒素和土壤污染物的响应十分敏感,因此可以用于指示土壤的污染状况,在石油污染场地中被广泛用于指示石油烃的生态毒性。TANG等[7]和黄盼盼等[8]利用蚯蚓作为指示生物研究了我国胜利油田石油污染土壤的生态毒性,发现中原油田污染土壤蚯蚓半数致死的LD50为1.37%~1.45%总石油烃(TPHs)含量。
目前对于石油污染生态毒性风险的研究多集中于对土壤毒性与总石油烃含量、污染时长、不同受试物种之间的关系进行定性和半定量描述[9-14],不同研究的受试对象和毒性结果之间差异较大[15-16]。WANG等[17]发现蚯蚓暴露于采自胜利油田的油泥28 d后LC50值为15.8%,GAINER等[15]的研究表明蚯蚓暴露于加拿大萨斯喀彻温省土壤14 d后的EC50值为3 950 mg·kg-1,HENTATI等[16]发现突尼斯斯法克斯油田区石油污染土壤对蚯蚓的EC50为644 mg·kg-1(以TPH计)。由于各油田区实验油品、土壤土质存在差异,使得毒性数据的适用性受到限制。
石油是由脂肪烃(直链或支链、环烷烃)、芳香烃(多环芳烃和单环芳烃)以及少量非烃物质组成的复杂混合物,各组分烃在总石油烃中的当量含量和毒性存在明显差异[18-20]。文献中多是对TPHs在土壤中的生态毒性风险进行评价,较少考虑不同组分烃的当量毒性风险贡献情况。本研究以蚯蚓作为指示生物,利用微宇宙毒性试验研究了黄绵土中不同石油污染水平的生态毒性,以正癸烷(C10H22)、正十六烷(C16H34)、正二十六烷(C26H54)作为烷烃组分的模式化合物,以蒽(An)、菲(Phe)、芘(Pyr)作为多环芳烃组分的模式化合物,探究了TPHs中当量烷烃和多环芳烃组分的生态毒性风险效应。研究结果可为预测石油污染对黄绵土的生态毒性风险提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 供试蚯蚓
实验用赤子爱胜蚓(Eisenia foetida)购于陕西省西安市某花鸟市场。选择环带显著、大小相近、体重在300~400 mg之间的成虫作为实验用蚓[21-22]。
1.1.2 供试土壤
供试土壤采自陕北志丹县油井附近未污染的表层(0~20 cm)黄绵土,土壤的理化性质:pH为8.0±0.1,含水率为2.2%±0.2%,氨态氮为68.79±2.72 mg·kg-1,硝 态 氮 为9.30±1.29 mg·kg-1,总 氮 为107.46±10.62 mg·kg-1,有机质为8.52±0.67 g·kg-1。
1.1.3 石油与化学试剂
所用石油为长庆油田采油六厂原油,属于石蜡基轻质原油。正癸烷、正十六烷、正二十六烷、蒽、菲、芘购自Sigma公司,正己烷、二氯甲烷(纯度≥99.5%)购自杭州化学试剂有限公司。超氧化物歧化酶(SOD)试剂盒和过氧化氢酶(CAT)试剂盒购自生工生物工程上海股份有限公司。
1.1.4 实验仪器
超声波细胞破碎仪(JY96-IIN,宁波新芝科技股份有限公司),高速冷冻离心机(TGL-20bR,上海安亭科学仪器厂),GC-MS联用仪(PE CLARUS 680,美国PE),台式微量冷冻离心机(Pico-21,美国Thermo Fisher),紫外可见分光光度计(UC2600A,美国尤尼柯)。
1.2 实验方法
1.2.1 石油污染土壤的制备
将清洁土壤置于阴凉通风处风干,剔除肉眼可见的石块、枝叶、根茎等杂物。土样研磨后过2 mm筛。根据预设最大含量,向12 kg土壤中加入840 g原油(溶于二氯甲烷)进行人工污染,从而获得高污染储备土,用未污染的黄绵土逐步稀释,获得不同污染水平的石油污染土壤。含油量从低到高依次为412±4、825±8、1 650±17、3 299±34、6 598±67、13 197±135、26 393±270、52 787±539 mg·kg-1,编号分别为1#,2#,3#,4#,5#,6#,7#,8#。对照组(CK)中只加入相同含量的二氯甲烷溶剂。
1.2.2 土壤中TPHs及不同组分烃的提取与测定
TPHs含量测定参考美国EPA3550C(METHOD 3550C)的方法,利用超声萃取提取土壤样品中的TPHs,并用质量法[23]测定含量:准确称取风干后的待测土样5.000 g于50 mL聚乙烯离心管中。加入25 mL萃取液(正己烷与二氯甲烷体积比为1∶1)。设置超声波细胞破碎仪功率180 W、超声开2 s、脉冲间隔1 s、-6℃,提取10 min后,在4℃、8 000 r·min-1条件下离心15 min。将上清液过滤后收集于已称质量的称量瓶内。对土壤进行3次重复萃取后,合并收集萃取液于称量瓶中。将称量瓶置于通风橱挥发、风干,质量恒定后称量并计算TPHs含量。
使用氧化铝硅胶层析柱进行TPHs中烷烃和多环芳烃组分的分离提取,用质量法测定含量。根据EPA8270C(METHOD 8270C)、8275A(METHOD 8275A)方法利用GC-MS联用仪测定脂肪烃中的正烷烃和芳香烃中的16种多环芳烃(PAHs)含量。
1.2.3 蚯蚓急性毒性试验
蚯蚓急性毒性试验参考《化学品蚯蚓急性毒性试验》(GB/T 21809—2008)。将蚯蚓清洗后清肠1 d,选取大小相近、环带明显、活动能力强、体质量在300~400 mg之间的成虫作为实验用蚓,用滤纸擦拭、称质量[24]。将配制的1#~8#污染土壤和清洁土壤(CK)各500 g分别置于9个直径为12 cm、高10 cm的塑料盒中,加水120 g至最大持水量的60%(含水率21%)[7]。平衡1 d后,每盆放入10条蚯蚓,然后用打孔的塑料盖密封,防止蚯蚓逃窜。每3 d喷水保持花盆恒质量,各浓度下设置三组平行试验。分别于第7天和第14天取出蚯蚓,计算蚯蚓死亡率、体质量抑制率、测定抗氧化酶SOD、CAT活性。
计算蚯蚓死亡率(Mj)和体质量抑制率(Nj)分别采用如下公式:

式中:yj为第j组的蚯蚓存活条数。

式中:Z0为各处理中的蚯蚓初始体质量,mg;Zj为各处理中蚯蚓7 d或14 d后的体质量,mg。
1.2.4 蚯蚓酶活性的测定
将清肠1 d后的冷冻蚯蚓充分研磨,并取0.1 g蚯蚓组织和9 mL提取液于1.5 mL EP管中。用涡旋机振荡均匀,以8 000g离心10 min。依照酶活性快速测试包(D799593-0050,D799597-0050)说明书,准确吸取定量的匀浆液和试剂至2 mL EP管,充分反应后利用紫外可见分光光度计测定吸光值A。以上操作均在4℃下进行。
①SOD的计算
抑制百分率(H)的计算:
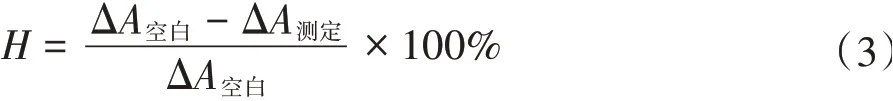
式中:ΔA空白=A空1-A空2;ΔA测定=A测定-A对照。
SOD活力单位(U):每毫升反应液中SOD抑制率达50%时所反应的SOD量为一个SOD活力单位。
动物组织SOD活力(U·g-1)计算:

式中:V反总为反应体系总体积,1.026 mL;V样为加入反应体系中样本的体积,0.09 mL;V样总为加入提取液体积,1 mL;W为样品质量,g;F为样本稀释倍数。
②CAT的计算
CAT活力单位(U):每克组织在反应体系中每分钟催化1 μmoL H2O2降解定义为一个酶活力单位。
动物组织CAT活力(U·g-1)计算:

式中:V反总为反应体系总体积,1.035 mL;d为比色皿光径,1 cm;V样为加入样本体积,0.035 mL;V样总为加入的提取液体积,1 mL;T为反应时间,1 min;W为样本质量,g;ε为H2O2摩尔吸光系数,43.6 L·mol-1·cm-1;106为单位换算系数,1 mol=106μmol。
1.3 数据分析处理
利用Excel 2016进行数据处理,实验结果以平均值±标准差(Mean±SD,n=3)表示。使用GraphPad Prism 9进行绘图。利用SPSS 26.0进行数据统计和单因素方差分析(ANOVA),经邓肯多重比较检验进行差异性显著性分析,设定P<0.05为显著水平。蚯蚓半数致死浓度LC50采用单位概率回归分析法计算。
2 结果与分析
2.1 石油污染土壤中的各组分烃含量
利用柱层析-质量法测得552 787±539 mg·kg-1石油污染土壤中脂肪烃总量为41 040±640 mg·kg-1,约占TPHs的77.75%;芳香烃总量为3 690±50 mg·kg-1,约占TPHs的6.99%。石油烃中各组分烃的含量占比如图1所示。

图1 石油污染土壤中各组分烃的含量占比Figure 1 Percentage of hydrocarbon fractions content in petroleum-contaminated soil
利用GC-MS测得52 787±539 mg·kg-1石油污染土壤中碳数为C7~C40的正烷烃总含量为5 067.7±21.1 mg·kg-1(图2a)。其中,C7~C10所占百分比为0.62%,C11~C16为22.45%,C17~C34为75.95%,C35~C40为0.99%。16种PAHs总含量为9.17±0.85 mg·kg-1(图2b)。其中,蒽(An)、菲(Phe)、芘(Pyr)分别占16种PAHs总量的4.14%、8.72%、1.53%。

图2 52 000 mg·kg-1石油污染土壤中的C7~C40正烷烃和16种PAHs含量Figure 2 Contents of n-alkanes and 16 PAHs in 52 000 mg·kg-1 oil-contaminated soil
2.2 蚯蚓对TPHs的毒性响应
2.2.1 不同石油污染水平对蚯蚓的体质量抑制率
将蚯蚓放入不同石油污染水平的土壤中,蚯蚓表现出不同的响应。在低石油烃含量的土壤中(TPHs<5 000 mg·kg-1),蚯蚓自动向下挖掘,颜色红润无变化。在较高石油污染水平的土壤中(TPHs>13 000 mg·kg-1),蚯蚓停留在土壤表面和花盆边缘,体型变细变长,色泽变暗,且不断扭曲弹动,有逃离土壤的行为,2 d后部分蚯蚓出现分泌体液,出血、身体断裂以及死亡现象。在中等含量石油污染土壤中(6 500±67 mg·kg-1)的蚯蚓比对照组中的蚯蚓更为活跃,产生“毒物应激效应”[25]。蚯蚓逃离土壤的行为称为回避行为,一些研究中使用蚯蚓回避率(NR)[15]来表示其所受石油烃毒性的影响程度,进而诊断土壤受石油污染的情况。
分别在第7天和第14天对蚯蚓进行计数、称质量,得到蚯蚓体质量变化如图4所示。土壤中含油量为400~6 500 mg·kg-1时,暴露7 d可致蚯蚓体质量减少20%以上,土壤中含油量超过13 000 mg·kg-1时,14 d可致蚯蚓体质量减少50%以上。土壤中石油含量越高,蚯蚓体质量减少量越大,说明重度石油污染造成了蚯蚓的生长障碍。对比7 d和14 d暴露结果,大部分土壤中的蚯蚓体质量减轻现象发生在前7 d。这可能是暴露7 d后由于蚯蚓对石油污染产生了适应性,甚至可能会促进石油的降解[26]。
2.2.2 TPHs与蚯蚓急性毒性的剂量-效应关系
以石油烃含量的对数作为横坐标,以蚯蚓死亡率的概率作为纵坐标,拟合得到线性回归方程,通过计算得出蚯蚓的7 d和14 d半数致死浓度(LC50),如表1所示。暴露7 d和14 d时,蚯蚓的LC50分别为20 378.38 mg·kg-1和11 336.27 mg·kg-1。这与TANG等[7]的结果相近。石油烃对蚯蚓的14 d半数致死浓度值小于7 d时的浓度,说明随着暴露时间的增加,石油烃对蚯蚓的致毒效应增强。

表1 石油烃对蚯蚓7 d和14 d的半数致死浓度Table 1 Fifty percent lethal concentrations(7 d and 14 d)of petroleum to earthworm
2.2.3 TPHs对蚯蚓酶活性的影响
不同TPHs含量污染土壤中暴露14 d的蚯蚓组织中SOD和CAT活性测定结果见图4。随土壤中石油烃浓度增加,蚯蚓SOD和CAT活性总体上均呈现出先增加后降低随后再升高的变化趋势。各处理组(52 787 mg·kg-1浓度下蚯蚓均已死亡,因此不分析此浓度下的数据)SOD酶活性均大于对照组(CK),土壤中TPHs浓度为26 393±270 mg·kg-1时,SOD酶活性达到最大,是对照组的1.57倍。土壤中石油烃浓度为1 650±17 mg·kg-1时,蚯蚓的CAT酶活性最大,是对照组的2.18倍。此后随石油烃浓度的增加CAT酶活性降低,在暴露剂量为6 598±67 mg·kg-1时最低,仅为对照组的85.7%。

图4 不同污染水平土壤中存活14 d蚯蚓组织中的SOD和CAT活性Figure 4 Enzyme activities of SOD and CAT of earthworms that survived in petroleum-polluted soil for 14 days
总体上,当土壤中TPHs浓度低于3 000 mg·kg-1时,SOD和CAT活性随TPHs浓度的增加被诱导而迅速上升,此时蚯蚓体内氧自由基增加,减少了细胞膜的氧化损伤,属于机体对胁迫环境的适应反应[27]。这体现出蚯蚓抗氧化系统对TPHs的应激敏感;当土壤中TPHs浓度在3 000~6 500 mg·kg-1之间时,两种酶活性降低,可能是由于蚯蚓需要消耗大量的酶以清除自由基;当土壤中TPHs浓度超过6 500 mg·kg-1,两种酶活性再次升高,可能是由于在高浓度石油污染条件下尽管存活的蚯蚓数量少,但可存活蚯蚓的抗氧化系统能力被极大激活所致。
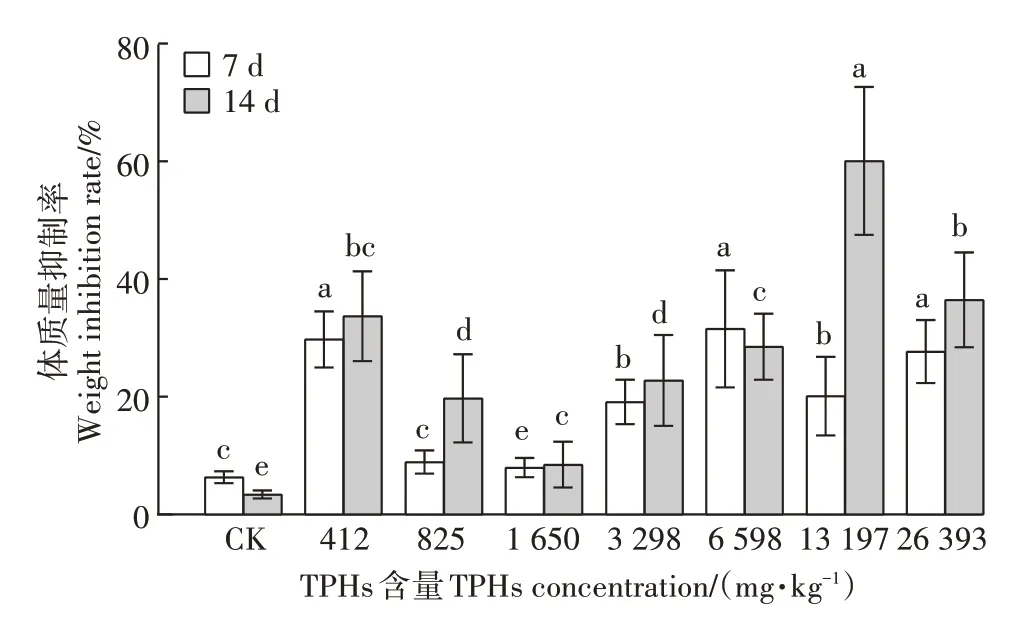
图3 不同石油污染水平条件下蚯蚓7 d和14 d的体质量抑制率Figure 3 Changes in body weight of earthworms at 7 and 14 days under different oil pollution levels
正常生理条件下,生物体内活性氧的产生和抗氧化防御系统酶之间存在动态平衡机制。而在不利的环境条件下,会引起生物体的氧化应激反应,产生具有极强氧化能力的O2-,是生物氧毒害的重要因素之一。抗氧化酶活性SOD和CAT是动物抵御活性氧破坏的两种重要酶,在清除O2-、H2O2以及阻止或减少羟基自由基中起着非常重要的作用,可反映动物体内活性氧清除能力或抗氧化能力的强弱[22]。本研究结果表明土壤受到低浓度石油污染后,诱发了蚯蚓体内产生大量氧活性自由基而造成氧化胁迫,导致活体蚯蚓通过启动SOD系统以清除自由基,进而减少细胞膜的过氧化作用[28]。同时启动CAT系统清除产生的H2O2,以维持机体平衡[22]。
2.3 石油烃不同组分对蚯蚓的毒性作用
根据2.2.2所得结果,蚯蚓在石油污染土壤中14 d的半致死浓度LC50=11 291 mg·kg-1,体质量抑制率的EC50为14 772 mg·kg-1。以此为依据,选取C10H22、C16H34、C26H54为烷烃组分的模式化合物,蒽(An)、菲(Phe)、芘(Pyr)为多环芳烃组分的模式化合物,取TPHs为10 000、30 000 mg·kg-1时各模式化合物的当量浓度(各组分在总石油烃中的浓度)作为添加浓度,探究不同模式化合物对蚯蚓的毒性效应。
2.3.1 烷烃组分对蚯蚓的毒性作用
根据2.1中烷烃组分测定结果,计算得到TPHs为10 000 mg·kg-1时,C10H22、C16H34、C26H54的浓度分别为3.22、48.34、52.73 mg·kg-1。向洁净土壤中分别加入三种模式化合物,使其在土壤中的浓度分别为3.22、48.34、52.73 mg·kg-1,同时对另外一组洁净土壤进行TPHs为30 000 mg·kg-1时的等当量烷烃污染,C10、C16、C26的当量浓度分别为9.67、145.01、158.20 mg·kg-1。利用蚯蚓作为指示生物研究当量烷烃组分的毒性风险,结果见图5。
整个实验期间,所有处理中蚯蚓未出现死亡现象,但各组之间体质量变化率存在差异。TPHs为10 000 mg·kg-1时的当量烷烃模式化合物的蚯蚓急性毒性试验抑制率见图5。对比CK组,三种烷烃模式化合物,蚯蚓体质量均表现出较高的抑制率。随着污染物剂量的增加,各处理组呈先升高再下降的变化趋势,但总体都高于CK组。其中,C16烷烃的体质量抑制率达到最高,处理7 d时,10 000 mg·kg-1和30 000 mg·kg-1污染水平中C16烷烃的体质量抑制率分别为27.15%和26.75%;处理14 d时,10 000 mg·kg-1和30 000 mg·kg-1污染水平的体质量抑制率分别为45.93%和44.41%。
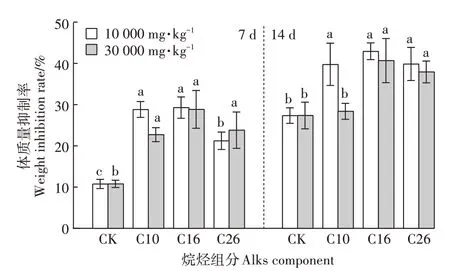
图5 10 000 mg·kg-1和30 000 mg·kg-1 TPHs中等当量烷烃组分模式化合物对蚯蚓的毒性Figure 5 Ecotoxicity of the equivalent alkane model compounds n-Decane,n-Hexadecane,and n-Hexacosane to earthworm
C10与CK组对比无显著相关性。比较C10、C16、C26烷烃对蚯蚓的毒性可知,当量浓度的高碳数烷烃对蚯蚓的毒性并非最大,说明石油污染土壤中不同烃类化合物对物种的毒性作用是复杂的,存在化学指标的特异性。
2.3.2多环芳烃组分对蚯蚓的毒性作用
根据2.1中多环芳烃组分测定结果,计算得到10 000 mg·kg-1TPHs中An、Phe、Pyr浓度分别为0.15、0.07、0.03 mg·kg-1;相应地,30 000 mg·kg-1TPHs中An、Phe、Pyr浓度分别为0.46、0.22、0.08 mg·kg-1。实验设计同烷烃组分。
利用10 000 mg·kg-1TPHs中的等当量多环芳烃污染土壤,蚯蚓7 d的体质量抑制率与CK组相比表现出较明显的抑制作用。三种多环芳烃中,当量An对蚯蚓的体质量抑制率最大,Phe和Pyr对蚯蚓的体质量抑制情况接近。在30 000 mg·kg-1TPHs等当量多环芳烃污染土壤中,An对蚯蚓的体质量抑制率达到最大值,其次为Pyr,Phe对蚯蚓的体质量抑制率最小。
由图6可见,在组分烃模式化合物污染条件下,蚯蚓的体质量抑制率与暴露时间和组分烃剂量有关,且低浓度时Phe的毒性低于Pyr,而高浓度时Phe的毒性高于Pyr。这与吴尔苗[29]的研究相似,即Phe和Pyr对蚯蚓的毒性差异与各自的溶解度有关,Phe在水中的溶解度较高,为1.3 mg·L-1,而Pyr在水中的溶解度为0.012 mg·L-1,Pyr的毒性受其低水溶性的影响。当Phe浓度较高时,由于其高水溶性,其融入土壤孔隙水的量增加,从而被蚯蚓接触吸收的Phe也较多,土壤毒性较高,相比于Pyr则较低。因此,评价石油烃组分在土壤中的毒性风险时,不仅要考虑组分的结构和物理化学特性,还与其在总石油烃中的当量浓度、暴露时间有密切的关系。对比图5与图6得到,在相同时间当量浓度下,各烷烃组分烃的蚯蚓体质量抑制率均为最大,且烷烃在石油烃组分中占比高,为77.75%,故烷烃模式化合物毒性要高于多环芳烃。

图6 10 000 mg·kg-1和30 000 mg·kg-1 TPHs中等当量多环芳烃组分模式化合物对蚯蚓的毒性Figure 6 Ecotoxicity of the equivalent PAHs model compounds to earthworm
在实际中,污染物对蚯蚓接触产生的毒性不仅取决于污染物本身,还与其在土壤中和蚯蚓体内的行为变化密切相关[29]。因此,急性毒性试验对潜在的毒性评价不够准确,而慢性试验对评价污染物的毒性效应更为准确。梁继东等[30]的研究表明,体质量变化率比死亡率(LD50)更能准确地反映污染物的生态毒性效应。在污染物剂量较低,暴露时间较短不足以引起蚯蚓死亡时,蚯蚓体质量的变化成为可靠的评价因素。
3 结论
(1)土壤中总石油烃含量为13 000 mg·kg-1时,可引起蚯蚓的体态变化和强烈回避行为、抗氧化系统过度应激以及14 d内半数致死等毒性效应。蚯蚓致死率和体质量抑制率均能较好表征蚯蚓在石油污染土壤中所受的毒害,但致死率测定便捷快速,而体质量抑制率的测定较为费时费力。
(2)石油污染土壤中的烷烃和多环芳烃组分占比分别为77.75%和6.99%。通过分别比较烷烃和多环芳烃在土壤中的当量浓度毒性可知,烷烃模式化合物正十六烷、正二十六烷对蚯蚓的急性毒性高于多环芳烃模式化合物蒽、菲、芘的急性毒性。因此,在土壤污染初期应充分重视烷烃的急性毒性,尤其是正十六烷化合物的毒性。
