蚯蚓体腔液胞溶素蛋白研究进展
2022-11-03顾浩天王冬生张天澍滕海媛袁永达
顾浩天,王冬生,张天澍,滕海媛,袁永达
(上海市农业科学院生态环境保护研究所,上海 201403)
蚯蚓体壁和肠道空间的体腔液中包含多种抗菌和凝血作用的生物活性分子[1]。胞溶素(Lysenin,LYS)最初从蚯蚓体腔液体中被提取克隆,是具有生物活性的穿孔毒素蛋白[2],可诱导小鼠血管平滑肌收缩。胞溶素及其相关蛋白(LYS-related proteins)目前仅在爱胜蚓属(Eisenia andrei、Eisenia fetida)及两者杂交体中被发现,而在其他正蚓科如Dendrobaena veneta、Lumbricus terrestris、Lumbricus rubellus、Aporrectodea caliginosa等中未被发现[3]。胞溶素蛋白分子量约为33 Ku,含有297个氨基酸,由1 600个碱基编码[4]。目前在爱胜蚓属中已分离出三种胞溶素相关蛋白,它们高度同源且与LYS共同组成LYS多蛋白家族[5]。Ohta等[6]证明LYS基因(mRNA)主要在盲道(Typhlosole)的黄色细胞中(Chloragocyctes)表达,而其蛋白只在体腔液中悬浮油细胞中表达[7]。
动物细胞膜磷脂(Sphingomyelin,SM)是胞溶素的膜靶标[8]。胞溶素以SM依赖性的方式结合到细胞膜表面形成寡聚物,造成寄主细胞膜表面穿孔,从而引发溶血反应、抗菌活性、平滑肌收缩活性及细胞毒性[3,7,9-10]。蚯蚓体内没有SM且具有成孔毒素的抑制机制[11],因此胞溶素对蚯蚓无自毒活性,相反在其免疫防御中起作用[5]。例如,在Eudrilus eugeniae中胞溶素蛋白具有抗菌、溶血、蛋白质水解等活性[1]。本文从胞溶素的理化分子结构出发,总结探讨其生物学功能、作用机制及应用价值,并对其发展前景进行展望,以期为下一步胞溶素蛋白研究提供参考和依据。
1 胞溶素的理化分子结构
研究表明,胞溶素多蛋白家族包含四个亚型,即Lysenin(NCBI登录号,BAA21518)、Lysenin-related protein 1(O18424)、Lysenin-related protein 2∕fetidin(O18425)、Lysenin-related protein 3(Q3LX99),几种蛋白氨基酸序列相似度高达76%—89%[5,12]。在E.fetida中其亚型主要为Lysenin、LRP-1、LRP-2(Fetidin);在E.andrei中其亚型则主要为Lysenin、LRP-3、LRP-2(Fetidin)[3]。其中LRP-2与Fetidin的氨基酸序列相似度为100%,核苷酸序列相似度为99%,暗示两者为同一蛋白[9]。
LYS的结构特点影响其生物学功能。Lysenin序列C端(161—297 aa)是与SM结合的活性部位,而N端(1—160 aa)参 与 细胞膜孔道的 形 成[13]。Lassèues等[14]在Fetidin中发现保守模体序列(ETKTLTASHSI)与其过氧化物酶活性相关,在抗菌功能中有重要作用[15]。在Lysenin及LRP-1中也发现该保守模体,但两者是否有过氧化物酶活性不清楚[9]。序列分析表明,在LYS蛋白家族中保守的210位苯丙氨酸及色氨酸残基(W20、W187、W245、W291)与SM结合相关,且色氨酸残基还参与SM识别、寡聚物形成及溶血反应[10]。Lysenin和LRP-2蛋白序列中210位为苯丙氨酸,因此可以特异地与SM结合发生溶血反应;LRP-1蛋白序列中210位为异亮氨酸,与SM结合能力及溶血活性大幅减弱[9]。而LRP-3目前功能未知。X射线晶体学显示,Lysenin属于气溶素(Aerolysin)毒素家族,每个Lysenin单体含有受体结合域及孔道形成模块(图1)[16]。

图1 LYS结构的X射线图[16]Fig.1 Lysenin water-soluble monomeric X-ray structure[16]
2 胞溶素的生物学功能
2.1 结合鞘磷脂
SM主要存在于大多数脊椎动物细胞膜外叶,且和胆固醇共同组成细胞膜脂质筏[9,17]。研究表明,LYS与SM具有较高亲和性(Kd=5.3×10-9M)[18],在细胞膜表面仅与SM特异性结合,且一个LYS分子与五个SM分子结合[19]。SM中的鞘氨醇、磷酰胆碱、脂肪酸基团及SM分子的亲水头部和疏水尾部共同促进了SM与LYS的互作结合[8,18]。此外,SM浓度、密度、分布也影响其与LYS的结合[20-21]。
2.2 诱导细胞溶血
LYS诱导细胞发生溶血反应的过程主要分为三阶段[9]:(1)与靶细胞膜表面的SM结合;(2)LYS-SM复合物形成寡聚物,增加细胞膜通透性;(3)寡聚物插入形成孔道,发生溶血反应(图2)。细胞膜表面胆固醇促进LYS寡聚物的形成,而较高SM∕LYS比值减少了寡聚化[22],SM中的脂肪酸组成也会影响LYS的寡聚化[21]。
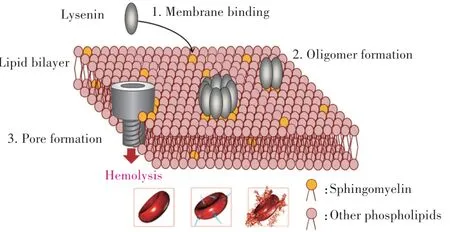
图2 细胞膜溶血反应图示[12]Fig.2 The schematic sketch of membrane hemolysis[12]
LYS-SM结合及寡聚化过程在4℃环境中也能发生,不依赖环境温度[8]。而孔道形成只能在37℃发生[12]。LYS形成的孔道直径约3 nm且呈蜂窝状正六边形结构(图3)[8,23]。去除N端的LYS(Non-toxic-Lysenin,NT-Lys,161—297)可抑制寡聚化过程,因此无细胞毒性[24]。

图3 LYS插入形成蜂窝状正六边形孔道[8]Fig.3 TEM image of LYS channels inserted in a lipid membrane[8]
LYS可诱导脊椎动物细胞发生溶血反应,且该反应发生依赖于温度和剂量[8,18]。仅5 ng∕mL LYS即可诱导绵羊体内50%红细胞发生溶血反应[18,21]。静脉注射60 mg∕kg LYS后,小鼠红细胞凝集、血小板被破坏,形成血栓而导致其呼吸困难甚至死亡[9]。此外,LYS还诱导大多数脊椎动物的精细胞死亡、两栖动物表皮剥落,而只对极少数无脊椎动物细胞产生溶血反应[9,25]。这可能由于无脊椎动物细胞膜含有较高浓度SM,易与LYS结合发生功能反应,而大量无脊椎动物体内无SM;也可能是无脊椎动物细胞膜表面SM被糖脂、糖蛋白等物质包被,而无法被LYS识别结合[9,26]。
2.3 形成离子通道
离子通道对生命系统维持基础的生理及生物学过程至关重要。研究表明,成孔毒素蛋白通过结合寄主细胞膜SM,组装成较长的β折叠(9—11 nm)及较宽的孔洞(2.5 nm),呈现离子选择性。LYS因其高运输速率、由配体及电压调节而具有离子通道特点,从而可调节细胞的跨膜电压,且对阳离子有更高的选择性[27-28]。
在负电压下LYS通道处于开放状态,当电解质浓度及pH变化较大时,仍保持稳定[27]。由于LYS通道可允许大分子穿梭转移,而被用于鉴定和表征单肽分子的纳米传感器。LYS形成的离子通道被广泛应用于开发新药、治疗策略、合成生物学等领域[29-30]。
2.4 参与免疫防御
蚯蚓进化形成了应对细菌及病毒侵染的独特机制,将细菌Pseudomonas aeruginosa、Bacillus subtilis注射蚯蚓体腔后,LYS大量分泌[1],推测LYS是蚯蚓体液免疫的重要成分[31]。蚯蚓体腔细胞暴露于革兰氏阳性金黄色葡萄球菌(Staphylococcus aureus)中,诱导了LYS的分泌和表达增加[7]。大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)均刺激LYS家族的基因和蛋白表达[32-33]。基于iTRAQ的蛋白组分析表明,E.fetida受大肠杆菌(E.coliO157:H7)胁迫7 d后,LYS蛋白表达显著上调[34]。这些研究均表明LYS蛋白家族对多种真菌、细菌、小型无脊椎寄生虫等有抗菌活性[35]。鉴于LYS要与SM结合后发挥功能,而这些生物体的膜表面无SM,因此Bruhn等[5]推测LYS可能与这些生物体内的其他受体结合,通过不依赖于SM的作用方式产生抗菌活性,如调理素特性[36]、过氧化物酶活性等[15]。此外,Hirigoyenberry等[37]发现蚯蚓体内溶菌酶和LYS共同作用抵御外源病原菌感染,溶菌酶作为快速响应物质,LYS作为长效抗菌分子。
蚯蚓为避免被鸟类、鼠类等高营养级捕食,排出具有抗菌活性、细胞毒性、溶血活性的体腔液(图4),因此LYS参与组成蚯蚓防御捕食者的适应性策略[3]。LYS还能诱导体腔细胞的吞噬作用。如在体外试验中,LYS可以与银纳米材料结合,形成“protein corona”促进体腔细胞对其的吞噬活性[36,38]。LYS可能作为“find-me∕eat-me”信号介导蚯蚓体内巨噬细胞的胞吞作用[39]。

图4 蚯蚓排出体腔液抵御捕食者[40]Fig.4 The ejection of coelomic fluid from earthworms against predators[40]
综上,LYS通过依赖于SM及不依赖SM的两种互补作用方式,参与蚯蚓响应生物因子和非生物因子胁迫的免疫防御。因此LYS可作为动物免疫反应的潜在诱导剂,具有广阔应用前景。
2.5 激活细胞凋亡信号
SM与胆固醇共同组成的脂质筏上含有如G蛋白、GPI锚定蛋白、酰化蛋白等大量信号分子,在信号传导中有重要作用[41]。因此,SM不仅是细胞膜的结构成分,同时介导细胞信号通路,其多种代谢产物作为第二信使参与调节细胞生长、分化、凋亡[42-43]。LYS主要以两种形式调控细胞凋亡:(1)参与调控依赖半胱氨酸蛋白酶(Caspase)的细胞凋亡信号[33];(2)与SM结合在膜表面形成穿孔,使得SM在脂质筏的空间结构改变[44],增加细胞质的钙离子浓度同时降低钾离子浓度[45-46],进而诱导激活细胞凋亡信号。
3 胞溶素的潜在应用
3.1 生物膜脂质标记
添加荧光基团(Alexa Fluor)或结合荧光蛋白(mCherry)及其他分子标记(125I,麦芽糖结合蛋白等)的LYS可用于检测鞘磷脂SM[47]。NT-lysenin具有SM结合特异性而无细胞毒性[24]。利用改造的NTlysenin添加荧光标签[26,48]或LYS蛋白抗体[9],可实时检测、监测、定位SM在生物膜及细胞内的动态变化[23]。如Yoshida等[49]利用LYS抗体探针评估SM在小鼠表皮发育过程中的细胞动态分布。此外,Hanada等[50]利用LYS筛选中国仓鼠体内不能合成SM的突变卵巢细胞。综上,LYS可以作为标记SM或研究膜生理学的生物传感器[21]。
3.2 疾病诊断治疗
LYS对人类肺癌细胞、结肠癌细胞、乳腺癌细胞、表皮癌细胞及小鼠白血病细胞均有毒性作用[9,51]。因此,可利用LYS的细胞溶血毒性进行肿瘤等疾病治疗。Yamaji等[18]提出利用LYS与SM特异性结合的特点诊断神经磷脂贮积病,如尼曼匹克病类型A(NPA)等。此外,Hayashi等[36]发现LYS的抗菌调理素活性可促进蚯蚓切断组织再生修复,表明LYS在伤口愈合、抗菌消炎等方面具有有益作用[52]。最新研究发现,E.fetida可以有效免疫新型冠状病毒(COVID-19),当向人体细胞注射无毒NT-Lys后可消除新冠病毒感染。其具体机制可能为:胞溶素蛋白与新冠病毒包膜上的鞘磷脂结合,形成穿孔并破坏其结构,使病毒无法与宿主细胞膜结合,从而阻断其感染过程。因此具有抗病毒活性的胞溶素蛋白家族可用于治疗新冠病毒及其他病毒疾病[53]。
3.3 响应胁迫的生物标记
胞溶素相关蛋白2(LRP-2)可以清除线粒体内具有潜在毒性的超氧自由基[54]。E.fetida暴露于多种重金属污染的土壤中,LYS表达显著上调[55];重金属镉(Cd)和温度双重胁迫诱导下,E.andrei中LYS表达显著下调[56];E.andrei、E.fetida及两者的杂交体受Cd胁迫后,体内LYS均显著下调[57];Wu等[58]研究表明,蚯蚓受菲污染胁迫后,LYS家族蛋白表达均显著下调。综上,LYS对不同污染物有不同的响应,可作为蚯蚓响应环境胁迫的生物标记。
3.4 生物源农药
尽管无脊椎动物细胞膜表面SM含量极低,或不含SM[59],LYS仍可对少数昆虫的精细胞及血淋巴细胞产生毒性[9,25]。最近研究表明,在无脊椎动物中SM的类似物为神经酰胺磷酸乙醇胺(CPE)[60]。Panevska等[61]发现来源于Aegerolysins家族的成孔毒素与含MACPF(Membrane-attack-complex∕perforin)的伴侣蛋白形成复合物,可与玉米根叶甲及马铃薯甲虫的中肠细胞膜CPE结合,产生杀虫活性且不易形成突变抗性。来源于气溶素(Aerolysin)家族的LYS是否也能产生杀虫活性,能否作为生物源农药进行应用开发,需要进一步研究。
4 小结与展望
本文分析了胞溶素家族蛋白的分子理化结构,探讨了LYS的细胞溶血毒性、免疫防御、信号转导功能,同时指出其在分子生物学、医学、环境科学、农业等领域的应用价值。为更好开发利用LYS的特性及功能,建议未来研究重点关注以下几个方面:(1)探索LYS诱导细胞溶血毒性、参与细胞凋亡信号调控网络、产生抗菌活性的内在分子机理,为研发新型生物源农药、抗癌和抗菌类药物等奠定理论基础。(2)比较分析LYS蛋白家族不同亚型间的作用机制,研究LRP-3在蚯蚓体内、体外的功能活性。(3)利用基因工程技术重组改造LYS蛋白分子,挖掘其衍生物,解决其溶血毒性风险[12],以便开发脂质标记探针、生物传感器识别定位SM,研究膜成孔机理。(4)基于蚯蚓成孔毒素的抗病毒机制,研制无细胞毒性的胞溶素蛋白疫苗,用于治疗新冠病毒(COVID-19)以及其他病毒。
