小麦根际解磷细菌的筛选及其解磷能力鉴定
2022-11-03李亚菲李东方吴大付
李 航,李亚菲,张 影,李东方,吴大付,王 菲
(河南科技学院资源与环境学院,河南省生物药肥研发与协同应用工程研究中心,新乡 453003)
磷是农业生产中一个十分重要的元素,但由于其在土壤中易被固定,且移动性差,导致其利用率只有10%—20%[1],而大部分磷肥则作为无效态磷在土壤中积累,一方面消耗了磷矿资源,造成了磷肥的浪费,另一方面也对环境造成了一定的风险。因此,通过高效环保的生物过程,如挖掘土壤微生物的解磷潜力[2-3]以充分活化土壤中累积态磷,使其转化为能够被植物直接吸收和利用的有效磷,实现农业绿色发展。
土壤中的磷素循环以微生物活动为驱动力[2],与磷周转密切相关的一类微生物被称为解磷微生物,主要通过酸解作用、酶解作用以及直接氧化作用来活化或矿化难溶性无机磷和有机磷,将磷酸根释放出来供植物吸收利用[3-7]。这些解磷微生物包括细菌、真菌、放线菌等,其中细菌的解磷效果最佳[8]。目前报道的具有解磷作用的细菌多隶属于芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、欧文氏菌属(Erwinia)、沙雷氏菌属(Serratia)、不动杆菌属(Acinetobacter)、微球菌属(Micrococcus)、黄杆菌属(Flavobacterium)、固氮螺菌属(Azospirillum)、肠杆菌属(Enterobacter)、根瘤菌属(Rhizobium)、节细菌属(Arthrobacter)等[9-11],而且这些菌株在不同环境条件下均能表现出良好的解磷和促生效果,如刘希旻等[12]从盐碱地土壤中分离得到一株高效解磷菌Pseudomonas veronii,解无机磷量最高可达850.1 mg∕L,在盐碱地土壤生物修复方面具有较大的应用价值;庄馥璐等[13]从苹果根际土壤中筛选出具有矿化有机磷能力的细菌10株,其中菌株PsbM4(肠杆菌属)综合能力较强,且能够刺激拟南芥植株泌氢,更好地应对低磷胁迫。
针对当前集约化农业生产过程中存在的一系列问题,通过筛选高效解磷微生物并将其应用于菌肥的研发,从而替代农业生产中化学肥料的大量使用,对于早日实现农业绿色发展具有重大意义。因此,高效解磷细菌的筛选就成为了一项非常重要的基础性工作。本研究利用选择性培养基,从小麦根际土壤中分离筛选解磷细菌并分析其解磷能力,以期为后续研发微生物菌肥提供菌种资源,并为增强作物对磷的吸收以及减少作物对磷肥的依赖提供理论依据和技术支持。
1 材料与方法
1.1 根际土壤的采集
利用五点取样法在河南省新乡市红旗区洪门镇原堤村试验基地(113.56°E,35.15°N)采集分蘖期小麦根际土壤样品,并用抖根法收集,5个样点的根际土壤作为一个混合样品,过2 mm筛后,按照四分法收集根际土壤,并于4℃冰箱保存。
1.2 培养基的配制
无机磷固体培养基采用国际植物研究所磷酸盐生长培养基(National Botanical Research Institute’s Phosphate Growth Medium,NBRIP)[14],配方如下:葡萄糖(C6H12O6)10 g∕L,磷酸钙[Ca3(PO4)2]5 g∕L,氯化镁(MgCl2·6H2O)5 g∕L,硫酸镁(MgSO4·7H2O)0.25 g∕L,氯化钾(KCl)0.2 g∕L,硫酸铵[(NH4)2SO4]0.1 g∕L,琼脂粉15 g∕L。有机磷固体培养基以NBRIP为基础,用植酸钙(Phytin)来代替原配方中的磷酸钙,且用量减少为2 g∕L。相应的无机磷和有机磷液体培养基则不添加琼脂粉,pH调至7.0。所有培养基经灭菌(121℃,30 min)后使用。
1.3 解磷细菌的分离、纯化和分子鉴定
根据孙亚钦等[15]的方法,采用平板稀释法和划线法[16]对小麦根际土壤中的解磷细菌进行分离筛选和纯化,采用AxyPrep细菌基因组DNA小量制备试剂盒(Axygen,USA)提取细菌的基因组DNA,利用细菌通用引物27F和1492R进行PCR扩增[17],PCR产物用AxyPrep DNA凝胶回收试剂盒(Axygen,USA)回收后,利用全自动DNA测序仪ABI 3730XL(Applied Biosystems,USA)对其进行双向测序,并对所得序列进行拼接、比对和分析等。
1.4 菌株解磷能力的分析
根据纯菌株在无机磷和有机磷固体培养基上产生溶磷圈的情况,测量其溶磷圈直径(D)和菌落直径(d),并计算溶磷指数(P solubilization index,PSI=D∕d)和溶磷效率[P solubilization efficiency,PSE=(Dd)∕d×100%]以初步判断各菌株的解磷能力[18-19],详细的操作步骤参考孙亚钦等[15]的方法。
将纯菌株接种于LB液体培养基中,经振荡培养、调节菌液OD值、离心、清洗菌体、定容后,吸取菌液分别添加到无机磷和有机磷液体培养基中,再经振荡培养和离心后,吸取上清液测定培养液pH、速效磷含量[20]和磷酸酶活性[21],详细的操作步骤参考孙亚钦等[15]的方法。
1.5 数据统计
利用Microsoft Excel软件对数据进行初步整理,用SPSS 26.0统计软件进行单因素方差分析和Pearson相关性分析,处理间差异的显著性通过新复极差法(Duncan's)比较(P<0.05),利用Microsoft Excel软件绘图。
2 结果与分析
2.1 解磷菌株的分子鉴定
通过16S rRNA基因测序和序列同源比对,从小麦根际土壤共筛选得到10株不同的解磷菌株,其中溶解植酸钙和磷酸钙的菌株各有5株,分别将其编号为LP2、LP5、LP16、LP17、LP23及LE、LF、LH、LI、LM。将这些菌株的16S rRNA基因序列提交至GenBank中,获得对应的序列号,为MW085018—MW085027。由表1可知,具有溶解植酸钙能力的菌株LP16和LP17同属于芽孢杆菌属,LP2、LP5和LP23分别属于假单胞菌属、谷氨酸杆菌属和泛菌属;而具有溶解磷酸钙能力的菌株LF和LM同属于肠杆菌属,LE、LH和LI分别属于沙雷氏菌属、拉恩氏菌属和假单胞菌属。从不同磷源来看,溶解磷酸钙的菌株LI和溶解植酸钙的菌株LP2都属于假单胞菌属(表1)。

表1 不同菌株的鉴定结果Table 1 Identification results of different strains
由图1可知,这10株解磷菌株隶属于7个不同的菌属(Pseudomonas、Glutamicibacter、Bacillus、Pantoea、Serratia、Enterobacter、Rahnella)。其中菌株LF和LM、LP16和LP17、LI和LP2分别与Enterobacter、Bacillus、Pseudomonas聚为一支,表明它们分别与肠杆菌属、芽孢杆菌属和假单胞菌属的亲缘关系更近;菌株LP23、LE、LH、LP5分别与Pantoea agglomerans、Serratia quinivorans、Rahnella aquatilis、Glutamicibacter arilaitensis聚为一支,表明它们之间有较近的亲缘关系。
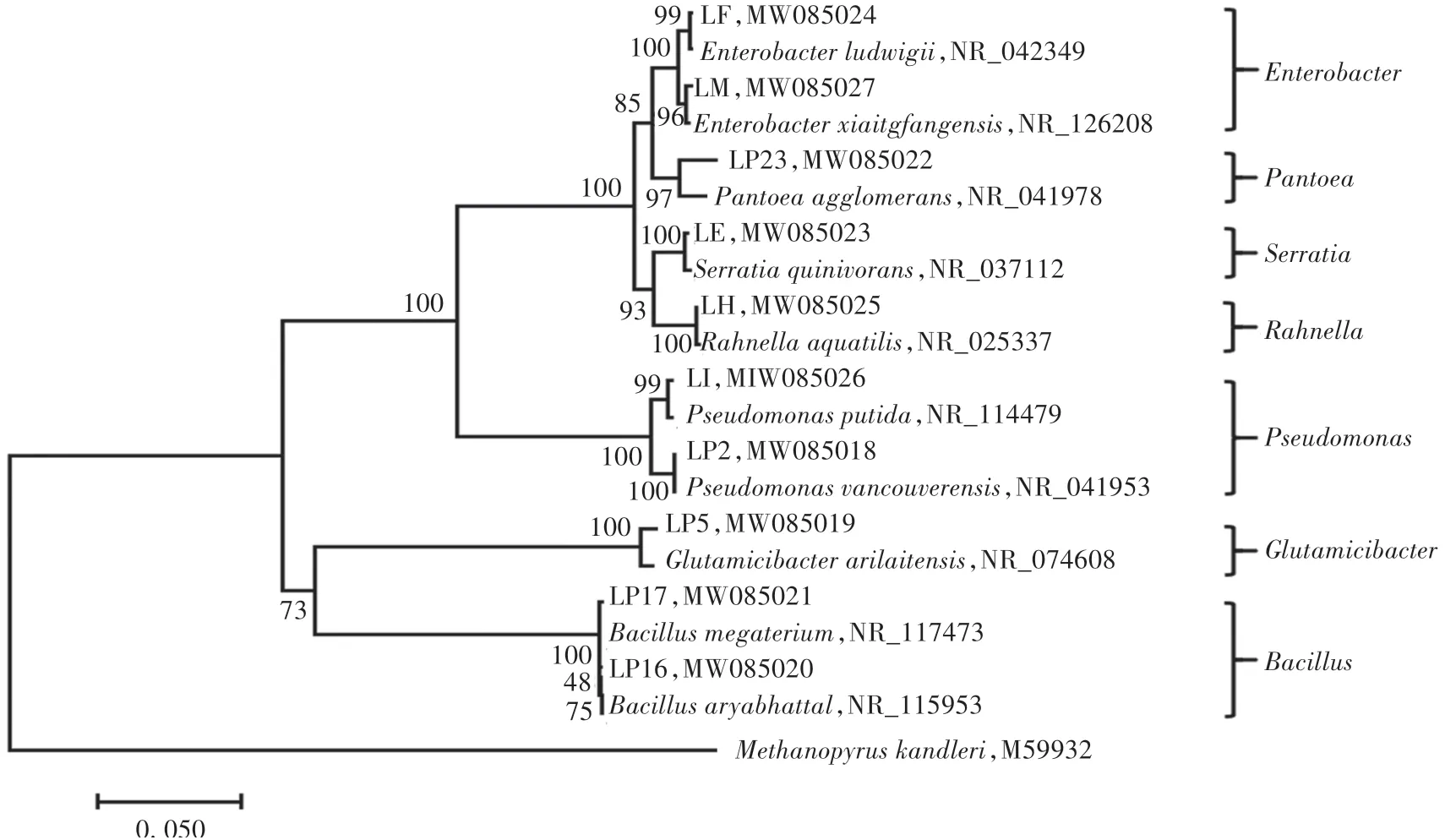
图1 基于16S rRNA基因序列构建的解磷菌株系统进化树Fig.1 Phylogenetic tree of phosphate-solubilizing strains based on 16S rRNA gene sequences
2.2 菌株解磷能力的定性分析
溶磷指数(PSI)和溶磷效率(PSE)可作为表征解磷细菌相对解磷能力的指标。通过计算发现,在以植酸钙为磷源的菌株中,菌株LP17的PSI和PSE最大,显著高于菌株LP5和LP23,但与其他菌株无显著差异;菌株LP5的PSI和PSE最小,显著低于菌株LP16和LP17,而与其他菌株无显著差异。
以磷酸钙为磷源的解磷菌株中LM的PSI和PSE最大,显著高于菌株LE、LH和LI,而与菌株LF无显著差异;菌株LE的PSI和PSE最小,显著低于菌株LF、LI和LM,但与菌株LH之间无显著性差异(表2)。各菌株的溶磷能力强弱与溶磷圈所示结果一致(图2)。

图2 不同解磷菌株产生的溶磷圈Fig.2 Phosphate-solubilization halo produced by different phosphate-solubilizing strains
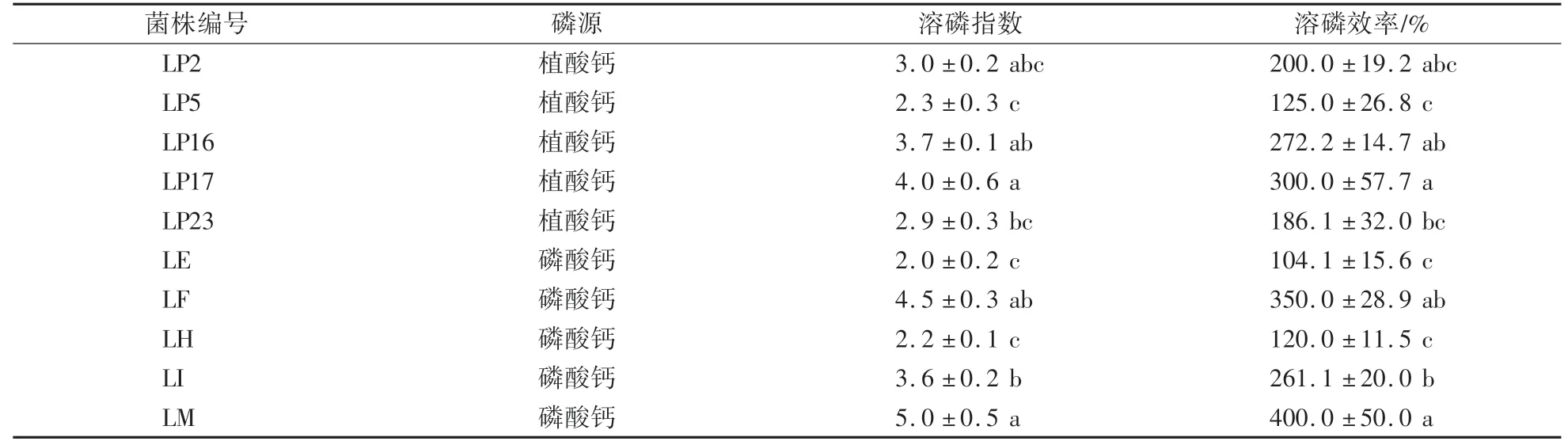
表2 解磷菌株的溶磷指数(PSI)和溶磷效率(PSE)Table 2 P solubilization index and P solubilization efficiency of different phosphate-solubilizing strains
2.3 菌株解磷能力的定量分析
5株解磷菌株从植酸钙中活化出来的速效磷浓度为3.5—5.3 mg∕L(图3A),其中菌株LP17对应的培养液中速效磷浓度最高,显著高于菌株LP2、LP5和LP23,分别高出24.53%、33.96%和22.64%,而与菌株LP16无显著性差异,同时菌株LP2、LP5和LP23对应培养液中速效磷浓度无显著差异(图3A)。菌株LP17对植酸钙的活化能力也最高,显著高于菌株LP2、LP5和LP23,但与LP16之间无显著差异;菌株LP5对植酸钙的活化率最小,显著低于其他菌株(图3C)。
对于活化磷酸钙的解磷菌株来说,其活化出的速效磷浓度范围是34.1—69.7 mg∕L,其中菌株LM对应的培养液中速效磷浓度最高,显著高于其他菌株;菌株LE对应的培养液中速效磷浓度最低,且与其他菌株间的差异均达到显著水平(图3B)。另外,菌株LM对磷酸钙的活化能力依然最高,显著高于菌株LE、LH和LI,而与菌株LF无显著差异;菌株LE的活化能力最低,与其他菌株均有显著性差异(图3D)。
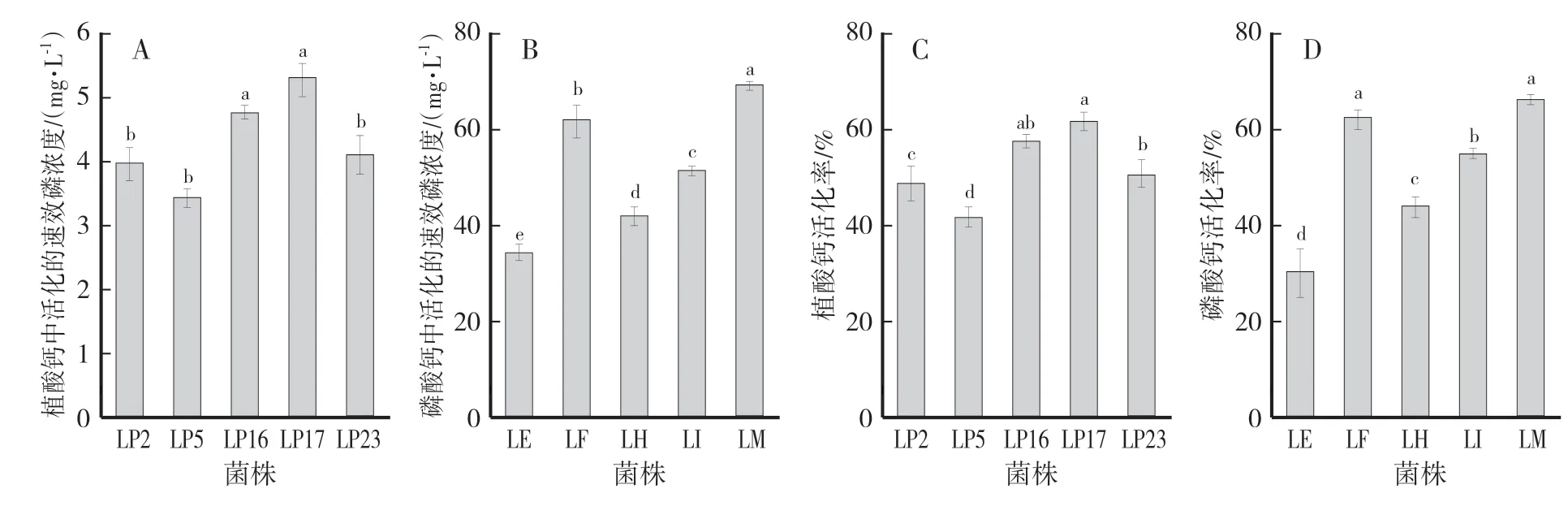
图3 解磷菌株活化植酸钙和磷酸钙的能力比较Fig.3 The capactity of phosphate-solubilizing strains to mobilize phytin(A,C)or tricalciurn phosphote(B,D)
2.4 解磷菌株培养液pH和磷酸酶活性
在以植酸钙或磷酸钙为磷源的液体培养基中接种解磷细菌并培养一段时间后,其培养液pH显著低于初始pH,其中含有植酸钙的培养液pH为5.05—6.09,菌株LP5对应培养液pH最高,与其他菌株存在显著差异。根据培养液的实际pH来测定其磷酸酶活性,更能真实地反映培养液的磷酸酶活性。培养液中磷酸酶活性为5.93—7.14 μg∕(mL·min),其中菌株LP17对应的培养液中磷酸酶活性最高,显著高于其他菌株(表3)。
以磷酸钙为磷源的液体培养基的pH在4.92—5.98,其中菌株LE对应培养液pH最高,显著高于菌株LF、LI和LM,而培养液pH最低的是菌株LM,与其他菌株差异显著。5株解磷菌株对应培养液中的磷酸酶活性为6.37—8.71 μg∕(mL·min),菌株LM对应的培养液中磷酸酶活性显著高于其他菌株,菌株LE对应的磷酸酶活性最小,显著低于其他菌株(表3)。
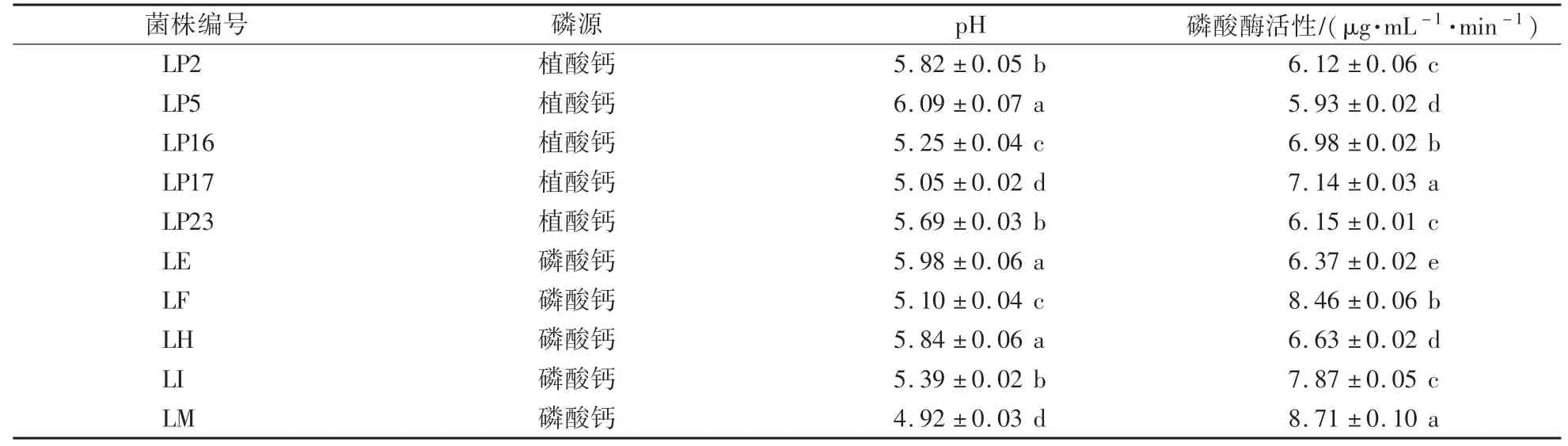
表3 解磷菌株对应培养液的pH和磷酸酶活性Table 3 pH and phosphatase activity in fluid medium corresponding to different phosphate-solubilizing strains
2.5 培养液中磷酸酶活性与pH以及速效磷浓度的关系
以植酸钙或磷酸钙为磷源的培养液中pH与磷酸酶活性之间均存在极显著的负相关关系,即培养液pH越高,其磷酸酶活性越低;且不同菌株的实际磷酸酶活性与速效磷浓度之间也存在极显著的正相关关系,即磷酸酶活性越高,从植酸钙或磷酸钙中活化出的速效磷浓度越大(图4)。
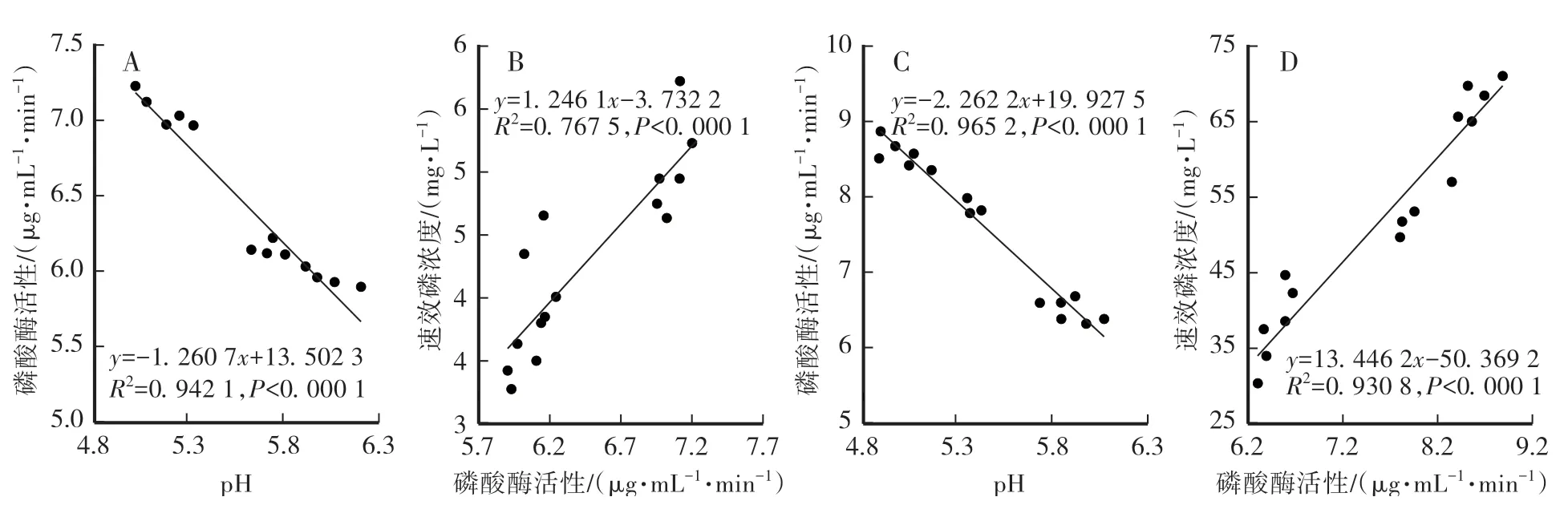
A、B以植酸钙为磷源;C、D以磷酸钙为磷源。
3 结论与讨论
利用解磷微生物来活化土壤难溶性磷是提高作物磷素利用效率的一种有效且环保的重要措施,也是关乎粮食安全、生态文明建设、农业绿色发展等战略的重大问题。目前,解磷微生物的分离筛选均是利用平板稀释法进行的,这是一种简单且有效的方法[16],如果将筛选获得的高效菌株研制成微生物菌肥并应用到农业生产中,不仅能够提高作物产量,也可以增加土壤肥力以及增强作物抗逆性[22-29]。
本研究通过平板培养法从小麦根际土壤中获得10株能够产生明显溶磷圈的菌株,其中,5株解磷菌株能够溶解磷酸钙,另外5株可以降解植酸钙,使其对应的培养基都产生了溶磷圈,通过对溶磷圈和菌落大小进行测量,并计算溶磷指数PSI与溶磷效率PSE,发现菌株LP17和LM的PSI与PSE均最高;同样,这两株解磷菌株从植酸钙和磷酸钙活化出的速效磷浓度也最大,这表明其具有较强的溶解植酸钙和磷酸钙的能力。分子鉴定表明,菌株LP17和LM分别隶属于肠杆菌属和芽孢杆菌属,这两个属的细菌已被许多研究证明具有较强的解磷能力[30-34]。
酸解作用和酶解作用通常被认为是解磷细菌溶解无机磷和有机磷的机制[3-7]。在本研究中,与培养液的初始pH相比,培养过程中培养液的pH大幅下降,可能是解磷菌株分泌有机酸所致,而且培养液pH与磷酸酶活性之间存在极显著的负相关关系。磷酸酶活性除了与介质pH密切相关外,还与其自身活性和底物有效性有关[35-36]。本研究发现以两种不同磷源为底物的解磷细菌培养液中磷酸酶活性与可溶性磷含量之间存在极显著的正相关关系,表明较低的培养液pH有利于磷酸酶活性和底物有效性的增加,进而增强了难溶性磷的活化,提高了可溶性磷含量。
近年来,随着集约化农业发展的加快,大量化肥和农药的投入对有益微生物的繁殖产生了负面影响[37],也使粮食生产面临着严重的威胁。作为环保型修复剂的微生物菌肥,在替代化学肥料和农药中起着重要作用[38-41],而且在实际生产中的效果也比较显著[42-44],在绿色农业的背景下,拥有广阔的应用前景。而微生物菌肥的有效成分是微生物,因此,通过筛选高效解磷微生物并对其进行驯化,使其能够在不同环境和土壤条件下维持稳定的活性,这将为微生物肥料的研发提供高效的菌株资源,提高磷素在农业生产中的利用率,进而减少化学肥料的施用。本研究从小麦根际土壤中筛选出的菌株LP17和LM具有较强的溶解植酸钙和磷酸钙的能力,且分别隶属于肠杆菌属和芽孢杆菌属,这只是分离具有解磷能力的细菌的第一步,后续还有大量的相关工作需要进行,如生理生化特征的分析、培养条件的优化、促生效果的验证等[45-47]。
