miR-21介导Wnt信号通路诱导胰腺癌细胞凋亡的机制研究
2022-11-03陈兰茜张宏达朱硕儒
陈兰茜 张宏达 朱硕儒
胰腺癌是一种死亡率较高、患癌初期特征不明显、预后较差的恶性肿瘤。据2018 年全球癌症统计报告显示,胰腺癌的发病率和死亡率分别位居全球常见癌症发病率和死亡率的第11 位和第7 位。患者的5 年生存率在所有癌症中最低,仅为9%,1 年生存率仅为24%,且胰腺癌患病率呈增长状态,患病年龄呈年轻化趋势[1]。近年来,研究证实胰腺癌进展过程中多个信号通路均有参与,而Wnt 信号通路在胰腺癌细胞增殖、分化、凋亡、免疫等过程中扮演重要角色[2]。β-catenin 广泛存在于机体细胞中,作为Wnt 通路较为重要的转导因子被发现,属于多功能胞质蛋白的一种。Wnt/Wnt1、βcatenin 蛋白可影响组织细胞功能,在癌细胞增殖、转移过程中扮演重要角色[3]。microRNA 的生物学特性极为广泛,还有一定的内因性调节功能,对人体一半的蛋白基因都有调节作用,对mRNA 的分解有一定的促进作用,同时还能对目标基因的mRNA 转录进行阻碍。miR-21 是目前临床上研究的致癌基因之一[4]。众多癌细胞中都存在miR-21的异常表达,如:肝癌、结直肠癌、胃癌、乳腺癌等,miR-21 表达增加促进了肿瘤的增生、浸润、转移[5]。根据病因和目标疗法的研究基础,miR-21 和Wnt 信号已被纳入胰腺癌的治疗中,但其作用机制尚不明确[6]。因此,本次研究通过对miR-21 介导Wnt 信道通路的机制进行研究,分析其对胰腺癌细胞凋亡的影响。
1 材料与方法
1.1 实验材料 本次研究于2021 年3 月进行。人胰腺腺癌细胞株ASPC-1(由上海肃攀公司生产)来源于人胰腺癌患者腹水中的细胞,在M-NSG小鼠皮下接种后,能正常成瘤。
1.2 方法
1.2.1 细胞培养 取出ASPC-1 细胞,接种细胞为圆形,悬浮1 d 后逐渐贴壁,2 d 时细胞完全贴壁,贴壁细胞呈梭形或多边形,等到细胞生长至80%~90%时对细胞进行传代培养。用0.25%的胰酶对细胞进行消化传代,用吸管轻轻吹打,把细胞制成悬液后移到培养瓶中,对细胞继续进行培养,收集第5代细胞进行试验。将收集的细胞制成1×105/ml 的液体,将细胞悬液放置16 孔板中,当细胞生长至60%~80%时取出细胞进行后续实验。
1.2.2 细胞转染和分组 收集生长至60%~80%的ASPC-1 细胞,将细胞放置培养皿中进行转染,转染过程均按照Lipofectamine 2 000 说明书操作进行,将细胞分为三组:As 组、Ay 组和Nc 组。As 组为正常ASPC-1 细胞,Ay 组为ASPC-1 细胞转染+miR-21-inhibitions 细胞,Nc 组为ASPC-1细胞转染+miR-21-阴性对照细胞,转染细胞4 h 后,将细胞上清液去除,更换培养基后对细胞继续培养48 h。其中miR-21-inhibitions 细胞、miR-21-阴性对照细胞由上海吉玛公司生产。
1.2.3 RT-PCR检测Wnt1、β-catenin 水平变化ASPC-1细胞总RNA 采用Trizol 法来提取,根据逆转试剂盒(由武汉塞维尔公司生产)将总RNA 提取反转录成cDNA,按说明书进行实验,用DNA 荧光染料SYBR GreenⅠ对miR-21、Wnt1、β-catenin 表达水平进行检测,内参采用U6,60°C 10 min,95 ℃、72°C 各30 s,95 ℃5 min,循环次数以40次为准,实验次数至少3 次,用相对定量2-ΔΔCT计算miR-21、Wnt1、β-catenin水平。引物序列见表1。

表1 引物序列
1.2.4 Westernblot 法检测Wnt1、β-catenin 蛋白表达 取出100 μg 的胰蛋白酶提取液,将其加入到6 孔板中,将2 ml 的培养基再次注入培养板中,把转染后的细胞移到EP管中后和胰蛋白酶提取液混合,放入冰箱中冷冻,10 min后细胞裂变成为E溶液;在EP管中再次加入2 ml的胰蛋白酶提取液,让细胞裂变为F 溶液,将E 溶液和F 溶液充分混匀后制成工作液,放置37 ℃的环境中静止20 min,待细胞冷却后计算Wnt1、β-catenin蛋白浓度。
1.2.5 流式细胞仪检测ASPC-1 细胞凋亡程度 将ASPC-1 细胞注入6 孔培养板中,1 d 后将少量的胰蛋白酶加入到培养板进行消化,4 h 后将细胞置于-20 ℃甲醛溶液中冷藏,1 d 后将细胞离心去除上清液,用磷酸盐缓冲液对细胞进行多次冲洗,用5 μl 标记lFITC 的AnnexinⅤ与5 μl PI 染色混匀,采用流式细胞仪分析ASPC-1 细胞凋亡程度。
1.2.6 Transwell 检测ASPC-1 细胞迁移能力 饥饿处理三组细胞12 h 后,将DMSO 溶液加入细胞中,24 h 后离心,重悬细胞成为5×105/ml 的细胞悬液,在细胞悬液中注入Transwell 小室后在培养基中继续培养12 h,培养结束后可上室,拭去未迁移细胞,用甲醛固定细胞8 min,用结晶紫对细胞进行染色,用显微镜对细胞进行观察。
1.2.7 MTT 检测ASPC-1 细胞活力 ASPC-1 细胞离心,5 min 后将细胞接种于96 孔板中培养,每孔注入细胞溶液200 μl,保持环境为37°C,CO2浓度为5%,培养24 h 后将MTT 溶液加入细胞中,3 h 后和DMSO溶液混匀,酶标仪测定光密度。
1.3 统计学方法 用SPSS 19.0 软件进行数据处理。计量资料结果用均值±标准差()表示,多组比较采用单因素方差分析,组间两两比较采用Bonferroni 校正法。设P<0.05 差异有统计学意义。
2 结果
2.1 RT-PCR 检测三组细胞miR-21、Wnt1、βcatenin水平变化见表2
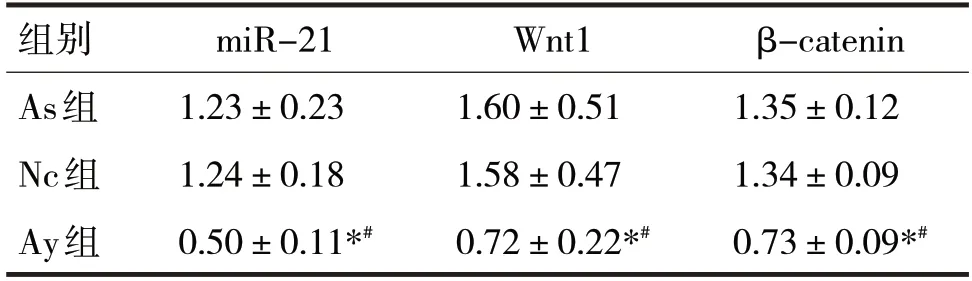
表2 三组细胞miR-21、Wnt1、β-catenin水平变化
由表2 可见,三组miR-21、Wnt1、β-catenin 水平比较,差异均有统计学意义(F分别=55.47、14.30、123.60,P均<0.05)。进一步两两比较,As 组、Nc 组miR-21、Wnt1、β-catenin 水平比较,差异无统计学意义(P均>0.05),与As 组、Nc 组比较,Ay 组miR-21、Wnt1、β-catenin 水平有明显下降(P均<0.05)。
2.2 Westernblot 法检测Wnt1、β-catenin 蛋白表达见表3
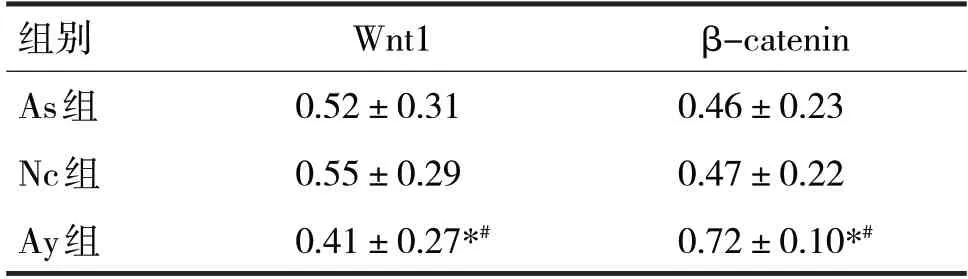
表3 三组Wnt1、β-catenin蛋白表达情况
由表3 可见,三组Wnt1、β-catenin 蛋白表达比较,差异均有统计学意义(F分别=3.54、5.85,P均<0.05)。两两比较,As 组、Nc 组Wnt1、β-catenin 蛋白表达比较,差异无统计学意义(P均>0.05),与As组、Nc 组比较,Ay 组Wnt1 蛋白表达有明显下降,βcatenin蛋白表达明显上升(P均<0.05)。
2.3 流式细胞仪检测ASPC-1 细胞凋亡程度 As 组细胞凋亡率为(13.51±2.31)%,Nc 组细胞凋亡率为(13.53±2.22)%,Ay 组细胞凋亡率为(7.32±1.56)%,三组间细胞凋亡率比较,差异有统计学意义(F=30.27,P<0.05)。两两比较,As 组、Nc 组ASPC-1 细胞凋亡率没有明显差异(P>0.05),Ay 组ASPC-1 细胞凋亡率较As组、Nc组明显下降(P均<0.05)。
2.4 Transwell 检测ASPC-1 细胞迁移能力见封二图1
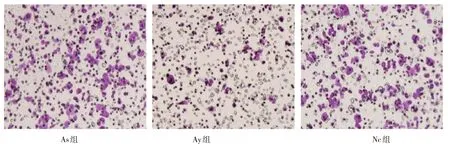
图1 ASPC-1细胞迁移能力
由封二图1可见,As组、Nc组ASPC-1细胞迁移能力比较,差异不明显,与As 组、Nc 组迁移能力比较,Ay组ASPC-1细胞迁移能力明显下降。
2.5 MTT检测ASPC-1细胞活力见表4
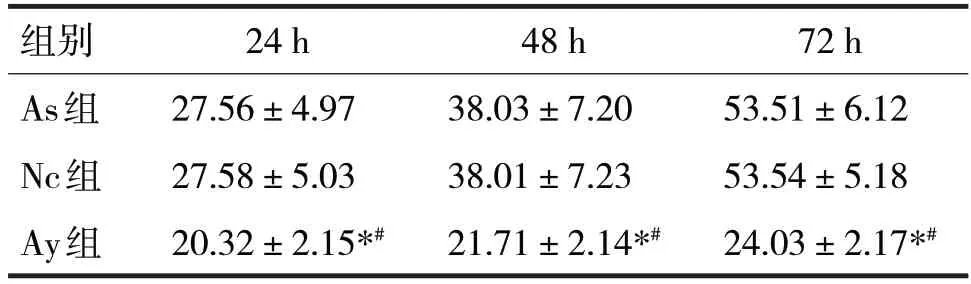
表4 三组ASPC-1细胞活力比较
由表4 可见,培养24 h、48 h、72 h 时,三组间ASPC-1 细胞活力比较,差异均有统计学意义(F分别=9.62、24.47、126.10,P均<0.05)。两两比较,培养24 h、48 h、72 h 时,AS 组与Nc 组细胞活力无明显差异(P>0.05),Ay 组细胞活力均低于As 组、Nc组(P均<0.05)。
3 讨论
胰腺癌属于消化道常见的一种恶性肿瘤,全球胰腺癌的发病率有小幅度上升,国外胰腺癌病死率已居第四位,在我国也有较高的死亡率,胰腺癌首发症状以上腹部异常疼痛或不适最为常见,属于预后最差的恶性肿瘤之一[7,8]。癌症侵袭和细胞因子、信号转导通路等有密切的联系[9]。近年来研究证实,miRNA 介导肿瘤细胞的侵袭和转移,同时有研究表明在胰腺癌细胞的发生发展中miR-21 发挥重要作用,并且其在肿瘤的生物学活性中取得很大的研究进展[10]。miR-21 主要位于跨膜蛋白基因编码区域,转录后对相关基因有负调控的作用[11]。大数据证实显示胰腺癌细胞促进肿瘤相关纤维细胞miR-21 表达,miR-21 的过表达会加速癌细胞的侵袭,而沉默miR-21 表达可抑制细胞的侵袭[12]。Liu等[13]指出,将抗miR-21 的慢性毒质粒注入胰腺癌细胞株中,能抑制胰腺癌细胞的增殖能力,且呈时间依赖性,其中下调miR-21 能有效地抑制胰腺癌的细胞增殖。
本次研究结果发现,与As 组、Nc 组比较,Ay 组Wnt1、β-catenin 水平有明显下降,且Wnt1 结果蛋白表达及ASPC-1 细胞凋亡率亦明显下降,而βcatenin 蛋白表达明显上升(P均<0.05)。有研究证实,有效地调控Wnt 通路能有效抑制胰腺癌细胞中相关蛋白的活性,同时也会一定程度地增加化疗药物的敏感性[14,15]。在胃癌、子宫内膜癌等多种肿瘤中均发现了Wnt通路的存在,当激活Wnt通路时,限制了其靶器官的分化,保留了干细胞的特异性的同时也加快了癌细胞的分化,最终导致肿瘤的形成[16]。多数癌症患者机体中Wnt1、β-catenin 的表达都有明显升高,异常表达的Wnt/Wnt1、β-catenin 可加剧机体免疫细胞的损伤,例如,抑制肿瘤中的Wnt信号表达,降低癌细胞的放射敏感性,进而让放疗和化疗的效果得到一定程度的提高[17]。miRNA的异常表达与肿瘤发生、发展和侵袭转移密切相关,成为近几年的研究热点。最近研究表明miR-21 在肝癌、胰腺癌等多种人类肿瘤表达下调,miR-21表达下调后,对靶基因PTEN 降解减少,PTEN 蛋白表达增强,进而负向调节AKT 通路使其丧失活性。AKT 通路的失活触发下游一系列生物学行为改变,包括抑制细胞迁移和增殖能力。
本次研究结果发现,与As 组、Nc 组比较,Ay 组ASPC-1 细胞迁移能力和细胞活力明显下降(P均<0.05),提示miR-21 能影响细胞增殖、凋亡和调控以及肝纤维化过程。近些年来,与胰腺癌相关的miRNA 不断被发现,miR-21 在胰腺癌下拨凋亡过程中的调控机制也逐渐被证实[18]。促进胰腺癌细胞凋亡可通过抑制miR-21 的表达来实现,使胰腺癌细胞恢复功能活性[19]。通过对肺癌中转基因小鼠和Wnt 信号通路的研究发现,活化Wnt 信号会让其在肺泡上皮细胞中过表达[20],因此,Wnt 信号可调控Wnt1、β-catenin 促进癌症的进展。在胰腺癌组织及胰腺癌细胞中发现miR-21 水平高于正常组织,因此,调控miR-21 可影响细胞增殖与凋亡。
综上所述,miR-21 低表达能明显抑制胰腺癌细胞增殖,其作用机制可能通过抑制Wnt/β-catenin 信号通路活性来实现。
