多黏菌素B干预颅脑创伤后大鼠外周血LPS表达的变化
2022-11-03周小嫔王衍廷
周小嫔,王衍廷,刘 斌
目前,颅脑创伤(traumatic brain injury,TBI)在全身创伤发病率中排第二位,是导致伤残及死亡的主要原因,严重影响患者生活质量及生存率[1],因此,探寻TBI 后脑保护的治疗方法,是提高TBI患者生存率及生存质量的重要途径[2,3]。近年来,肠道与心脑等重要脏器关系的相关研究越来越被人们所关注[4]。在严重创伤、感染等机体应激状态下,肠黏膜缺血、坏死,肠道屏障功能破坏,通透性增加,出现肠道菌群移位,肠道细菌崩解产物脂多糖(lipopolyssacharide, LPS)内毒素的主要成分进入人体血液循环,与单核-巨噬细胞及中性粒细胞通过受体相互识别,导致细胞活化,引起致炎细胞因子(TNF、IL-1、IL-6、IL-8、IL-12)释放,同时诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)合成大量的一氧化氮,随之引起多肽类物质-肾上腺髓质素(adrenomdullin, AM)表达增加,诱发严重的循环衰竭和组织损伤,最终导致感染性休克、多器官功能障碍综合征等,病死率极高[5]。正常机体具有一定清除LPS的能力,但是LPS过多则无法全部清除。临床研究发现,LPS清除剂多黏菌素B(polymycin B, PMB)对多种炎症有抗菌作用,在临床上应用广泛[5]。本研究主要探讨PMB干预颅脑创伤后大鼠外周血肠道LPS表达变化规律,旨在对TBI后的脑保护作用及相关药物治疗提供依据。
1 材料与方法
1.1 实验动物及分组 选取 SPF级雄性7周龄SD大鼠50只(由解放军军事医学科学院动物实验中心提供),体重(310±15)g,进行编号和称重,随机分为5组,即正常组(Normal)、假手术组(Sham)、创伤性脑损伤组(TBI)、创伤性脑损+生理盐水组(TBI+NS组)及创伤性脑损+多黏菌素组(TBI+PMB组),每组10只。
1.2 材料与试剂 选取FITC-Dextran(美国,Sigma);PMB(美国,Sigma)。电子皮质损伤撞击仪(electric cortical contusion impactor,eCCI),试剂(厦门市试剂有限公司),LS55全波长分光光度计(美国,Bio-Rad)。
1.3 模型复制 Normal组同环境下正常饲养。Sham组用5%水合氯醛(0.6 ml/100 g)溶液腹腔麻醉后固定于立体定向仪,头部备皮消毒,手术刀片沿正中切开头皮,剥脱分离骨膜,以牙科钻在冠状缝后5 mm、矢状缝右侧5 mm交汇处,扩大骨窗至5 mm×5 mm,保持硬膜完整。TBI组待夹尾反射出现后,将其固定于eCCI仪设置打击深度4 mm,持续时间120 ms,打击1次,速率4 m/s。正常造模后,TBI+PMB组,使用1ml注射器经腹腔注射给予PMB溶液(2.5 μg/ml),TBI+ NS组给予等体积生理盐水[6]。
1.4 神经功能缺损评分(neurological severity score,NSS) 行电子皮质损伤撞击仪打击,动物完全苏醒后,由不了解实验分组情况、经过专业培训的研究人员在造模24、48 h两个时间点参照文献[6]神经功能缺损评分表,对大鼠进行神经功能缺损评分。
1.5 SD大鼠急性TBI后肠道通透性的测定 取Normal组、Sham组、TBI组在造模后第3天给予FD4(0.4 mg/g)灌胃。灌胃3 h后通过颌下静脉丛方式进行取血。将取出的外周血滴入含有EDTA抗凝剂的EP管内,血液与抗凝剂混匀后置于冰上,配平,离心(3000 r/min, 4 ℃)20 min, 然后取血清50 μl用高压MilliQ水稀释,调整荧光分光光度计波长为488 nm,取100 μl稀释后的血清检测。利用标准曲线计算出样品的FD4的浓度。
1.6 SD大鼠急性TBI后外周血LPS浓度测定 血浆样品用样品处理液稀释10倍, 70°C水浴加热10 min后置于冰水中冷却待测。配制LPS标准溶液,本实验中标准曲线的溶液浓度为0.10、0.05、0.025、0.01、0.00 EU/ml。BET水作为阴性对照。设定全波长分光光度计,设置温育温度为37 ℃,生物光模式,读取波长为405 nm,提前预热仪器30 min。之后分别溶解试剂和显色基质,将1.7 ml的BET水加入试剂中,用手摇动使试剂完全溶解。试剂溶解后10 min内尽快用完。将0.1 ml BET水加入到显色基质中,用手摇动使显色基质完全溶解。溶解的显色基质溶液应尽快用完(无污染、4 ℃、8 h以内)。温度37 ℃,无热源96孔检测板预热5 min;依次加入50 μl BET水、LPS标准溶液或样品;加入50 μl试剂;孵育60 min后加入显色基质溶液100 μl,中速振摇10 s充分混匀后,孵育6 min后,加入反应终止剂50 μl,中速振摇10 s混匀后,设置波长405 nm,自动读取吸光度值。计录实验前,试验第1、3、5、7 天 共5个时间点外周血中LPS的浓度。
1.7 SD大鼠急性TBI后HE染色结合炎症评分的半定量测定 1周后取各组大鼠脑组织石蜡包埋,切片放在60 ℃烘箱中烘烤30 min,常规脱蜡,流水冲洗10 min后,苏木精染色2 min。随后用流水冲洗10 min,伊红复染2 min,流水冲洗10 min,乙醇脱水,二甲苯两次透明,中性树胶封固。每张HE染色切片目标区域随机选取5个视野,用Image Pro Plus 4.5软件分析图像,描记切片炎性反应区域的轮廓,得到炎症浸润面积的比例。脑组织炎症评分按照表格中的方法分为0~4级,按照炎症浸润面积<10%、10%~25%、>25%~50%、>50%,分别记1~4分,进行统计分析。

2 结 果
2.1 神经功能缺损NSS评分的结果 Normal组和sham组未伤及正常脑组织,神经功能未缺损,评分正常。TBI组神经功能出现明显受损,主要表现为无法沿直线行走,平衡功能明显障碍,外周感知能力下降,NSS评分均升高(P<0.01,表1),即创伤性脑损伤干预明确。在24、48 h两次测定NSS评分,结果一致。
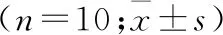
表1 不同时间点创伤性脑损伤大鼠NSS评分
2.2 SD大鼠急性TBI后外周血FD4浓度的变化 结果发现,与Sham组比较,TBI组外周血中FD4的浓度明显增加[(4228±203)ng/mlvs.(2743±279) ng/ml],差异有统计学意义(P<0.01)。Sham组与Normal组比较,外周血中FD4的浓度增高[(2743±279)ng/mlvs.(1850±80) ng/ml],差异有统计学意义(P<0.05,图1)。
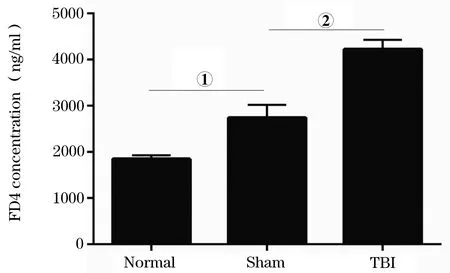
图1 各组大鼠外周血FD4的浓度差异统计结果
与Sham组比较,①P<0.01;与Normal组比较,②P<0.05
2.3 SD大鼠急性TBI后外周血LPS浓度的变化 试剂终点显色结果显示,在基线水平,TBI组和Sham组大鼠LPS浓度差异无统计学意义。与基线比较,TBI组LPS浓度从术后第1天即有升高趋势,但差异无统计学意义,在第3天达到高峰,之后迅速下降,在第5、7天即恢复基线水平;与基线比较,Sham组各时间点LPS浓度差异无统计学意义。与Sham组比较,TBI组术后第3天 LPS浓度显著升高,差异有统计学意义(P<0.05,表2),其余时间点差异无统计学意义。
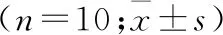
表2 各时间点SD大鼠急性TBI后外周血LPS浓度的变化
2.4 LPS清除剂PMB减轻SD大鼠急性TBI后的LPS浓度 在基线水平上,与TBI+NS组比较,TBI+PMB组和TBI组大鼠外周血LPS浓度差异均无统计学意义。TBI+PMB组第3天的LPS浓度低于同一时间点TBI+NS组,差异有统计学意义(P<0.01),其余时间点TBI+PMB组和TBI+NS组比较差异无统计学意义。TBI+NS组第1天和第5天的LPS浓度低于第3天时的浓度,差异有统计学意义(P<0.01,表3)。
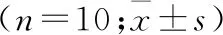
表3 各时间点LPS清除剂PMB减轻SD大鼠急性TBI后的LPS浓度
2.5 LPS清除剂PMB可降低梗死区域炎症反应 脑组织HE染色后镜下可见,Sham组神经细胞排列整齐,长度一致,胞膜完整,染色质清楚。间质未见明显水肿及炎症细胞浸润。TBI组均可见不同程度异常神经纤维排列紊乱,局部红细胞及炎症细胞浸润,部分神经细胞胞膜破坏,排列不规律,可见大片状坏死区域(图2)。TBI+NS组与TBI组炎症反应差异无统计学意义,TBI+PMB组炎症反应低于TBI+NS组(TBI+PMBvs.TBI+NS: 1.64±0.11vs.2.36±0.17,P<0.01)。

图2 大鼠脑组织HE染色(×200)
3 讨 论
研究表明,近年来有关TBI的实验多采用电子皮质损伤撞击仪(eCCI)造模,均报道了TBI模型未见死亡[6],神经功能缺损评分有效证明此造模效果可靠。通过成功建立大鼠TBI模型,探讨大鼠急性TBI后肠道菌群易位引起外周血LPS增加及LPS清除剂PMB对大鼠急性TBI后外周血炎症反应进程的影响。结果证实,大鼠急性TBI后肠道通透性增加,进而引起外周血LPS增加;急性TBI后外周血LPS浓度呈动态变化;LPS清除剂PMB在炎症反应初期能够有效地抑制外周血LPS浓度,进而影响急性TBI的病理生理进程。
3.1 急性TBI后肠道通透性增加 在20世纪70年代人们就发现,创伤及感染可引起肠黏膜通透性改变,进而导致肠道细菌及其代谢产物进入机体[7],即为菌血症或内毒素血症。急性TBI后肠道通透性增加,与TBI导致肠蠕动减弱、各种细胞因子、炎症介质的释放等因素相关[8, 9]。其中主要是细菌及其代谢产物通过肠黏膜入血,LPS可使诱导一氧化氮合酶(iNOS)合成增加,产生大量的NO,机体的过氧化物会与NO发生反应,形成的产物过氧化亚硝酸盐可通过氧化蛋白质巯基、Fe-S中心,破坏细胞肌动蛋白骨架等方式引起肠上皮细胞屏障功能破坏,增加肠壁通透性。而且LPS还能通过与单核-巨噬细胞作用,促使其分泌更多介质分子如TNF-α、IL-1等,再借助这些介质分子在肠道局部发挥作用,致使肠壁通透性增加[10]。本研究使用目前国外常用的FD4作为肠道通道性的检测物[11-13],以SD大鼠作为研究对象,利用FD4于TBI造模后第3天灌胃,取外周血检测FD4的分布。结果发现,与Sham组比较,在大鼠急性TBI后第3天血中FD4的浓度增加,证实急性TBI后出现肠道通透性增加。肠道通透性增加作为急性TBI后的一种病理生理变化,可能引起机体内环境改变,进而对急性TBI产生进一步影响。同时发现,与Normal组比较,Sham组也出现了肠道通透性增加的现象,这说明开颅对机体来说也是一种应激,同样会引起肠道内的生理病理改变。
3.2 急性TBI后血浆LPS的变化 本研究结果发现,急性TBI后血浆LPS的浓度呈现一过性增高后又下降的周期性变化。肠道直接与外界环境相通,是机体内最大的细菌及LPS聚集地。正常情况下,肠黏膜屏障具有保护作用,仅有极少量的LPS可以通过肠道黏膜进入血液,随即迅速被肝脏的kupffer细胞清除灭活。急性TBI后肠道通透性增加,LPS大量入血,不能被有效清除而出现肠源性内毒素血症[14]。在本实验中我们发现,急性TBI后血浆LPS浓度呈现动态变化,从第1天即有升高的趋势,第3天达到高峰,之后逐渐下降,第5、7天基本恢复基线水平;而Sham组LPS浓度无明显动态变化。以往实验证明LPS可快速激活全身免疫系统,免疫细胞活化,细胞因子和炎症介质大量释放,使神经细胞发生“再损伤”,LPS浓度越高,这种激活效应及损伤作用越重,因此TBI后针对LPS继发性升高的治疗也是TBI治疗和后续康复的关键环节。说明TBI发生后的前3 d是关键治疗窗口,在LPS达到峰值前进行干预,可以减轻LPS介导的炎症反应,提高TBI的治疗效果。对于Sham组血浆LPS的浓度无明显改变的情况,这可能与Sham组肠道通透性改变不同,尚未达到在血中能检测到LPS浓度变化的程度有关。
3.3 降低急性TBI后早期炎症反应 本研究通过HE染色结合炎症反应评分,对TBI后炎症反应进行半定量研究,PMB可降低TBI后早期炎症反应;PMB作为一种抗生素,其减轻炎症反应方面的作用非常明确,研究结果表明,PMB可能通过清除循环外周血LPS,进而降低TBI后大鼠脑组织炎症反应,这提示PMB可能对急性TBI的治疗有益。既往抗生素用于治疗急性TBI的研究存在争议,有关治疗机制的研究仍不充分,其作用可能与除抗生素常规作用以外的其他生物学作用有关,比如调节中性粒细胞、单核巨噬细胞等的免疫活性[15]。McCafferty等[16]采用口服万古霉素用于大鼠缺血再灌注模型,在排除了抗生素的直接作用后发现,抗生素能减少心肌梗死的面积并具有心脏保护作用。同时,应用糖皮质激素单向抑制TBI急性期的炎症反应,也被证明对于疾病本身的恢复作用并不明确[17]。多项研究认为,虽然急性TBI后过度的炎症反应对长期预后不利,但单向抑制炎症反应并不可取,炎症反应在急性TBI后组织修复中具有“双刃剑作用”[18,19]。
综上所述,本研究成功地证明了大鼠急性TBI后可出现肠道菌群易位及外周血LPS水平一过性增加。证实LPS清除剂PMB可降低急性TBI后早期LPS浓度,降低急性TBI后脑组织炎症反应。下一步,将继续探讨其降低炎症反应的分子学机制。
