正交试验与单因子双重试验法优化玉米PCR反应体系
2022-11-03江常胜朱洪海钟永丽刘明晓
江常胜,朱洪海,钟永丽,刘明晓,东 方
(中禾生物种业集团有限公司,广东 深圳 518000)
玉米(Zea mays L.)属禾本科一年生高大草本植物,又名苞米、玉蜀黍和包谷等,是世界三大粮食作物之一。玉米起源于美洲大陆,自古以来,人们通过人工驯化,杂交育种及现代生物学的方式对玉米品种不断进行改良,玉米逐渐形成了适宜生产需求的品种体系,其栽种范围也遍布全球各地。玉米是重要的农业作物,可作为粮食,同时也可做饲料加工,供畜牧业和养殖业使用[1],并且玉米在工业、医学等各个领域都有用途。因此,对玉米品种的改良一直是育种家们关注的问题。
分子育种就是在传统育种的基础之上,结合分子生物技术发展起来的一种现代育种方法。PCR(Polymerase Chain Reaction)技术是分子育种中一项重要的技术手段[2],其对分子育种工作有着极大的帮助作用。PCR(Polymerase Chain Reaction)又称聚合酶链式反应,是指在DNA聚合酶催化作用下,以母链DNA为模板,以特定引物为延伸起点,通过变性、退火和延伸等步骤,体外复制出与母链模板DNA互补的子链DNA的过程[3]。其原理类似于DNA的天然复制过程,其特异性依赖于与靶序列2端互补的寡核苷酸引物。PCR技术在基因分离克隆、序列分析、基因表达调控和基因多态性研究等许多方面有极其重要的作用[4]。目前,PCR技术在分子育种中被广泛应用,且相关方法和技术已经相当成熟。但基于不同基因组,不同研究方向的PCR应用仍需根据实际情况进行摸索,才能探索出适用于不同研究需要的最佳PCR反应体系。所以,在课题试验中,先建立起一种优化的PCR反应体系很有必要。本研究是在玉米抗丝黑穗病品种改良的研究课题中,探索适用于试验材料基因组的PCR最佳反应体系。采用正交试验与单因子双重试验法对PCR反应条件中主要因子(引物用量、模板DNA、模板DNA质量浓度和退火温度)进行优化分析,探索出了一套稳定性强、重复性好、扩增质量高且适用于大批量玉米种质材料PCR分析的优化反应体系,获得了能够满足后续科研工作的DNA扩增产物。
1 材料与方法
1.1 供试材料、试剂与仪器
1.1.1 供试材料
本试验所用玉米材料均来自深圳市大鹏新区华大基因试验基地,为抗丝黑穗病品种改良试验Q41的回交二代。在Q41的回交二代群体中预选6株材料(①-1、①-5、②-2、③-6、③-7和③-8)提取DNA,在其中选取DNA质量较好的4株材料做试验材料。
1.1.2 主要试剂与仪器
试剂:CTAB提取液、三氯甲烷、异戊醇、乙醇、2×Easy-TaqRPCR SuperMix、ddH2O、琼脂和1×TAE电泳缓冲液。
仪器:TC1000-G PCR仪、低速离心机、高速冷冻离心机、B-500超微量分光光度计、震荡研磨仪、UVP紫外凝胶成像系统、生物保存冰箱、移液枪、水平电泳仪和制冰机等。
1.2 试验设计与方法
1.2.1 模板DNA的提取
本次试验的材料均在试验田现场采取,取用玉米叶片幼嫩部位,用剪刀剪下后编号放入塑封袋,置于冰盒(冰盒提前放置冰和生物冰袋)冷冻保存,样品带回实验室后如果不能立即进行DNA提取操作,则保存于-80℃冰箱内,用时取出。DNA提取采用改良CTAB快速提取法,具体方法如下:①用打孔器在叶片上取下3片大小均一的叶片组织,装入预先做好编号的2 mL离心管中(离心管置于冰上),每个离心管中放入直径3 mm的钢珠2粒[5],在通风橱内加入600 μL的CTAB提取液,盖紧盖子。②将离心管对称放入研磨仪支架孔中,盖上上盖并旋紧螺母,在40 Hz频率下震荡研磨75 s,轻轻颠倒离心管将研磨物混匀,重复1次。③取出离心管(研磨物呈匀浆状),于通风橱中加入600 μL的三氯甲烷∶异戊醇(24∶1),混匀[5],室温静置10min。④12000r/min离心10 min,用移液枪将上清转移至1.5 mL预先做好编号的离心管(注意不要吸到中间层),加等体积无水乙醇,沉淀DNA[6]。⑤12 000 r/min离心5 min,弃上清,加75%乙醇洗涤。12 000 r/min离心2 min,弃上清,离心管管口朝下放置,室温晾干沉淀,加50 μLddH2O溶解DNA,低温保存[7]。
1.2.2 模板DNA质量检测
用超微量分光光度计对DNA纯度和质量浓度进行检测;制作琼脂糖凝胶,模板DNA的电泳结果如图1所示。
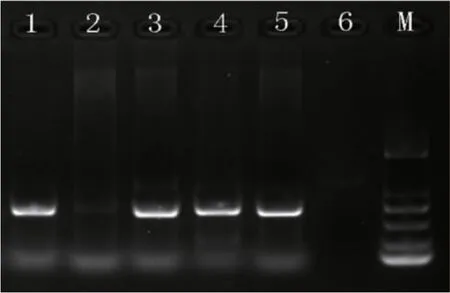
图1 模板DNA的电泳结果
对DNA紫外分光光度和琼脂糖凝胶电泳的结果分析:1、3、4、5这4个泳道的DNA样品条带较为清晰,且无杂带、拖带现象。结合超微量紫外分光光度计的检测,①-1、②-2、③-6和③-7这4个DNA样品杂质少,质量较高,能满足试验需求,所以最终确定以①-1、②-2、③-6和③-7这4个DNA样品为后续试验材料。
1.2.3 PCR反应体系试验设计
采用L1(643)正交试验设计,对影响PCR反应的3个因子:引物用量、模板DNA和模板质量浓度进行3因素4水平筛选,各组分的因素水平见表1。反应体系总体积为10 μL,其中含5 μL2×EasyTaqRPCR SuperMix(含EasyTaqRDNA Polymerase、dNTPs)、引物和1 μL模板DNA,其他各组分按照表2加入,不足体积以ddH2O补足[8]。

表1 正交试验设计因素及其水平

表2 L1(643)正交试验�设计表
1.2.4 PCR扩增程序及扩增产物的检测
PCR反应程序为:94℃预变性3 min;94℃变性30 s;56℃退火30 s;72℃延伸2 min;32个循环;72℃延伸10 min,12℃保存[9]。
按照正交试验表配置反应体系,配置好后的体系分装于PCR八连管中,盖好PCR八连管上盖,放入设置好扩增程序的PCR仪中进行扩增,扩增结束后,取出扩增产物低温保存备用。制备1%的琼脂糖凝胶,加入染液。待凝胶凝固后放入电泳槽[4],取5 μL扩增产物点样电泳。电泳30~40 min后取出凝胶在UVP紫外凝胶成像系统上观测并拍照。
1.2.5 退火温度试验优化
采用最优体系对退火温度进行梯度试验。温度取值在50.0~65.0℃范围内,在PCR仪上进行设置,设置好后PCR仪自动生成8个梯度温度(T1~T8),分别为50.0℃、52.0℃、54.9℃、56.6℃、58.3℃、60.0℃、63.0℃和65.0℃。扩增程序的预变性、变性、延伸的温度与时间及循环数与正交试验设计的设定相同。
2 结果与分析
2.1 PCR正交试验设计结果的直观分析
玉米PCR体系优化正交试验设计的结果如图2所示,根据聚丙烯酰胺凝胶电泳图中谱带强弱及清晰度进行分析,条带分析按照条带强且清晰、无拖带、杂带少或无为指标[10-11,5]。因正交试验设计具有均衡分散的特点,PCR反应体系中各个试验组分的组合彼此不同,因此扩增结果具有明显的差异。从图中可以看出,1、2、9、13、14、15号组合条带微弱模糊;3、4、7、10、11、12号组合条带明显,且无拖带现象,其中4号组合条带最亮,效果最好;5、6、8、16号组合有条带产生,但亮度一般,说明扩增效果也一般。综上所述,4号组合的扩增结果最好,即4号组合的模板DNA质量浓度与引物用量为最优选。因此,本次试验结果认为10 μL的PCR的最优反应体系条件组合应为引物0.25 μL、模板质量浓度40 ng/μL。

图2 玉米PCR体系优化正交试验设计结果
2.2 退火温度试验优化结果分析
采用最优组合对退火温度的优化试验结果如图3所示,根据直观观察发现,各个温度梯度条件下均可扩增出条带,但不同温度梯度的PCR扩增结果存在差异。结果表明:退火温度的高低直接影响到引物与模板DNA的特异性结合和扩增条带的样式,扩增结果随温度梯度变化差异显著。在T1(50.0℃)温度条件下,观察不到明显条带;在T2~T5(52.0~58.3℃)温度条件下,均有条带产生,但条带亮度呈现先亮后弱的趋势,其中在温度为T4(56.6℃)时条带最为清晰明亮,说明此温度下扩增效果最好;在温度条件为T6~T8(60.0~65.0℃)时,扩增条带极其微弱,基本无法观察,说明超过60.0℃的退火温度并不适合玉米PCR反应体系。综上所述,在50.0~65.0℃退火温度范围内,最适于玉米PCR反应体系的退火温度为56.6℃。

图3 最优组合下退火温度优化试验结果
3 讨论
实践表明,PCR反应容易受到各种因素的影响[12],扩增条件的变化对PCR的扩增结果影响较大,并且直接影响到PCR分析的准确性和可靠性。PCR谱带的准确性与稳定性是应用PCR技术进行遗传多样性分析的前提条件[13]。因此,为了获得准确而稳定的PCR谱带,在对不同物种甚至同一物种不同种质材料之间进行PCR分析之前,消耗适当的时间与精力寻求最适宜的PCR扩增条件十分必要。
为了解决准确性与稳定性的问题,绝大部分研究者均是在对大批量样品进行PCR扩增之前,先采用单因子双重试验法对PCR试验条件进行优化[14]。但是,单因子双重试验法并没有考虑到各种影响因子之间可能存在的交互作用。而且,在进行优化试验的过程中,前一个供试因素在一定水平范围内扩增出来的条带数和清晰度有可能完全一致[7],在选择该因素的某一水平作为后续供试因素之优化试验的条件时,就可能存在一定的主观性。因此,本次试验在方法上采用正交试验的方法,先探索出最佳的引物-模板体系,然后结合单因子双重试验方法,进而筛选出最佳退火温度。
试验中发现玉米的PCR扩增谱带出现了引物二聚体,引物二聚体的出现在PCR中是必然的,只是或多或少的问题,其最主要还是受引物设计本身的影响。因此,优化引物设计可大大降低引物二聚体现象出现的概率[15]。其次,在PCR体系配置过程中,体系在室温条件下放置过久也会导致引物二聚体的出现,所以,PCR体系的配置应在冰上进行。作为试验操作者,也要提高操作熟练度。
4 结论
本次试验以4个玉米材料基因组DNA为模板,先采用正交试验设计的方法,对引物用量、模板DNA质量浓度进行优化[16],对正交试验设16个组合的PCR扩增结果进行分析,确定了最佳的引物用量与模板DNA质量浓度,筛选出一种适用性较广且扩增结果优良稳定的10 μL的PCR反应体系:5 μL2×EasyTaqRPCR Super-Mix(含EasyTaqRDNA Polymerase、dNTPs)、引物0.25 μL和1 μL40 ng/μL模板DNA,体系其余部分以ddH2O补足。随后,采用单因子双重试验法,在50.0~65.0℃范围内探索退火温度条件,以最佳体系对退火温度进行优化,最终确定了玉米PCR反应的最佳退火温度为56.6℃。
在玉米分子育种的过程中,选择一种合适的PCR反应体系尤为重要。由于育种材料群体数量较大,而且不同的基因组之间反应体系往往也存在着差异[17],所以构建一种适用性广、扩增结果优良且稳定的PCR反应体系是进行后续育种工作的前提。本次试验成功探索出了玉米抗丝黑穗病品种改良回交群体的PCR最佳反应体系,且在后续的育种工作中,采用这种PCR反应体系的效果甚好。本次试验所建立的PCR反应稳定体系为玉米品种鉴定、分子育种、遗传作图和遗传多样性研究等奠定了基础。
