30例以发热症状首诊的ANCA相关性血管炎临床诊治分析*
2022-11-03赵然然李云霄谭春婷
赵然然,李云霄,谭春婷,林 芳,王 军,徐 波
(首都医科大学附属北京友谊医院呼吸内科,北京 100050)
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic auto anti-bodies,ANCA)相关性血管炎(anti-neutrophil cytoplasmic antibody-associated vasculitis,AAV)是一种累及全身多器官系统的自身免疫性疾病[1],属于少见疾病。临床上由于受累脏器的不同,患者可表现出不同症状,肺和肾脏是最常累及的靶器官,除以上两个脏器累及后出现的相关症状外,据统计一半以上的AAV患者出现发热症状[2]。由于缺乏特异性的临床症状和影像学特征,容易造成AAV早期误诊、漏诊。本文主要通过对首诊表现为发热的AAV患者临床表现、影像学特征及治疗预后情况进行总结,以提高对该病的认识和诊治水平。
1 资料与方法
1.1 一般资料
收集本院2016年1月至2021年12月以发热为首发症状并最终确诊为AAV的初诊患者共30例,男15例,女15例,性别比为1∶1;年龄39~84岁,平均(63±11)岁,>65岁者15例(50.0%)。所有入选患者诊断均符合2012年美国 Chapel Hill会议制订的AAV的诊断标准[3]。
1.2 方法
以“ANCA相关性”和“血管炎”为关键词在本院住院病例管理系统中进行检索,检索时间为2016年1月至2021年12月,通过病历阅读排除既往诊断或未合并发热症状的病例。收集所有30例患者的住院病历资料,包括起病症状体征、首次就诊科室、实验室检验结果、肺部CT结果、治疗及转归等。
1.3 统计学处理
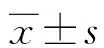
2 结 果
2.1 患者的一般资料
入选患者中,73.3%(22例)的患者髓过氧化物酶(MPO)-ANCA阳性(男性患者13例,占该类患者的59.1%),平均年龄(66±8)岁;26.7%(8例)的患者丝氨酸蛋白酶3(PR3)-ANCA阳性(男性患者2例,占该类患者的25.0%),平均年龄(55±12)岁。MPO-ANCA阳性患者年龄明显高于PR3-ANCA阳性患者(P=0.006),两组间性别构成比无明显差异(P>0.05)。所有患者从发病到确诊的中位时间为38(26,60)d,其中MPO-ANCA阳性患者为42(26,61)d,PR3- ANCA阳性患者为30(22,60)d,两组间无明显差异(P>0.05)。
2.2 临床表现
2.2.1首诊科室及误诊情况
首次就诊科室以感染科占比最高,为33.3%(10/30),其次为风湿科30.0%(9/30)和呼吸科16.7%(5/30),肾内科及眼科各2例(6.7%),神经科及结核科各1例(3.3%),见图1。病程初期共误诊26例,误诊率为86.7%,其中误诊为呼吸道感染19例(63.3%),起病初期口服或静脉给予抗生素治疗;误诊为眼科疾病3例,骨关节炎2例,肺结核1例,胃肠炎1例。
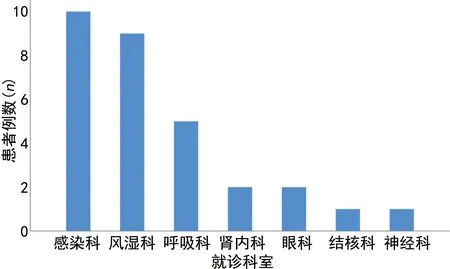
图1 首诊科室分布柱状图
2.2.2临床症状
30例(100.0%)患者均表现为发热,所有患者平均最高体温为(38.7±0.7)℃,两组间平均最高体温无明显差异(P>0.05);其次表现为非特异性全身症状、咳嗽/咳痰症状,均为18例(60.0%);肌肉/关节疼痛12例(40.0%),泌尿系统症状8例(26.7%),胸闷/憋气及视力下降各4例(13.3%),耳痛/耳鸣、结膜充血、消化系统症状(包括恶心、呕吐、腹泻)及皮疹者各3例(10.0%)。
2.3 辅助检查
2.3.1临床资料及实验室检测结果
两组患者的C反应蛋白(CRP)、红细胞沉降率(ESR)及超敏C-反应蛋白(hs-CRP)水平均明显高于正常参考值上限(CRP 8 mg/L,ESR 15 mm/h,hs-CRP 10 mg/L);血红蛋白(Hb)及血清清蛋白(ALB)水平低于正常参考值下限(Hb 130 g/L,ALB 40 g/L);尿潜血阳性共20例(66.7%),尿蛋白阳性共10例(33.3%);12例(40.0%)患者血清肌酐水平升高;免疫球蛋白中以免疫球蛋白G(IgG)升高为主,免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、补体C3及C4均未见明显异常。除血清肌酐水平,MPO-ANCA阳性与PR3-ANCA阳性患者其余各项实验室指标比较,差异均无统计学意义(P>0.05),见表1。
2.3.2胸部CT影像
30例患者中,90.0%(27例)合并肺受累,其中以肺部磨玻璃影为主要表现,共15例(50.0%),磨玻璃影以双下肺为主;其次为肺结节影13例(43.3%),索条影12例(40.0%),网格影8例(26.7%),斑片状实变影7例(23.3%),胸膜下线/小叶间隔增厚6例(20.0%),支气管壁增厚及纵隔淋巴结增大各5例(16.7%),蜂窝状影及肺气肿各3例(10.0%),局部支气管扩张及胸膜增厚各2例(6.7%),空洞及胸腔积液各1例(3.3%),部分患者合并多项肺部病灶,见图2。
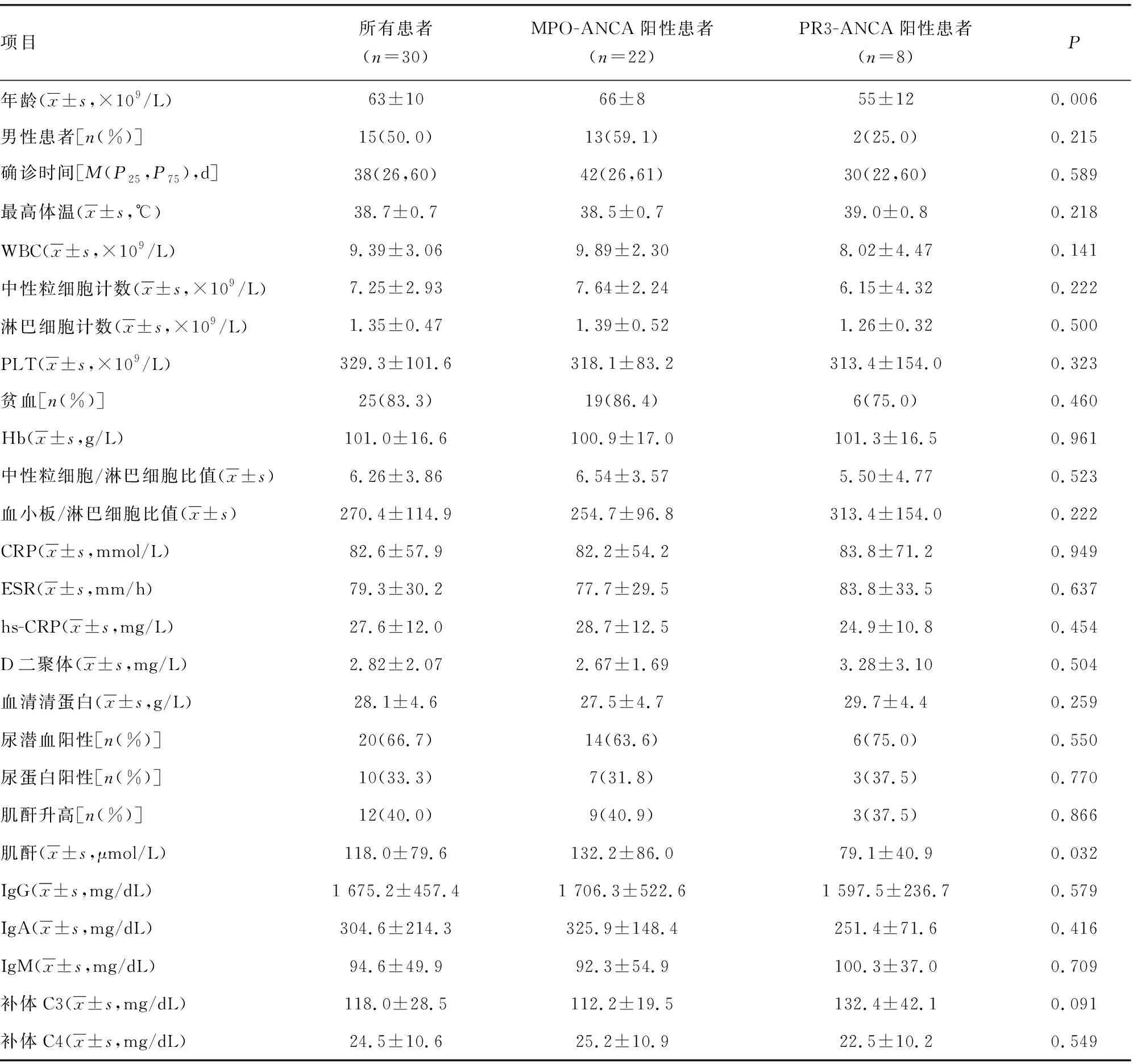
表1 患者临床资料及实验室检测结果
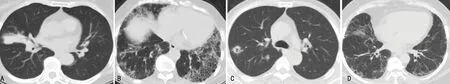
A:实变影伴支气管充气像;B:小叶间隔增厚、网格影、蜂窝影及牵拉性支气管扩张;C:空洞、磨玻璃影、结节影及胸膜牵拉;D:胸膜下线、小叶间隔增厚、磨玻璃影及索条影。
2.4 治疗及转归
患者药物治疗方案中均应用糖皮质激素,6例(20.0%)患者予以甲强龙500 mg/d冲击治疗,其中MPO-ANCA阳性患者5例,PR3-ANCA阳性患者1例;24例(80.0%)患者予以常规治疗剂量(0.5~1.0 mg/kg)的激素治疗;联用环磷酰胺(CTX)治疗者11例(36.7%);联合应用丙种球蛋白者2例(6.7%),均为MPO-ANCA阳性的病重患者,其中1例患者插管,治疗后均存活;联合雷公藤多苷及氨甲蝶呤(MTX)治疗者各1例(3.3%),见表2。治疗后,患者体温改善最为明显,用药2 d內可降至正常水平。除有2例患者(合并严重脏器功能不全并予以激素冲击治疗)出现病情加重外,28例患者均取得了较好的治疗效果,病情稳定后出院。

表2 30例患者的药物治疗方案[n(%)]
3 讨 论
AAV是以小血管发生炎症和纤维素样坏死为病理特征的系统性自身免疫性疾病[4],包括肉芽肿性血管炎(GPA)、显微镜下多血管炎(MPA)、嗜酸肉芽肿性血管炎(EGPA)。感染、药物、肿瘤及结缔组织疾病等均可诱发AAV。近期有研究发现,吸烟与AAV的发生有关,尤其可造成MPO-ANCA升高[5]。AAV的发病率在过去40年显著增加,目前已不属于罕见疾病。2017年,美国明尼苏达州的调查结果表明,AAV年发病率为3.3/10万人,总患病率达42.1/10万人[6]。挪威一家医院的研究结果显示,AAV的5年综合发病率高达4.39/万人[7]。我国2015年AVV患病率为27/10万人[8]。在美国和北欧地区的AAV患病人群中GPA发生率较高,而中国和日本以MPA更为常见[6,9]。因此,不除外种族和地域等因素对AVV发病也可能造成一定程度的影响。
AAV以肺和肾脏受累最为常见,同时还可以影响耳鼻喉、眼、神经、心血管、胃肠道、皮肤等多器官,临床表现缺乏特异性,因此常容易被漏诊。2005年陈旻等[2]在一项关于426例AAV患者临床表现的研究中发现,56.8%的患者病程中可出现发热症状。而存在肺受累的AAV患者,70%以上合并发热[10]。患者的首诊科室及治疗方案与发热及其他伴随症状密切相关。当AAV患者合并咳嗽、咳痰等呼吸道症状及肺部影像改变时,常被误诊为肺部感染而进行抗感染治疗。本研究中,33.3%的患者以不明原因发热收治于感染科,16.7%的患者因肺部感染入住呼吸科,19例患者在起病初期曾接受抗感染治疗。其中1例患者最长经过6个月才得到确诊,分析原因可能是由于合并呼吸道症状及肺部影像学改变给予抗感染治疗,后期患者血清ANCA检查阴性因而延误了诊断。可见,抗体阴性并不能作为排除AAV的标准,当诊断和治疗陷入困境时,应及时复查或进一步行病理检查明确诊断。5例因发热及肺部感染于呼吸科住院的患者,入院筛查时都合并贫血,2例合并尿潜血,2例合并肌酐升高。其中1例66岁男性患者既往无特殊病史,入院合并低蛋白血症、贫血、尿潜血阳性及肌酐升高,抗感染3 d后及时完善ANCA检查,并在住院7 d时确诊,给予激素治疗后体温恢复正常,临床症状得到明显改善。
ANCA是诊断AAV的血清标志物,按其间接免疫荧光类型可分为胞浆型(cytoplasmic ANCA,c-ANCA)和核周型(perinuclear ANCA,p-ANCA),靶抗原分别主要为PR3和MPO[11]。临床中仍然以MPO-ANCA阳性AAV更为常见[12-13]。本组AAV患者均出现发热症状,MPO-ANCA阳性比例更高,约为73.3%,且以男性患者为主。AAV以中老年患者发病率更高,对比后发现MPO-ANCA阳性患者平均年龄为(66±8)岁,高于PR3-ANCA阳性患者(55±12)岁。在一项关于比较MPO-ANCA和PR3-ANCA相关性肾小球肾炎的免疫细胞浸润的组织学亚型研究中发现,病变肾内的免疫细胞浸润亚型差异与不同的肾小球和小管间质病变相关,提示ANCA亚型中存在不同的免疫细胞浸润造成的肾损伤[14]。而MPO-ANCA阳性可导致更严重的肾功能减退,与患者所发生的全身炎症反应的标识物无关[14]。本组研究中,MPO-ANCA阳性组患者血清肌酐水平明显高于PR3-ANCA阳性组,也证实了这一结论。MPO-ANCA阳性患者,更应关注其肾功能的恶化。然而AAV相关的肺组织病理活检不普及,目前尚缺乏AAV肺病理与不同ANCA亚型之间的相关性研究。
AAV患者肾功能受损及病变累及肺可影响患者的总体生存率[15]。本研究发现,90.0%的患者存在肺受累,66.7%的患者尿潜血阳性,40.0%的患者出现血清肌酐升高。伍婷等[16]报道的269例AAV患者中有肾损伤者占90.7%,肺受累者占60.6%。与本研究结果有所差异,考虑与入组标准不同有关,发热首诊的患者中,以肺受累更为常见,而肾功能异常者表现往往以蛋白尿、血尿或下肢水肿为主,在疾病过程中可不出现发热症状。本组以发热为首诊表现的患者中,肾功能受损者占比达40.0%。本研究中,年龄大于65岁的老年患者15例(50.0%),既往研究报道确诊时年龄>65岁是AAV死亡的独立危险因素之一[17]。除此之外低PLT、低球蛋白血症、低IgG及血清肌酐升高是AAV患者1年肾生存率的危险因素,且血清肌酐升高是AAV患者全因死亡的独立危险因素[16]。
氟脱氧葡萄糖正电子发射断层扫描联合计算机断层扫描(FDG-PET/CT)有望成为排除AAV患者合并癌症或感染的有效手段[18]。此外,对神经系统受累AAV患者的诊断,PET-CT联合头颅增强磁共振成像可早期发现弥漫性或局灶性的椎管内高代谢病灶,早期诊断肥厚性硬脑膜炎[19]。
基于AAV的疾病特征,免疫抑制剂是诱导和维持缓解的主要治疗药物,通常在应用糖皮质激素治疗的基础上联合应用CTX或MTX。除局限性或早期系统性AAV可采用单独糖皮质激素治疗外,对于病情危重及靶器官受累严重者,推荐应用甲泼尼龙冲击治疗(500~1 000 mg/d,共3 d),其后可续贯口服泼尼松1 mg·kg-1·d-1,病情稳定后2个月左右逐渐减量至20 mg/d,同时可联合CTX或利妥昔单抗(RTX)[20]。而RTX联合糖皮质激素治疗对于复发性AAV患者再诱导缓解仍然有很高的疗效,亦无增加不良反应的风险[21]。本组患者中,24例应用常规剂量激素,6例应用了甲强龙500 mg/d静脉冲击治疗,部分联合CTX或MTX治疗。除有2例患者(合并严重脏器功能不全并予以激素冲击治疗)出现病情加重外,28例患者均取得了较好的治疗效果,病情稳定后出院。目前关于AAV维持缓解治疗的用药剂量及方案仍然存在争议,并在不断的探索中,而基于不同ANCA血清型的特异性治疗也受到越来越多的重视。MPO-ANCA阳性较PR3-ANCA阳性患者有更差的肾脏预后,但后者有更高的复发风险及更多的肾外器官表现,RTX在PR3-ANCA阳性患者和复发性患者治疗中显示出优于CTX的效果[22]。
综上所述,临床工作中以发热症状首诊的AAV临床表现常缺乏特异性,当发热合并多脏器功能受损且抗感染疗效不佳时,需及时完善血清ANCA或病理组织学检查,以早诊断、早治疗,减少误诊、漏诊发生,改善患者预后。
