沉默肌动蛋白样6A对胰腺癌细胞增殖、凋亡、侵袭及迁移的影响
2022-11-03林振宇董庆泰张建新尚作宏李中虎马丹丹金炜东
林振宇,董庆泰,张建新,钟 彬,张 涛,尚作宏,殷 微,李中虎,马丹丹,金炜东,
胰腺癌是常见的消化道恶性肿瘤之一,发病率和病死率逐年上升,其5年生存率小于8%[1]。2020年统计数据显示,在185个国家36种恶性肿瘤中,胰腺癌是肿瘤导致死亡的主要原因之一,排名第7位[2]。其具有早期诊断率低,中晚期时常伴随着病灶转移,疗效欠佳且预后差等特点。因此提高胰腺癌的早期诊断率,寻找新的肿瘤基因治疗靶点迫在眉睫。
ACTL6A 基因编码肌动蛋白相关蛋白家族成员,并且与传统的肌动蛋白具有显著的氨基酸序列同源性。ACTL6A是ATP依赖性SWI/SNF样BRG1/BRM相关因子复合体的重要组成部分,参与人体内多种生理过程,包括囊泡运输、调控基因转录、纺锤体定向、核迁移和染色质重塑[3]。ACTL6A与前列腺癌[4]、肝癌[5]、胶质瘤[6]、胆管癌[7]等多种肿瘤的发生发展密切相关。但目前其在胰腺癌中的表达和作用尚不明确,该研究主要通过探讨沉默ACTL6A对胰腺癌细胞增殖、侵袭、转移及凋亡的影响,分析ACTL6A在胰腺癌中的细胞生物学功能。
1 材料与方法
1.1 基因表达差异分析利用Oncomine数据库检索ACTL6A在胰腺癌组织及正常胰腺组织中的基因表达差异。在Oncomine数据库筛选“ACTL6A”基因,设定条件为:“normalvscancer”、“pancreatic cancer”、“mRNA”,获得各个研究中胰腺癌组织与正常胰腺组织中的表达情况,并行荟萃分析。
1.2细胞培养及转染① SW1990细胞系培养于DMEM培养基(含10%的胎牛血清),置于37 ℃、5% CO2培养箱中培养。② 取对数生长期细胞接种于6孔培养板,待贴壁后,使用阳离子脂质载体Lipofectamine 2000将沉默ACTL6A质粒及siRNA阴性对照质粒分别转染SW1990细胞作为siRNA-ACTL6A组与siRNA-NC组。
1.3 CCK-8实验取对数生长期siRNA-ACTL6A组与siRNA-NC组细胞接种于96孔板,每组设置3个复孔。分别于培养24、48 h后加入10% CCK-8试剂,每孔10 μl,放入37 ℃培养箱孵育2 h。最后进行检测(酶标仪波长450 nm),记录吸光度(absorbance, A)值。
1.4 流式细胞仪检测细胞凋亡用胰酶消化siRNA-ACTL6A组与siRNA-NC组细胞,5 000 r/min离心5 min,重悬后制成细胞悬浮液,调整细胞悬液浓度为1.0×105/ml,接种于96孔板中,每孔中加入细胞悬液0.2 ml,培养48 h后,PBS清洗2次;低温下加入Binding Buffer重悬细胞。室温避光条件下取100 μl细胞悬液加入5 μl的AnnexinV-FITC和Propidium Iodide,静置10 min。最后加入400 μl Binding Buffer混匀,流式细胞仪检测细胞凋亡。每组设置3个复孔。
1.5 Transwell实验用胰酶消化siRNA-ACTL6A组与siRNA-NC组细胞,1 000 r/min离心5 min,取沉淀用DMEM重悬,形成单细胞悬液,调整细胞密度为1.0×106/ml。每孔取100 μl细胞悬液并接种到含有无血清培养基的Transwell小室上层中。下室内加入500 μl有血清的DMEM高糖培养基。置入配养箱中培育24 h后,在室温下每孔加入1 ml 4%多聚甲醛固定15 min,用PBS洗去甲醛,棉签擦去上室未迁移细胞,0.5%结晶紫染液染色15 min,自然风干后在显微镜下以200倍放大观察染色细胞。每组设置3个复孔。
1.6 划痕实验用胰酶消化siRNA-ACTL6A组与siRNA-NC组细胞,1 000 r/min离心5 min,取沉淀用DMEM重悬,形成单细胞悬液,铺于6孔板中培养,待细胞铺满贴壁,用10 μl消毒枪头垂直划痕,PBS洗3次,使用显微镜记录此时的细胞图像并记录划痕宽度,记为0 h;加入无血清DMEM培养基置于培养箱中培养,48 h后再用拍摄显微镜记录此时的细胞图像并记录划痕宽度,放大图片倍数为200倍。
1.7 GSEA富集分析收集癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库中ACTL6A在胰腺癌中的基因表达数据。以胰腺癌患者ACTL6A mRNA表达水平的中位数为分割点将患者划分ACTL6A高表达组与ACTL6A低表达组。基因集富集分析(Gene Set Enrichment Analysis, GSEA)是基于JAVA语言的一款基因富集分析软件,本研究利用GESA软件进行KEGG通路富集分析。每次分析进行1 000次基因组排列。校正P值及错误发现率(false discovery rate,FDR)均小于0.05的基因组被认为差异具有显著性。
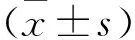
2 结果
2.1 ACTL6A mRNA在胰腺癌组织及正常胰腺组织中的基因表达差异Oncomine数据库中有4项子研究符合筛选条件。4项子研究分别为BadeaPancreas、Lacobuzio-Donahue Pancreas2、Pei Pancreas及Segara Pancreas,共包含117个胰腺癌组样本及66个正常胰腺组织样本。对其进行荟萃分析,结果显示ACTL6A在胰腺癌组织中的表达水平高于正常胰腺组织(P<0.05)。见图1。

图1 ACTL6A在胰腺癌组织和正常胰腺组织中的表达差异
2.2 沉默ACTL6A抑制胰腺癌SW1990细胞的增殖CCK-8法实验表明,与siRNA-NC组相比,siRNA-ACTL6A组胰腺癌SW1990细胞的增殖能力明显下降,在24、48 h吸光度值差异有统计学意义(P<0.01),见表1。表明沉默ACTL6A抑制胰腺癌细胞的增殖。

表1 CCK-8法检测胰腺癌细胞的增殖
2.3 沉默ACTL6A促进了胰腺癌SW1990细胞的凋亡细胞凋亡实验结果如图2所示,siRNA-ACTL6A组的凋亡率明显高于siRNA-NC组(t=12.192,P<0.001),表明沉默ACTL6A明显促进了胰腺癌细胞的凋亡。

图2 沉默ACTL6A促进SW1990细胞的凋亡与siRNA-NC组比较:***P<0.001;Q1区:机械损伤;Q2区:晚期凋亡或坏死;Q3区:早期凋亡细胞;Q4区:正常存活
2.4 沉默ACTL6A抑制了胰腺癌SW1990细胞的侵袭Transwell实验结果如图3所示,siRNA-ACTL6A组侵袭细胞数较siRNA-NC组明显减少(t=4.464,P<0.05)。表明沉默ACTL6A抑制胰腺癌细胞的侵袭。
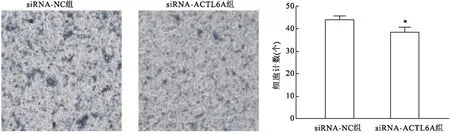
图3 沉默ACTL6A抑制SW1990细胞的侵袭 ×200与siRNA-NC组比较:*P<0.05
2.5 沉默ACTL6A抑制了胰腺癌SW1990细胞的迁移划痕实验结果如图4所示,48 h后siRNA-ACTL6A组愈合率较siRNA-NC组低,差异有统计学意义(t=3.960,P<0.05)。表明沉默ACTL6A抑制胰腺癌细胞的迁移。
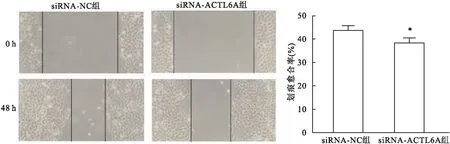
图4 沉默ACTL6A抑制SW1990细胞的迁移 ×200与siRNA-NC组比较:*P<0.05
2.6 GSEA信号通路富集分析GSEA研究结果显示:ACTL6A mRNA高表达组在细胞周期通路、核苷酸切除修复、碱基切除修复、DNA复制、癌症信号通路、NOTCH信号通路等相关基因集出现上调(P<0.05)。当ACTL6A基因表达上调时,上述通路被激活。结果如表2和图5所示。
图5 基因集GSEA的富集图
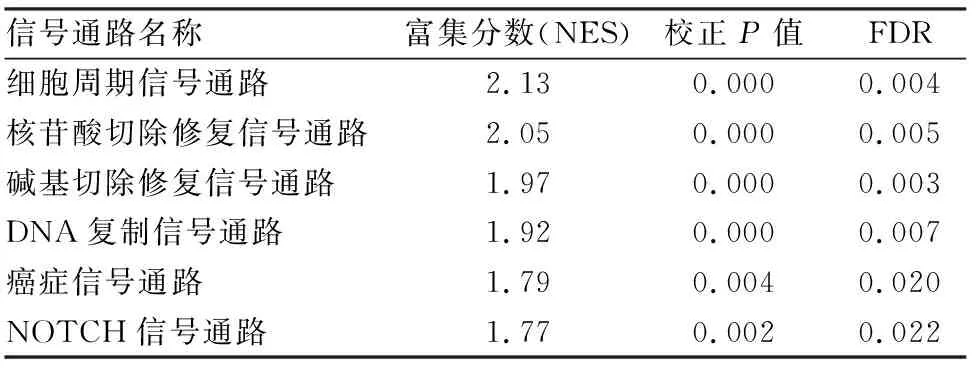
表2 高表达ACTL6A的GSEA富集结果
3 讨论
胰腺癌因其高侵袭性和转移性,目前治疗该疾病仍然面临诸多困难。随着基因治疗技术的发展,分子靶向治疗已成为胰腺癌诊疗的热点。由于缺乏胰腺癌特异的分子靶点,不利于胰腺癌的早期诊断、治疗及预后的评估。因此深入探索胰腺癌发病潜在的分子靶点对于疾病的诊疗至关重要。
研究表明,ACTL6A在多种癌症中高度表达,Jin et al[4]发现,同正常前列腺组织相比,ACTL6A 在前列腺癌组织中的表达显著升高,并且与雄激素受体的表达密切相关。Xiao et al[5]同样发现,ACTL6A 于人肝细胞癌组织及细胞系中高表达。在胶质瘤组织中的ACTL6A表达水平高于正常脑组织且ACTL6A的高表达与不良预后相关[6]。本研究中,Oncomine数据库分析结果显示ACTL6A在胰腺癌组织中的表达水平高于正常胰腺组织。与相关文献[4-6]报道一致,均有力证实ACTL6A在胰腺癌中高表达。
本研究中,体外细胞学实验结果表明沉默ACTL6A抑制胰腺癌细胞增殖、侵袭及迁移,并促进其凋亡。研究[8]显示ACTL6A在卵巢癌中过表达,并且ACTL6A过表达与预后不良相关。体外沉默ACTL6A可抑制卵巢癌细胞的增殖、侵袭和迁移,并降低葡萄糖利用、乳酸生成和丙酮酸水平。Shrestha et al[9]发现ACTL6A可促进鳞状细胞癌细胞增殖、侵袭和迁移,并且ACTL6A基因敲除可显著抑制其细胞生物学功能。在胆管癌组织中,ACTL6A呈现异常表达,沉默ACTL6A基因后,人胆管癌QBC939细胞的增殖、迁移和侵袭能力受到明显抑制[7]。Jian et al[10]研究发现ACTL6A的过表达促进了乳腺癌细胞增殖和肿瘤生长,而沉默ACTL6A则抑制了乳腺癌细胞增殖和肿瘤生长。本研究结果证实ACTL6A在胰腺癌中表现为癌基因特性,可能具备作为胰腺癌新治疗靶点的潜力。
近年来研究发现胰腺癌相关基因突变多集中于DNA损伤修复、细胞周期调控、TGF-β信号通路、染色质调节、轴突导向通路等[11]。Zhong et al[12]研究发现在急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)患者中ACTL6A的表达异常升高,其体外实验证实沉默ACTL6A基因能够促进NB4和HL-60细胞的分化,表明ACTL6A在APL分化中具有重要作用,进一步机制研究发现,ACTL6A是通过SOX2和Notch1信号传导途径来促进细胞的分化。Xiao et al[5]研究表明ACTL6A通过激活NOTCH信号通路促进肝细胞癌转移和上皮-间质转化,ACTL6A不仅通过SOX2激活NOTCH1信号通路,而且还通过SOX2影响肝癌细胞的生物学行为。Zhang et al[8]发现在卵巢癌组织中,ACTL6A和PGK1的表达呈正相关,ACTL6A过表达增加PGK1表达,而敲低ACTL6A则相反。ACTL6A表达改变通过下调PGK1抑制卵巢癌细胞体内致瘤性。在喉鳞癌细胞中,ACTL6A的敲除抑制了Yes相关蛋白(YAP)介导的信号通路的激活,而YAP的重新激活显著逆转了ACTL6A沉默介导的喉鳞癌细胞增殖和侵袭的抑制[13]。Li et al[14]研究发现ACTL6A的表达可能通过S6K1/pS6通路促进食管鳞状细胞癌细胞周期的再分配来影响细胞的增殖和DNA合成。本研究中,利用GSEA富集分析预测ACTL6A在胰腺癌中发挥功能的可能信号通路,结果显示ACTL6A在胰腺癌中发挥功能的可能信号通路有细胞周期通路、NOTCH信号通路等,与文献[5,14]报道一致。除此之外,还有核苷酸切除修复信号通路、碱基切除修复信号通路、DNA复制信号通路、癌症信号通路等,可为ACTL6A在胰腺癌中的机制研究提供更多线索和思路。
