人参皂苷RG1调控丙酮酸激酶M2影响视网膜毛细血管内皮细胞糖酵解和血管形成
2022-11-03薛黎萍李亚娣张晓帆张洁莹梁佳芮张传宏
薛黎萍,胡 敏,李亚娣,张晓帆,张洁莹,周 园,梁佳芮,张传宏,丁 鹏
糖尿病视网膜病变(diabetic retinopathy,DR)是最常见、最严重的糖尿病微毛细血管并发症之一,DR的基本病理特征是新生血管的生成[1]。有研究[2]表明内皮细胞(endothelial cells,ECs)代谢在血管生成中的关键作用,ECs的增殖和迁移依赖于糖酵解产生的能量,因此,抑制ECs中的糖酵解可能会抑制DR中新血管形成。丙酮酸激酶M2(pyruvate kinase M2, PKM2)是糖酵解末端步骤的限速酶,它促进磷酸烯醇式丙酮酸释放能量,为细胞生长提供有利条件[3]。Liu et al[4]报道,高葡萄糖(high glucose,HG)可诱导人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMECs)中PKM2表达增加,而抑制PKM2后可逆转HG诱导的HRMECs损伤和凋亡。人参皂苷Rg1(ginsenoside Rg1,GRg1)是人参中的一种主要皂苷,在糖尿病中具有抗血管生成和抗凋亡活性[5],但在DR中,鲜有关于GRg1是否通过调控糖酵解过程影响血管形成的报道。因此,该研究旨在探讨GRg1通过调控PKM2的表达对HRMECs糖酵解的影响。
1 材料与方法
1.1 细胞株及主要试剂人视网膜微血管内皮细胞HRMECs(上海泽叶生物科技有限公司);LipofectamineTM2000转染试剂盒、TRIzol试剂、Western blot试剂盒(美国Thermo Fisher公司);Qiagen RNeasy mini 试剂盒(广州健仑生物科技有限公司);PrimeScript RT试剂盒(北京智杰方远科技有限公司);葡萄糖检测试剂盒和ATP检测试剂盒(生工生物工程股份有限公司);乳酸含量检测试剂盒(北京索莱宝科技有限公司);血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素-1(angiopoietin-1,Ang-1)、血管生成素-2(angiopoietin-2,Ang-2)、成纤维细胞生长因子2(fibroblast growth factor2,FGF2)和GAPDH(英国Abcam公司);ECs专用培养基(武汉普诺赛生命科技有限公司)
1.2 细胞培养及转染HRMECs在含有5%胎牛血清(fetal bovine serum,FBS)、1%青霉素/链霉素和1% ECs生长因子的HRMECs特异性ECs培养基中培养。所有细胞均在37 ℃、5% CO2培养箱中培养。每2 d更换一次培养基。正常葡萄糖条件下的葡萄糖浓度为5 mmol/L,HG条件下的葡萄糖浓度为25 mmol/L,细胞在HG条件下培养48 h后加入10 μmol/L GRg1,继续培养48 h进行后续实验。根据Lipofectamine 2000转染试剂盒说明将阴性对照物(NC)、靶向PKM2的小干扰RNA(si-PKM2)和过表达PKM2(OE-PKM2)的质粒转染至HRMECs。
1.3 qRT-PCR检测HRMECs中PKM2 mRNA的表达情况收集各组细胞,使用TRIzol试剂提取细胞总RNA,根据PrimeScript RT试剂盒说明将1 μg总RNA逆转录合成cDNA,以GAPDH为内参,进行定量PCR反应,反应体系为:ddH2O 7 μl,SYBR Green PCR Master Mix 10 μl,cDNA 2 μl,上游引物0.5 μl,下游引物0.5 μl,总体系共20 μl。PCR反应条件为:95 ℃预变性10 min,然后3步反应,95 ℃变性15 s,60 ℃ 退火30 s,共45个循环。引物序列见表1。

表1 引物序列
1.4 Western blot检测HRMECs中相关蛋白表达量使用RIPA缓冲液裂解细胞,BCA蛋白检测试剂盒分析蛋白质浓度,然后加载到十二烷基硫酸钠-聚丙烯酰胺凝胶电泳微型凝胶上并转移到聚偏二氟乙烯膜上。将膜在含有5%脱脂奶粉的封闭缓冲液中封闭,并在4 ℃下加入提前稀释好的一抗(VEGF,1 ∶10 000;Ang-1,1 ∶10 000;Ang-2,1 ∶5 000;FGF2,1 ∶1 000;GAPDH,1 ∶2 500),室温孵育2 h。然后在室温下将膜与HRP标记的二抗孵育1 h,ECL显色,凝胶成像系统成像分析,使用ImageJ软件进行蛋白质印迹结果的定量。
1.5 血管形成实验检测HRMECs血管形成能力将Matrigel(90 μl)涂到24孔板中,在37 ℃下硬化30 min,将HRMECs以每孔1.2×105个细胞的密度接种到Matrigel包被的孔顶部,于100%湿度、37 ℃、5%CO2的无菌培养箱中培养6 h,然后在倒置显微镜下观察体外管腔生成结果并拍照,使用Image Pro Plus软件分析计算视野内Matrigel小管形成的数量,以此量化血管形成能力。
1.6 HRMECs中葡萄糖摄取量和乳酸产量收集细胞到离心管内,离心后弃上清液,每组收集5×105个细胞,加入100 μl蒸馏水,超声波破碎细胞(冰浴,功率200 W,超声3 s,间隔10 s,重复30次),95 ℃水浴10 min,冷却后,25 ℃、10 600 r/min离心10 min,取上清液备用;酶标仪预热30 min以上,按照试剂盒说明书加入各试剂,根据公式计算葡萄糖摄取量。同样,按照乳酸含量检测试剂盒说明书检测乳酸产量。
1.7 HRMECs中ATP含量收集各组细胞,每组收集5×105个细胞,加入100 μl提取液,冰浴下超声波破碎1 min,4 ℃、11 818 r/min离心10 min,取上清液至另一离心管,加入500 μl的氯仿充分震荡混匀,4 ℃、11 818 r/min离心3 min,取上清液,置冰上待测。根据试剂盒说明加入反应液,检测酶标仪340 nm波长处的光密度(optical density,OD)值,根据公式计算腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)含量。
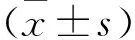
2 结果
2.1 GRg1抑制HRMECs血管形成Western blot检测结果显示,与NC组相比,HG组细胞的VEGF、Ang-1、Ang-2、FGF2的表达水平增强,经GRg1处理后,VEGF、Ang-1、Ang-2、FGF2的表达下降(P<0.05),见图1A;同时分析视野内Matrigel小管形成的数量,结果显示,与NC组细胞相比,HG组细胞血管形成数量增多(P<0.01),而GRg1处理HG诱导的HRMECs后,其血管形成数量减少(P<0.05),见图1B。
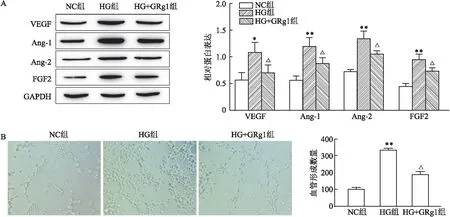
图1 GRg1抑制HRMECs血管形成A:GRg1处理后HRMECs的相关蛋白表达情况;B:GRg1处理后HRMECs的血管生成情况×200;与NC组比较:*P<0.05,**P<0.01;与HG组比较:△P<0.05
2.2 GRg1抑制HG诱导的HRMECs糖酵解在HG的处理下,HRMECs对葡萄糖的摄取量高于NC组(P<0.001),其乳酸和ATP产量也高于NC组(P<0.001);用GRg1处理HG组细胞后,与HG组相比,细胞对葡萄糖的摄取减少(P<0.01),乳酸及ATP产量与HG组相比也降低(P<0.01),见图2。
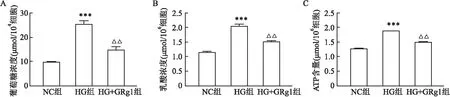
图2 GRg1抑制HG诱导的HRMECs糖酵解A:GRg1处理后HRMECs的葡萄糖摄取量;B:GRg1处理后HRMECs的乳酸产量;C:GRg1处理后HRMECs的乳酸产量;与NC组比较:***P<0.001;与HG组比较:△△P<0.01
2.3 GRg1调控HRMECs中PKM2表达qRT-PCR检测结果显示,HG组细胞PKM2 mRNA的表达增加(P<0.001),在GRg1处理后,PKM2 mRNA的表达有所下调(P<0.01),见图3A;Western blot检测HRMECs中表达量发现,PKM2在HG组中的表达高于NC组(P<0.01),而经GRg1处理后,其在HRMECs中的表达降低(P<0.05),见图3B。
图3 GRg1调控HRMECs中表达A:GRg1处理对HRMECs中PKM2 mRNA表达的影响;B:Western blot检测HRMECs中PKM2的表达;与NC组比较:**P<0.01,***P<0.001;与HG组比较:△P<0.05,△△P<0.01
2.4 GRg1通过调控PKM2的表达减少HRMECs糖酵解抑制血管形成qRT-PCR检测si-PKM2和OE-PKM2的转染效率,结果显示,转染si-PKM2后,其表达量降低(P<0.001),见图4A。转染OE-PKM2后,其表达量升高(P<0.001),见图4B。表明细胞转染效率佳。对每组细胞的糖酵解过程检测发现,与HG+GRg1组相比,HG+GRg1+OE-PKM2组细胞的葡萄糖摄取量、乳酸和ATP产量均升高(P<0.05或P<0.01),而HG+GRg1+si-PKM2组细胞的葡萄糖摄取量、乳酸和ATP产量均降低(P<0.01),见图4C-4E。检测HRMECs中相关蛋白表达量,结果如图4F,在HG+GRg1+OE-PKM2组细胞中,VEGF、Ang-1、Ang-2、FGF2的表达量高于HG+GRg1组(P<0.05),HG+GRg1+si-PKM2组的蛋白表达量则降低(P<0.05或P<0.01)。最后,通过血管形成实验进一步验证,HG+GRg1+OE-PKM2组细胞的血管生成数量多于HG+GRg1组(P<0.01),而HG+GRg1+si-PKM2组的血管形成数量比HG+GRg1组减少(P<0.05),见图4G。
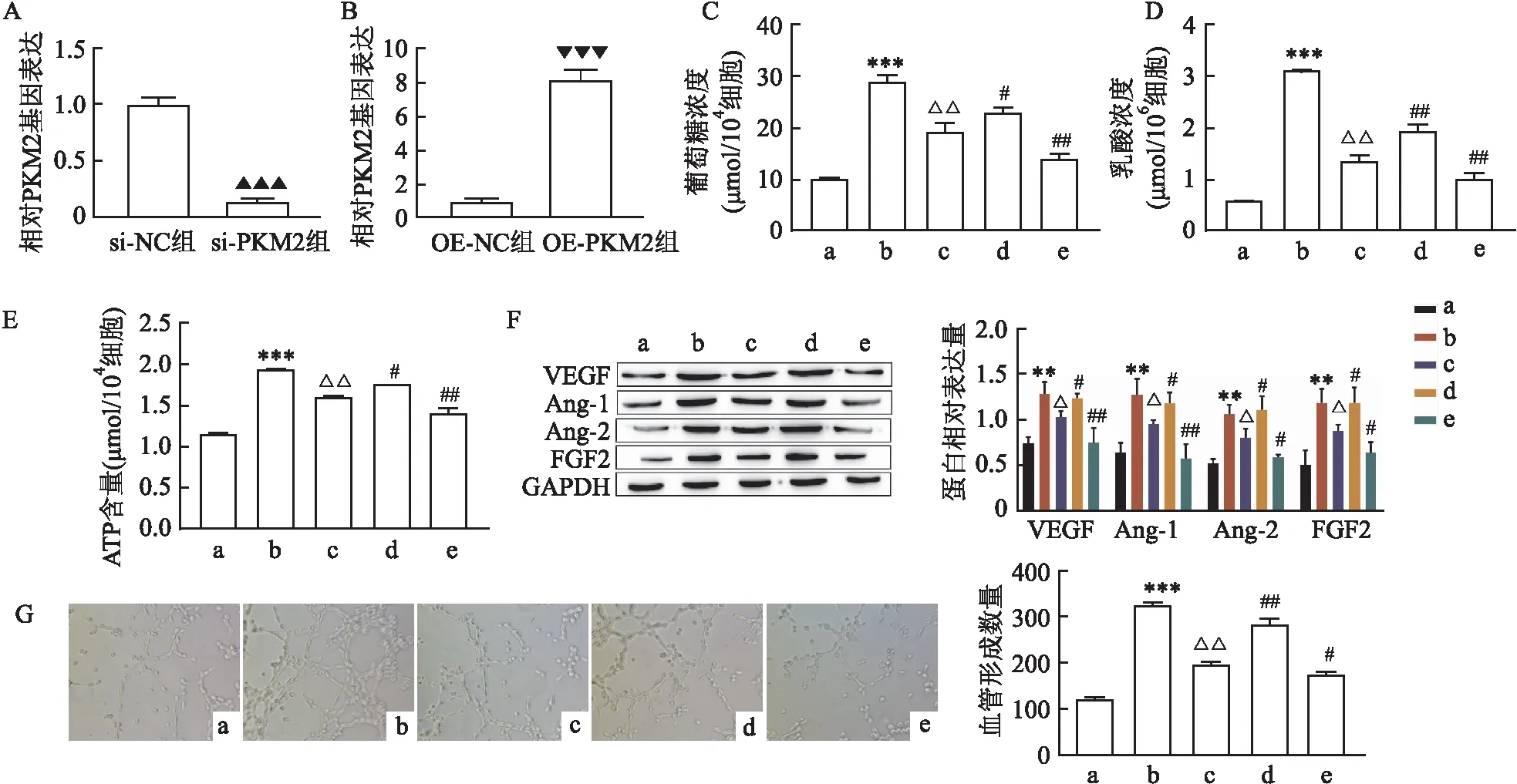
图4 GRg1通过调控PKM2的表达减少HRMECs糖酵解抑制血管形成A:qRT-PCR检测si-PKM2的转染效率;B:qRT-PCR检测OE-PKM2的转染效率;C:各组HRMECs的葡萄糖摄取量;D:各组HRMECsHRMECs的乳酸生成量;E:各组HRMECs的ATP产量;F:各组HRMECs的蛋白表达;G:各组HRMECs的血管生成情况×200;a:NC组;b:HG组;c:HG+RGg1组;d:HG+RGg1+OE-PKM2组;e:HG+RGg1+si-PKM2组;与si-NC组比较:▲▲▲P<0.001;与OE-NC组比较:▼▼▼P<0.001;与NC组比较:**P<0.01,***P<0.001;与HG组比较:△P<0.05,△△P<0.01;与HG+RGg1组比较:#P<0.05,##P<0.01
3 讨论
DR的发展与高血糖相关,长期的高血糖环境可损伤视网膜血管内皮,引起一系列眼底病变,如微血管瘤、新生血管、玻璃体增生甚至视网膜脱离[6],视网膜新生血管被认为是DR中不可逆失明的主要原因。通过对高糖诱导下的HRMECs进行研究,可以发现HG环境可以诱导HRMECs的血管生成。
GRg1是人参中的主要活性成分之一,具有抗炎、抗氧化、神经保护等多种药理活性[7]。Zhu et al[8]报道GRg1可以减轻HG诱导的人脐静脉ECs屏障功能障碍;Ying et al[9]报道GRg1通过激活IRS-1/Akt/GSK3β信号传导,保护过度磷酸化Tau诱导的糖尿病视网膜神经变性,阻止DR 的进展。由此可知,GRg1可能在DR的血管病变中发挥作用。PKM2在所有核酸合成率高的细胞中均有表达,如胚胎细胞、正常增殖细胞和肿瘤细胞[10]。PKM2的四聚体通常与正常细胞中ATP的产生和糖酵解中间体的分解代谢增加有关[11]。目前已有研究[12]表明PKM2在肿瘤发生和伤口愈合过程中具有调节血管生成的作用。此外,PKM2也已经被证实参与调控DR中HRMECs的炎症、凋亡和功能障碍[4]。本研究结果显示,HG处理HRMECs后可上调PKM2表达,PKM2表达被抑制后可减少HG诱导的糖酵解和血管形成。GRg1可抑制HG诱导的PKM2表达升高,抑制PKM2诱导的糖酵解过程,进而抑制HG诱导的血管形成。
DR的发病机制不仅受多种因素通过整合的分子信号通路和细胞过程的调节,ECs的葡萄糖代谢通过控制ECs增殖、迁移和新血管形成在DR的眼部新生血管疾病中也发挥重要作用[13]。Feng et al[14]的研究表明,通过在视网膜病变小鼠玻璃体内注射PFKFB3的小干扰RNA可以减少糖酵解,并且抑制了脉络膜和视网膜ECs新生血管形成。Pedro et al[15]发现糖原合成、戊糖循环和糖酵解途径对VEGF和FGF刺激下的ECs增殖至关重要。由此可知,ECs糖酵解在DR新血管形成中发挥重要作用,调节视网膜ECs糖酵解途径的分子或药物对DR的治疗有重要意义。对HRMECs的葡萄糖、乳酸和ATP生成量进行研究发现,在HG的影响下,三者的生成量均显著升高,而在加入GRg1后,降低了葡萄糖、乳酸和ATP生成量;但如图4内容所示,HG+GRg1组导致的效应改变应该可以通过HG+GRg1+OE-PKM2组来逆转,但本研究结果并未完全逆转,因此GRg1对视网膜血管生成的影响是否仍有其他机制和分子参与还有待进一步研究。
