主要植物类病斑突变体研究进展及其对小麦相关研究的启示
2022-11-02唐华苹姚琦馥
马 建,李 聪,田 荣,唐华苹,,姚琦馥
(1.四川农业大学小麦研究所,成都 611130;2.铜仁学院农林工程与规划学院/贵州省梵净山地区生物多样性保护与利用重点实验室,贵州 铜仁 554300)
叶片在植物的整个生长发育过程中扮演着重要的作用。在传统育种过程中,叶色突变植株由于具有植株矮小、产量低的特点通常不被育种工作者选择。然而近年来,随着经济技术的高速发展,旅游观光产业的兴起,抗病育种及种质资源多样化的需求,叶色突变体越来越受到研究学者的关注[1-3]。尤其是随着植物生理学和分子生物学研究的不断深入,光合作用[4]、光合色素的合成或降解[5-6]、光形态建成[7]、植物抗病性[8]和细胞程序性死亡[7]等在植物中的调控模式越来越清晰,这些生命过程与植物叶片发育有着千丝万缕的联系。
叶色突变是一种在各种植物中广泛存的突变类型,它的种类有很多,大致可将其分为五类:白化、黄化、浅绿、条纹和斑点[9]。类病斑突变体(lesion mimic mutants)又称为斑点叶突变体(spot leaf mutants),它是指在无病原菌侵染、无机械损伤、无农药伤害及无逆境的环境条件下出现病斑表型的一种特殊的叶色突变体[10-11]。类病斑突变体斑点的产生可能导致叶绿体的超微结构发生变化,降低叶绿素的含量;色素蛋白复合体遭到破坏还阻碍了叶绿体-细胞核之间的信号转导,严重影响到叶绿素的光合作用以及小麦的产量[12-14]。此外,类病斑突变体斑点的产生还可以激发过敏反应(hypersensitive response,HR),产生细胞死亡以限制病原菌的生长和进一步侵染。
此外,类病斑突变体在其他许多方面也存在着潜在的应用前景。目前报道最多的是类病斑突变体目的基因为抗性基因,这些抗性基因的突变或表达异常对病原菌有专一或广谱的抗性[3,15-16]。这为挖掘抗病基因培育抗病品种提供了新途径。类病斑突变体也是研究植株光合通路和物质运输的优良材料。通过了解不同植物的光合途径可以对植株的光合通路进行定向改造,实现人造“叶绿体”、将光呼吸通路转变成碳浓缩途径,为增强光合能力提高生物产量提供了新思路[17-18]。类病斑突变体还是研究植物衰老相关机制的理想材料。衰老相关机制的解析为开发研制除草剂奠定新的理论基础。此外,在转基因植株中,通过将类病斑基因与目的基因紧密连接整合在同一载体上,通过观察后代植株的斑点表型确定目的基因是否存在,这可能在转基因株系中筛选目标株系提供了简便的表型标记。
因此,类病斑突变体不仅在研究植物抗病防卫机制和细胞程序性死亡方面发挥着积极的推动作用,还对探索类病斑突变体的分子机制、丰富类病斑突变体的基因及其功能,为分子设计育种提供可行的分子标记方面具有重要的研究价值。本文主要从以下几个方面对国内外主要植物类病斑突变体的相关研究进行综述,以期望能为小麦类病斑突变体的挖掘、鉴定和应用提供思路。
1 类病斑突变体的起源及命名
20世纪20年代美国科学家在玉米中发现的类病斑突变体可能是在植物中关于类病斑突变体材料的首次报道[19]。之后在其他植物中也相继报道,如1970年日本学者在水稻中也发现了类病斑突变体材料,进一步研究表明该突变体材料是自然突变而来[20]。1993年,德国科学家在筛选大麦抗病材料时发现的类病斑突变体材料可以增强植株的抗病能力[21]。直到二十一世纪初,众多的学者才开始对普通小麦类病斑突变体进行研究报道[22-23]。
这些类病斑突变体材料绝大部分是通过人工诱变获得的,很少部分是自然突变形成的。常用的人工诱变方法包括:物理诱变(γ射线、β射线等)、化学诱变(N-甲基-N-亚硝基脲、甲基磺酸乙酯等)、生物诱变(转座子标签、T-DNA标签插入等)。突变体材料的不同以及突变手段的差异,可能导致植物产生不同的表型特征。水稻作为禾本科的模式作物,根据类病斑发生的时间、形状、颜色或导致植株抗病等来进行命名。其中以spotted leaf(spl)来命名水稻类病斑突变体的数量最多[24-27],其次还有lesion mimic(lm),cell death and resistance to the blast fungus(cdr)[28],faded green leaf(fgl)[29],lesion mimic and senescence(lms)[30]和 sekiguchi lesion(sl)[31]等。在其他植物中类病斑突变体的命名也有差异。例如拟南芥中以lesion initiation[32]或spotted leaf[33]等来命名,玉米中以lesion[34]或lethal leaf spot[35]等来命名,大麦中lesion mimic/necrotic steptoe[36]或necrotic locus[37]等来命名。小麦中类病斑突变体的命名也借鉴了以上植物的命名方式[2],大部分的研究报道以lesion mimic(lm/Lm)来命名[38-40],后来也有以突变体表型命名的方式,如斑点叶基因TaSpl1[41]和TaLSD1[42]等。
2 类病斑突变体的分类和遗传特点
根据类病斑突变体的表型特征及其与细胞程序性死亡的关系,可将突变体分为细胞程序性死亡的抑制途径和激发途径两种类型[43]。
抑制途径所产生的突变体被称为扩展型类病斑突变体(mutant),如在拟南芥中LSD1[44]、ACD2[45]和ACD11[46]等基因突变导致的坏死表型;这种类型的突变体表现为类病斑突变体植株上的某一细胞一旦产生坏死,便迅速扩散到整个植株[47]。
激发途径所产生的突变体被称为起始型突变体(initiation class mutant),如在拟南芥中ACD5[48],LIN2[49]和CPR5[50]等基因突变导致的坏死表型;这种类型突变体的特点为在没有病原菌侵染的情况下,细胞坏死随机自发地产生在植株的叶片、茎和叶鞘等部位。
在粮食作物中,类病斑基因的遗传特点表现为:无论是抑制还是激发途径产生的类病斑突变体,大部分受到细胞核中的单基因控制,也有部分类病斑突变体受到多基因或细胞质基因控制和外界环境的影响。但是这两种类型的类病斑突变体最终都会导致植株的枯萎死亡[51]。
3 类病斑突变体的鉴定和基因克隆
以水稻、玉米、小麦和大麦为代表的粮食作物中,已经有关于类病斑突变体的报道。但是由于染色体组成、基因组大小和参考基因组组装质量的高低,不同物种的类病斑基因的鉴定和克隆研究进展有所差异。
水稻作为禾本科的模式作物。由于水稻基因组较小、公布时间较早,基因组较为完善,并且水稻还具有丰富的突变体,因此水稻中鉴定到的类病斑基因较多,遗传模式和克隆的类病斑基因报道也较多。在水稻的12条染色体上均有发现类病斑基因。目前为止至少鉴定并报道了70多个类病斑突变体/基因。例如:通过调控防御反应和细胞程序性死亡使得叶片出现:褐色坏死斑点的基因OsLSD1[52]和OsPti1a[53];红色类病斑的SPL5[25]和SPL7[54];棕色类病斑的SPL18[24]和SPL32[27];黑褐色类病斑的SPL29[55];橙褐色类病斑的SL[31]基因。这些坏死斑参与了水稻的稻瘟病和白叶枯病的部分抗性。此外,玉米中关于类病斑的研究也有较多报道。如,lls基因通过苯丙氨酸的信号转导途径而使玉米叶片表现出类病斑症状[35]。Nec-t基因与细胞死亡密切相关[56]。ded1突变体在光的作用下使叶绿体的完整性丧失加速细胞的死亡,表现出类病斑症状[57]。依赖于光的显性基因Les22通过编码尿卟啉原脱羧酶来使玉米叶片表现出类病斑症状[34]。类病斑的产生都伴随着细胞的死亡,在抗病基因的挖掘与应用中发挥着重要的作用[58]。如Rp1-D基因在玉米中具有广谱抗锈病的功能[59]。隐性基因lls1可能具有降解细胞死亡的酚类介质的作用而具有较强的抗真菌病原体的能力[1,60]。另外,大麦中也已定位和分离出一些控制类病斑的基因,如含有mlo基因的大麦对白粉病具有广谱抗性而得到广泛应用[3];大麦HIR基因指导的SPRH蛋白不仅参与细胞周期和离子通道的控制,还与细菌膜相关蛋白的控制有关[61];此外还有nec1[37]、Necs1[36]和bspl[62]等类病斑基因的报道。
由于小麦基因组公布较晚且基因组比较庞大,导致小麦分子研究进程较慢且周期较长[63],加上小麦染色体组成较为复杂,ABD染色体组之间可能的复杂相互作用[64],因此关于小麦类病斑基因的精细定位、分子克隆和功能分析的报道较少。目前已经报道的类病斑突变体都是由核基因控制的,但是这些基因的调控通路和分子机理还不是很清晰[23,39-40]。如:HLP突变体的叶片表现出白色斑点,斑点的出现对农艺性状的影响很小并且突变体具有很好的抗叶锈病能力,这对选育抗病品种有重要意义[2]。受隐性基因控制的lm基因被定位到1BL染色体上,含此位点的QTL可以解释60.8%的抗叶锈病表型变异[22]。分别定位在3BS和4AL染色体上的隐性基因lm1和lm2产生的类病斑与光照密切相关[23]。同样受光照强度和光照长度影响的显性基因Lm3被定位到3BL染色体40Mb的区域,进一步发现,类病斑的产生与细胞的程序性死亡和活性氧的异常积累相关,这也增强了小麦的白粉病抗性[38]。Dlm类病斑突变体的转录组分析表明二萜相关应激反应是类病斑表型的间接调节因子,这可能与植株的广谱抗性有关[65]。小麦锌指蛋白TaLSD1基因可能是一种负调控细胞程序性死亡的蛋白,并可以增强小麦对条锈病的抗性[42]。最近研究表明,位于2DS染色体上的显性类病斑基因Lm4可以显著性提高小麦的抗条锈病能力[39]。位于2A染色体长臂上的显性基因Lm5具有条锈病和白粉病抗性,并且斑点的产生受到光照强度的诱导[40]。显性斑点叶基因TaSp1激活防御相关基因导致细胞死亡[42]。此外,茉莉酸和Ca2+信号增强在PCD介导的自发叶片坏死和类病斑形成过程中也有重要的作用[66]。
虽然在小麦中已经报道了一些类病斑突变体基因,但是这些基因大部分只停留在初定位阶段,对于精准地筛选控制斑点叶产生的基因、解析斑点叶性状产生的分子机制和调控机理还存在着诸多疑问,这仍需要研究学者做更加深入的研究工作。值得注意的是,虽然在水稻、玉米和大麦中报道了许多类病斑基因,但是这些基因在同一作物之间是否有等位性以及不同作物之间是否行使相同的功能还有待证明[67]。例如:普通小麦是异源六倍体作物,不仅有四倍体和二倍体种质,还有许多的易位系、代换系和其他小麦族资源。在小麦中发现的水稻或其他作物上鉴定的斑点叶同源基因是否能在小麦中正常地行使功能,其他的冗余基因或A、B、D不同染色体上的同源基因等是否对斑点的形成有影响还有待研究。总之,上述类病斑相关基因的克隆和解析,不仅为小麦类病斑基因的精细定位、克隆和功能分析提供了重要的研究思路和切实可行的研究方法,还对小麦类病斑基因的调控通路和分子机制研究以及斑点叶基因的育种利用奠定了重要的理论基础,部分类病斑基因如表1所示。
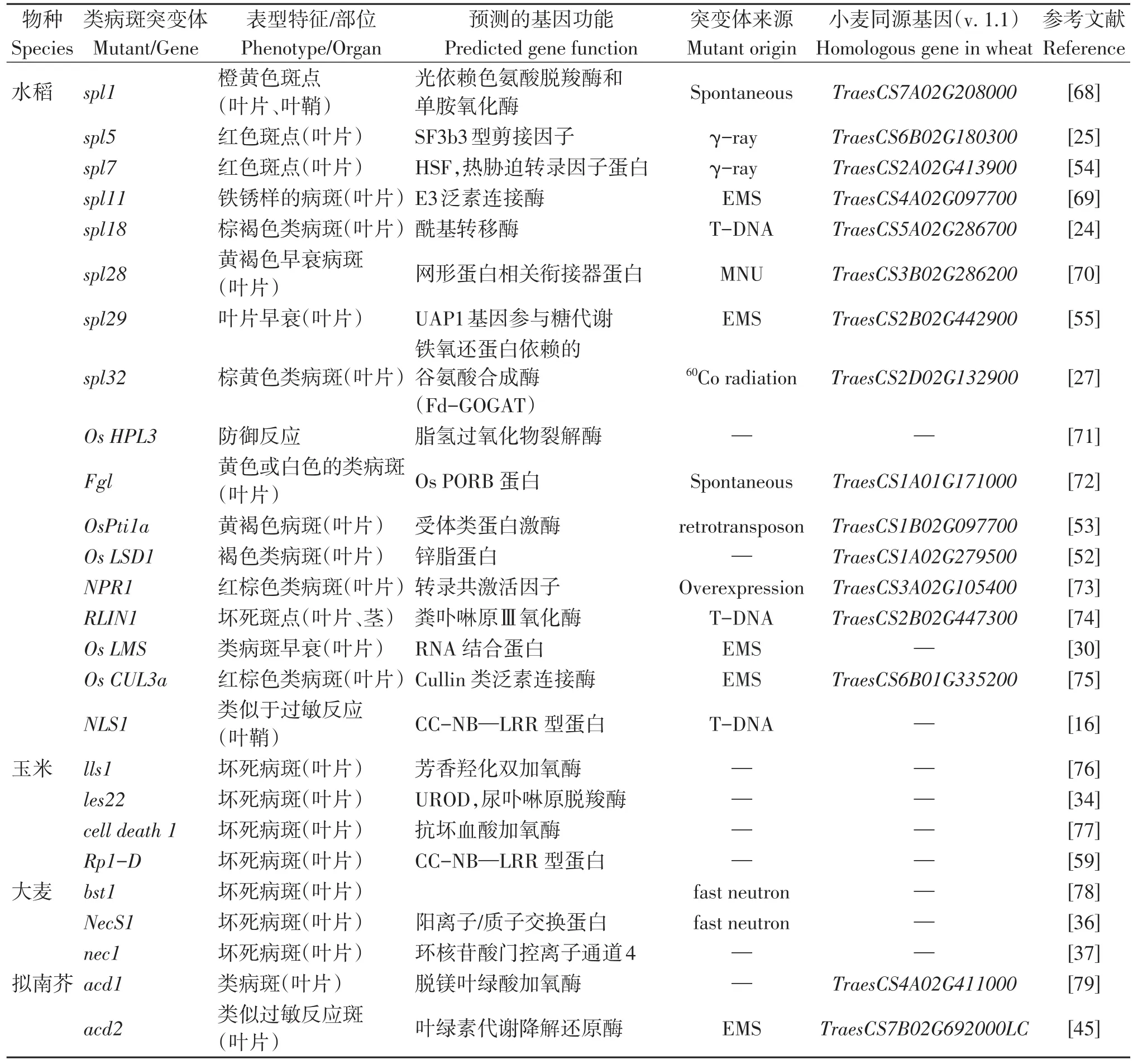
表1 部分植物类病斑相关基因及其小麦同源基因Table 1 Partial genes related to lesion mimic spots in main plants and their orthologs in wheat

(续 表1)
4 类病斑突变体的主要产生机制和抗病性
近年来,随着国内外学者对植物类病斑突变体斑点或坏死形成机制的深入系统研究,报道的类病斑突变体/基因越来越多。基于众多类病斑基因的功能验证和分子机制解析研究结果推测,引发突变体类病斑或坏死形成的原因很复杂,可能主要存在以下几个方面的原因(图1)。

图1 调控类病斑产生的部分途径Figure 1 Several pathways involved in the information of lesion mimic spots
4.1 重要基因的突变或表达异常为主要原因
大部分控制类病斑或坏死斑点形成的基因是抗性基因(R基因),少部分是编码蛋白激酶的基因。抗性基因发生突变或者表达异常可能会引发植物的过敏反应,引起调控防御相关基因的异常表达,从而影响防御信号通路的稳态平衡,最终导致植株产生类病斑或细胞坏死。CC-NB-LRR保守结构域是抗性基因的典型特征。水稻中OsRLR1基因编码的CC-NB-LRR蛋白直接与转录因子OsWRKY19相互作用,转录因子OsWRKY19与CC-NB-LRR蛋白复合体又与抗性基因OsPR10的启动子结合,提高了OsPR10的表达并增强水稻对稻瘟病的抗性[15]。相似地,水稻NLS1基因编码的CC-NB-LRR蛋白发生突变,显著提高了抗性相关基因的表达量,从而导致水稻叶鞘出现类病斑表型[16]。在水稻spl18突变体中,T-DNA激活标签的插入增强了插入位点周围基因的表达,尤其是诱导过敏反应的酰基转移酶序列相似基因OsATL表达水平升高,水稻抗病基因的表达异常导致了类病斑或坏死表型的产生[24]。玉米rp1基因的突变导致了玉米叶片出现类病斑坏死,然而该基因对玉米锈菌具有专一小种抗性,当rp1基因发生突变时,类病斑或坏死也会随之产生[59]。线粒体nad5基因的不同剪切方式增强了植物的抗氰呼吸,破坏了细胞中的线粒体结构,导致病类病斑表型并增强了水稻的抗病性和耐盐性[91]。
然而,小麦中类病斑突变体的报道还处于初始研究阶段,类病斑候选基因的分析还鲜有报道,因此,小麦中类病斑或坏死斑点的产生是否由抗性基因突变导致还不清楚,但是许多的研究发现类病斑或坏死斑点的产生同其他粮食作物一样,会引发细胞的程序性死亡现象并且具有专一或广谱抗性[22-23,38-40]。
4.2 正常代谢途径或合成途径的紊乱
许多的蛋白酶或转录因子等相互作用共同调节着植株的正常生长发育和代谢过程,如果这些关键的蛋白酶或调控因子功能减弱或丧失,会严重影响植株正常的生物合成和代谢平衡,从而可能导致类病斑或坏死斑的产生。
叶绿体是植物的“能量工厂”,叶绿体中的叶绿素在光合作用中扮演着重要角色,因此与叶绿素生物合成相关的关键酶活性改变都可能会引起类病斑或坏死等早衰现象[5,32]。因此,卟啉代谢途径中关键蛋白酶活性的改变都可能会导致植物类病斑或坏死斑的产生。如,水稻中粪卟啉原Ⅲ氧化酶活性降低,直接导致了粪卟啉原Ⅲ在植株内的积累,这进一步影响了叶绿素和血红素等光敏色素的代谢紊乱[74]。在水稻fgl类病斑突变体中筛选到的候选基因编码与原叶绿素酸酯氧化还原酶相关的蛋白。分析发现该基因的第二个外显子发生了移码突变,导致原叶绿素酸酯氧化还原酶B合成的提前终止,进一步导致了叶绿素的代谢紊乱[29]。小麦中,已经定位到的许多类病斑基因(lm1、lm2、Lm3、Lm4和Lm5等)都会引起叶绿素含量的降低[23,38-40]。
除了与叶绿体合成相关途径外,其他重要物质的生物合成和代谢也可能导致类病斑或坏死的形成。脂类物质代谢不仅是植物维持正常生长发育的重要生理过程,其中的脂肪酸和磷脂还是构成细胞膜基本支架的重要组成部分[92]。在脂肪酸合成途径中,脂烯酰基载体蛋白还原酶是该合成途径的关键酶,若脂烯酰基载体蛋白还原酶活性降低或失活,会严重影响脂肪酸的生物合成[93]。水稻中脂肪酸脱氢酶蛋白功能缺失后不仅会导致叶片出现斑点或坏死早衰表型,还会延缓植株的生长发育,此外,在植物的防御相关反应过程中,脂肪酸及其衍生物也具有着重要的作用[94-95]。糖的合成和代谢途径的异常也会导致植物类病斑或坏死斑点的形成。糖代谢过程中尿苷二磷酸乙酰葡糖胺焦磷酸化酶功能失活会诱导叶片的早期衰老和防御反应产生,导致水稻叶片出现类病斑[55]。糖酵解途径过程中,丙酮酸在氧气充足的条件下可以进一步氧化分解生成乙酰辅酶A,然后进入三羧酸循环彻底氧化分解成二氧化碳和水,并释放出大量的能量。三羧酸循途径中的中间产物也可以作为糖异生、脂类和氨基酸合成的重要原料,通过物质之间的相互转化以维持机体的正常运转。因此,三羧酸循环是联系糖类、脂类和氨基酸的关键枢纽,三羧酸循环途径遭到破坏,也可能会导致植物产生斑点或坏死[96]。
4.3 活性氧含量变化和植物激素作用
类病斑或坏死斑点的产生常常伴随着活性氧的迸发或(和)激素含量的变化。活性氧含量的积累,脱落酸、乙烯、水杨酸和茉莉酸等激素含量的增加能够引起植物细胞的程序性死亡,导致斑点或坏死表型的产生。
过度积累的活性氧可以作为毒力因子使脂类过氧化,造成细胞的膜脂氧化损伤,破坏膜的结构引起细胞死亡。小麦类病斑突变体中,Lm3[38]、Lm4[39]和Lm5[40]基因诱导产生的类病斑都伴随着活性氧的积累。拟南芥lsd1突变体超氧阴离子可以诱导细胞程序性死亡产生坏死斑点,当外源施加超氧化物歧化酶时能显著抑制该突变体的细胞死亡现象[97-98]。生长正常的水稻叶片用过氧化氢处理后,叶片上会产生大量的坏死类病斑[99]。但是活性氧是如何直接参与类病斑或坏死斑产生的调控机理尚不清楚。
此外,活性氧还可以作为信号因子激发其他调控途径引起类病斑或细胞死亡。水稻noel类病斑突变体植株中的活性氧含量的过度积累激活了体内的硝酸还原酶,进而导致了一氧化氮的过度积累,从而使植株产生坏死或类病斑表型[100]。活性氧也可以诱导水杨酸和乙烯等植物激素途径,促进植株的衰老死亡,导致坏死斑点产生的同时增强了植株的抗病能力。水杨酸是诱导植株抗病反应的重要信号因子,水稻NLS1突变体过氧化氢和水杨酸含量的大量积累,增强了植株中抗病基因的表达,抗病基因的表达水平增强进一步导致了水稻叶鞘产生了类病斑表型[91]。乙烯可以促进花粉的形成和果实的成熟,研究发现乙烯还参与植物的防御反应,突变体spl3类病斑的产生可能与活性氧和乙烯应答途径受损有关[101]。水稻spl28突变体类病斑部位积累了大量的活性氧、胼胝质和酚类物质,影响了叶片中叶绿素和可溶性糖的含量,增强了稻瘟病和白叶枯病抗性[70]。其他植物激素如茉莉酸的增加、生长素和赤霉素含量的降低以及不同激素之间的相互作用可能也会影响类病斑或坏死现象。
4.4 外界环境因素的影响
光照、温度和湿度等环境因素对植株的生长发育有着重要影响。众所周知,低温可以打破小麦种子的休眠促进萌发[102]、光周期可以影响植株的花期[103-104]、湿度可以影响叶片上气孔的开合[105-106]。然而,一些类病斑或坏死的产生与这些环境因素也有着密切的联系。
目前,在小麦中鉴定到的类病斑突变体/基因斑点表型的出现也会受到环境的影响。在偃展1号与早穗30品系构建的分离群体中,亲本没有斑点表型,而分离群体后代有类病斑表型,并且类病斑的出现受到光照的诱导,这是小麦中首次类病斑的产生受光照影响的报道[23]。此外,较强的光照强度可以促进MC21类病斑突变体坏死斑点的产生;而较低的光强条件下,温度和光周期的改变不会影响斑点或坏死的产生[40]。其他植物中,如水稻的spl24[8]、RLIN1[74]和spl32[27]突变体;拟南芥中lsd1[33]和ACD2[45]突变体的类病斑或坏死斑的产生也会受到光照的诱导。
高温会抑制细胞的正常生理和代谢过程,导致植物的生长发育异常。水稻类病斑坏死基因HES1编码的UDP-N-乙酰氨基葡萄糖焦磷酸化酶在高温条件下可以维持叶绿体的功能正常运行,该基因突变会导致植物对高温的耐受性降低[107]。拟南芥中突变体cpr22类病斑的产生受到湿度的调节,在高湿度条件下该突变体的防御反应受到抑制,而在低湿度条件下防御反应得到增强[108]。不仅如此,除了光照、温度和湿度等环境单独影响类病斑或坏死斑的产生外,也可能多个环境因素相互作用共同影响类病斑或坏死斑的产生。小麦突变体Lm3类病斑的产生受到光照的诱导,但是光照强度和光周期对类病斑的形成具有调节作用[38]。水稻中ell1突变体类病斑的产生受到光照和温度共同调控[109]。突变体spl7在分蘖期至完熟期发生的类病斑表型受到温度和光照的影响[54]。
4.5 其他影响因素
植物细胞中,一些离子也可能参与了防御体系和细胞的程序性死亡过程。K+和Na+可以调节细胞中的水势平衡,维持细胞环境的稳态;当膜上的环核苷酸门控通道功能受损,可能会导致K+和Na+的通透性增加,打破细胞的稳态平衡[109]。Mg2+与原卟啉Ⅸ结合生成单乙烯基原叶绿素酯a,进一步合成叶绿素[110];Ca2+与蛋白质结合形成钙调蛋白,它可以参与免疫调控和生长发育等许多的信号传递过程[66]。这些离子都可以诱导过敏反应产生类病斑或坏死表现。此外,某些转录因子以及泛素化途径也可以导致类病斑的产生[54,87]。
5 小麦类病斑突变体的研究展望
类病斑的产生受到许多因素的影响,斑点的产生机制和调控机理也各不相同。其他作物中已经克隆的类病斑基因较多,研究也较为深入;然而,小麦类病斑基因的研究还处于起始阶段,鉴于类病斑基因的重要作用,结合其他主要植物(主要为水稻)中类病斑的研究进展,未来小麦科研工作者关注的重点主要涉及以下两个方面:
首先是类病斑突变体的鉴定和候选基因的分离和克隆。在植物中类病斑基因可能对病原菌具有较强的抗性。因此类病斑突变体的鉴定在挖掘新的抗病基因方面越来越受到研究学者的关注。小麦类病斑基因的研究进展主要受限于基因组的复杂性、突变体数量和不同亚基因组之间的互作关系。但随着三代测序技术的兴起和转基因技术的不断发展,多倍体植株的遗传转化技术逐渐成熟,候选基因的功能验证将变得快速高效。此外,众多六倍体小麦、四倍体小麦、二倍体小麦和小麦的近缘属种基因组的陆续公布和完善,小麦的研究也将逐渐进入了泛基因组时代。结合转录组、蛋白组、代谢组等组学测序技术和生物信息学分析以及借鉴其他植物(比如水稻、玉米和大麦等)类病斑基因研究的方法和经验将对小麦类病斑突变体的研究进展起到很好的推动作用。
另一方面是类病斑基因的功能分析及其分子调控网络机制解析。类病斑基因可以诱导植株的叶片或其他部位产生坏死斑点,这种特殊的表型对植株的生长发育以及产量提升方面的积极效应并不是十分显著。但是,通过研究类病斑基因的调控机制对进一步了解植物生长发育与细胞凋亡的信号调控、植物抗病性抗逆性防卫基因信号转导等机制具有重要的研究价值。尤其是在类病斑的抗病机理、植物衰老调控和光合作用研究等方面可能会逐渐成为研究的热点。此外,针对部分分子机制和调控通路已经有较为深入研究的类病斑基因,进行新型除草剂或杀虫剂等的研发可能也具有潜在的价值。
