染色体微阵列芯片联合核型分析用于产前诊断价值
2022-11-02韩保良李晓君许晓红李晓婉
韩保良 李晓君 许晓红 李晓婉
1.安徽省六安市金安区妇幼保健院(237000);2.安徽省妇幼保健院
产前诊断是预防胎儿出生缺陷主要措施,目前产前诊断细胞遗传学检测的“金标准”是G显带染色体核型分析[1]。但核型分析仅能对10Mb以上的大片段缺失以及重复进行诊断,存在一定局限性[2]。染色体微阵列分析(CMA)可通过高通量特异性核酸探针对DNA进行全基因组拷贝数变异分析,尤其是对微缺失和微重复具有良好的检出效果[3]。有研究[4-5]显示,CMA与传统核型分析相比具有高通量、高分辨率以及高自动化检测的优势,对50kb以下的缺失及重复更具有显著优势。两种方法联合诊断,可对显微和亚显微水平结构变异进行检测,对提高产前诊断效率和准确性有积极意义[6]。本研究通过对核型分析联合CMA在不同产前诊断指征中的检出效率进行综合评估分析,为临床诊断技术应用提供科学依据。
1 资料与方法
1.1 基本资料
以2017年12月—2020年11月本院行侵入性产前诊断异常的80例产妇临床资料,均行传统染色体核型分析和CMA检测。年龄(29.6±6.3)岁(20~43岁),孕(20.5±2.5)周(19~33周),高龄孕妇(35≥岁)6例;胎儿超声异常27例,其中超声结构畸形9例,软指标异常18例(主要包括颈项透明层NT增厚、侧脑室增宽、鼻骨发育不良、脉络丛囊肿、心室强光斑等);不良孕产史22例,血清学筛查高风险9例,神经管畸形(NIPT)筛查高风险7例,夫妻一方表型/染色体异常或近亲婚配9例。孕产妇均签署知情同意书,本研究经伦理委员会论证通过。
1.2 研究方法
1.2.1样本采集在超声引导下经腹羊膜腔穿刺采集孕妇羊水35ml,其中20ml用作染色体核型分析,15ml用作CMA检测。
1.2.2染色体核型分析对羊水样本双线培养,收获以及制片,行G显带检测,依据人类细胞遗传学国际命名机制[7]分析染色体核型。
1.2.3CMA检测对羊水样本行DNA提取,以PCR方法扩增,反应条件设定为95℃ 5min,95℃ 40s,60℃ 20s,72℃ 15s。随后对羊水DNA进行酶切消化、纯化以及片段化处理,行杂交、标记和洗涤,采用Cytoscan 750K Array微阵列芯片(美国Affymetrix公司)分析羊水DNA,通过公共在线公共数据、本地化数据库和文献报道[8]对染色体异常情况进行分析。
1.2.4观察指标不同产前诊断指征孕妇胎儿的核型和CMA结果比较分析。胎儿CMA、核型异常结果分析。分析胎儿染色体微缺失/微重复等畸变类型。
1.3 统计学方法
数据分析采用SPSS26.0进行。计数资料以(%)表示,诊断一致性采用kappa检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 不同产前诊断指征孕妇胎儿核型和CMA检测
通过对不同产前诊断指征孕妇胎儿的羊水染色体核型和CMA检测结果进行比较,两种方法对产前诊断指征结果的一致性较强(Kappa=0.16,P=0.489)。见表1。
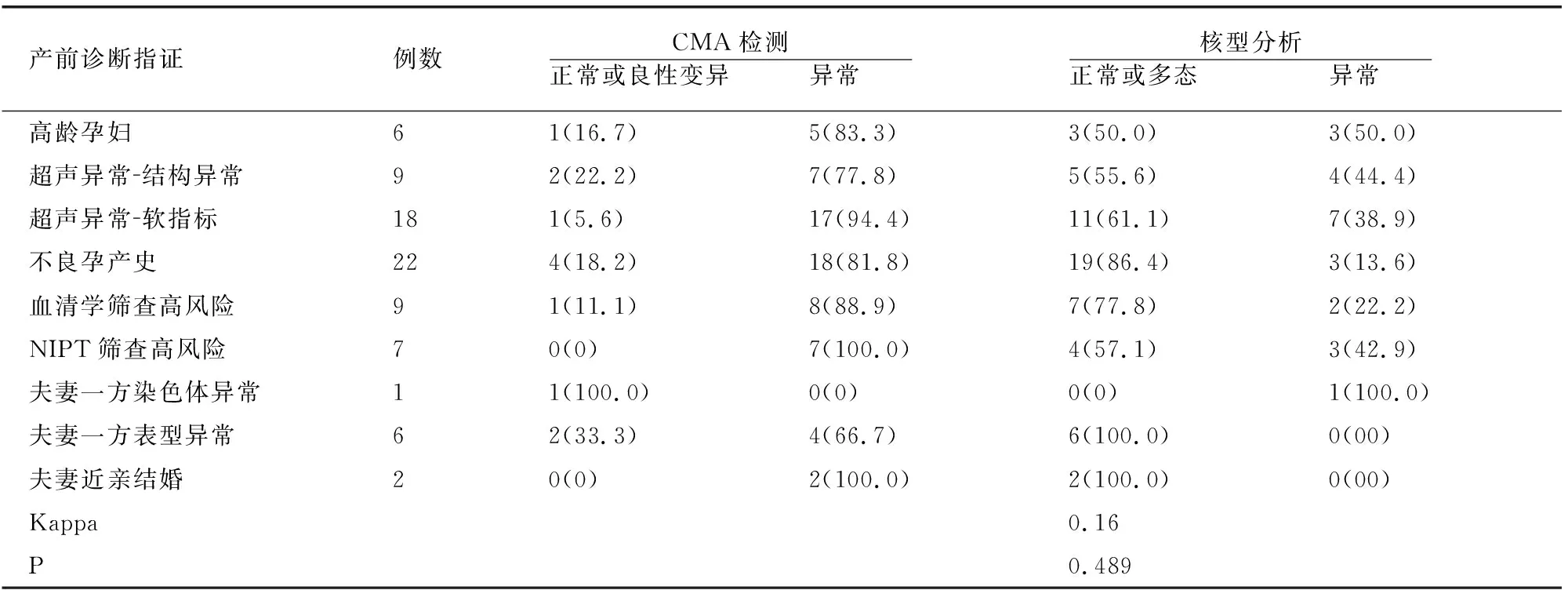
表1 不同产前诊断指征孕妇两种检测结果比较[例(%)]
2.2 胎儿核型与CMA诊断不一致分析
染色体核型分析和CMA检测结果不完全一致共61例,具体见表2。
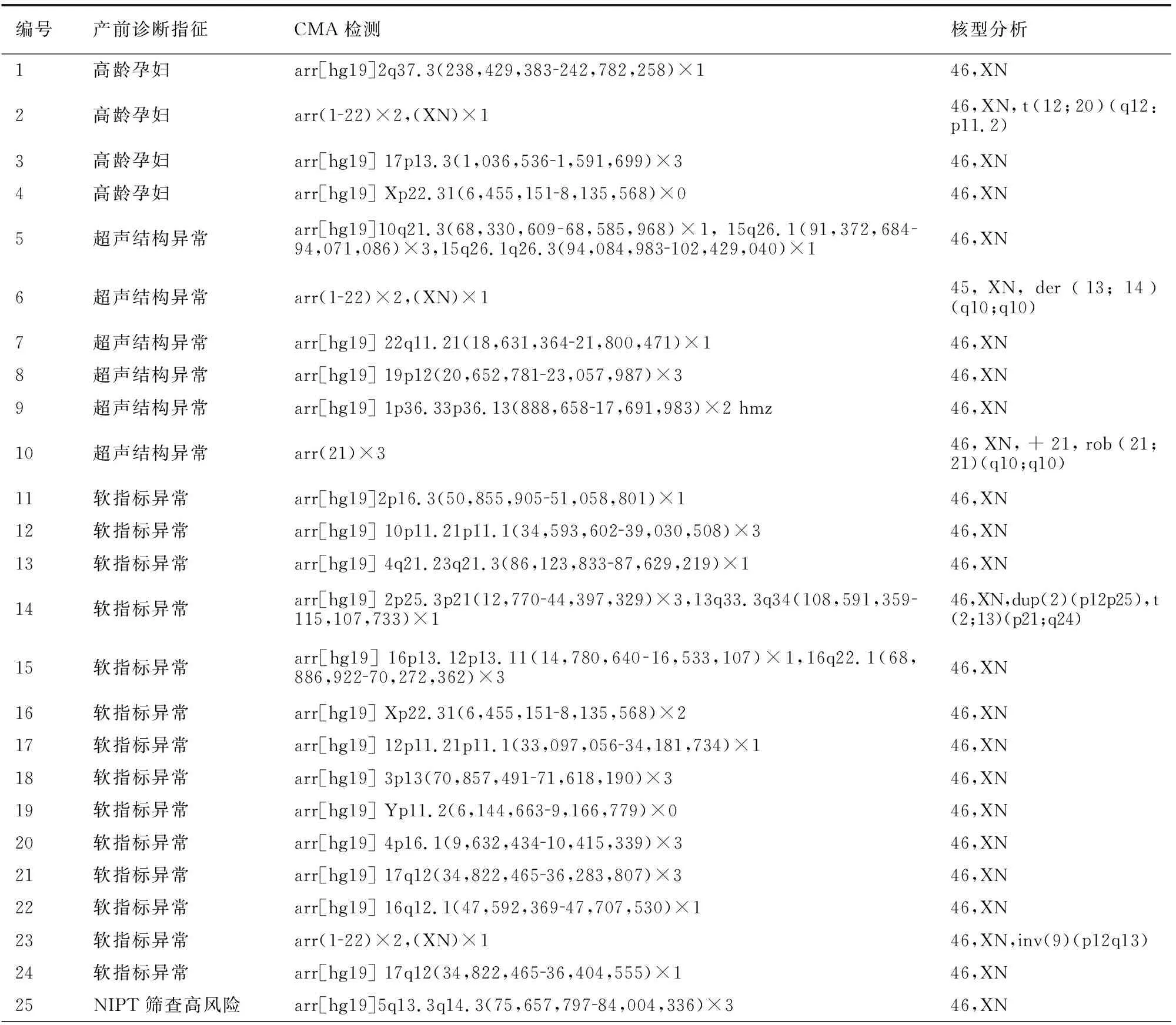
表2 两种诊断方法结果不一致情况分析

编号产前诊断指征CMA检测核型分析26NIPT筛查高风险arr[hg19]5p15.33p14.1(113,57625,370,521)×1,10p15.3p14(100,04711,779,908)×346,XN,5p27NIPT筛查高风险arr[hg19]1q23.1q25.2(159,030,399179,240,081)×346,XN28NIPT筛查高风险arr[hg19] 16p13.11p12.3(15,193,98218,185,466)×146,XN29NIPT筛查高风险arr[hg19] 17p13.3(525447,663)×146,XN30不良孕产史arr[hg19]16p11.2(28,748,00029,032,280)×146,XN31不良孕产史arr(X)×12 hmz,(Y)×1,(8)×2 mos hmz47,XXY32不良孕产史arr[hg19] 6q26(162,562,481163,599,390)×346,XN,15pstk+33不良孕产史arr[hg19] 1q25.3q41(182,780,916216,284,739)×2 hmz,3p22.1p14.3(41,035,35555,050,887)×2 hmz,3q25.1q26.31(149,456,994173,565,119)×2 hmz,6q21q23.2(107,302,808134,504,204)×2 hmz,8q22.3q24.13(102,689,987124,670,101)×2 hmz,15q22.31q26.3(67,090,25698,652,828)×2 hmz46,XN34不良孕产史arr[hg19] 22q13.2(42,925,01943,492,599)×346,XN35不良孕产史arr[hg19] Xq21.31(87,962,17389,102,857)×146,XN,13cen+36不良孕产史arr[hg19] 16p11.2(30,609,03134,011,784)×346,XN37不良孕产史arr[hg19] 22q11.22q11.23(22,997,92823,650,195)×346,XN38不良孕产史arr[hg19] 9q34.3(140,760,572141,018,648)×346,XN39不良孕产史arr[hg19] 22q11.21(18,648,85521,461,017)×346,XN40不良孕产史arr[hg19] 4q31.3(151,450,334151,795,507)×146,XN41不良孕产史arr[hg19] 20p13(1,863,2302,510,438)×346,XN42不良孕产史arr[hg19] Xp22.31(6,449,8368,141,076)×346,XN43不良孕产史arr[hg19] 22q11.21(18,648,85521,800,471)×146,XN44不良孕产史arr[hg19] 15q11.2(22,770,42123,214,655)×146,XN45不良孕产史arr[hg19] 2q13(110,498,141110,980,295)×146,XN46不良孕产史arr[hg19] 11q21q22.1(94,530,942101,022,180)×346,XN47不良孕产史arr[hg19] 8q22.1(97,324,11597,733,799)×346,XN48血清学筛查高风险arr(16)×2346,XN49血清学筛查高风险arr[hg19] Xp22.31(6,455,1518,135,103)×346,XN50血清学筛查高风险arr(X)×1245,X[7]/46,XN[63]51血清学筛查高风险arr[hg19]4p16.3(40521220412)×1;arr[hg19]Xq27.2(140480321140780524)×346,XN52血清学筛查高风险arr[hg19] 22q11.22q11.23(2301040123820302)×346,XN53血清学筛查高风险arr[hg19] Xp22.33(565,967700,044)×146,XN54血清学筛查高风险arr[hg19] 2p24.1p22.3(21,638,96733,001,100)×2 hmz,7q35(146,083,767146,551,861)×146,XN55夫妻近亲结婚arr[hg19] 3p26.1p24.2(8,674,67625,141,279)×2 hmz, 11q23.3q24.3(119,142,812130,747,231)×2 hmz46,XN56夫妻近亲结婚arr[hg19] Xp22.11p21.3(24,306,94724,999,621)×246,XN57夫妻一方表型异常arr[hg19] Xq28(153,543,879153,862,775)×446,XN58夫妻一方表型异常arr[hg19] 12q21.31q21.32(86,490,97087,696,289)×146,XN59夫妻一方表型异常arr[hg19] 17p13.2(3,447,5913,603,469)×146,XN60夫妻一方表型异常arr[hg19] 7q11.23(72,701,09874,154,209)×146,XN61夫妻一方染色体异常arr(122)×2,(XN)×146,XN,rob(13;14)(q10;q10)mat
2.3 CMA正常但核型分析异常分析
分析CMA正常但核型分析异常结果,核型分析额外检出了4例染色体平衡性结构变异。见表3。
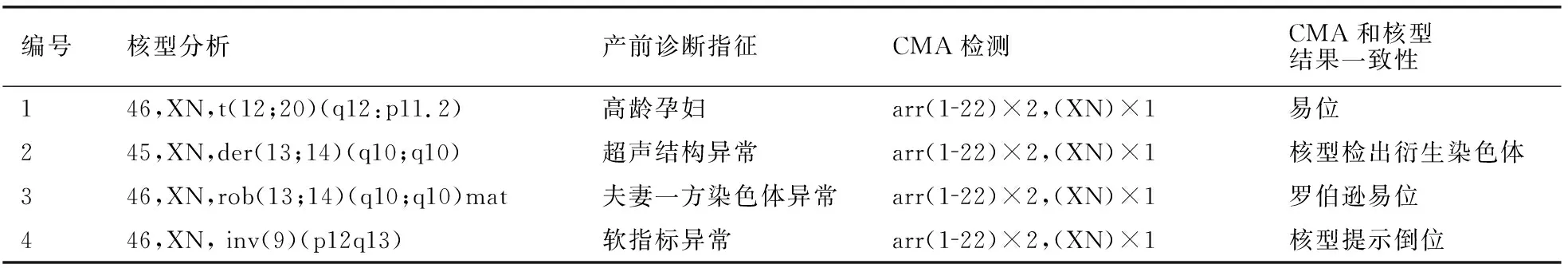
表3 CMA检测正常但核型分析异常结果分析
2.4 核型正常但CMA检测异常胎儿结果分析
分析核型分析正常但CMA检测异常结果,CMA额外发现了49例微缺失/微重复、嵌合体、杂合性缺失/单亲二倍体(LOH/UPD)等。见表4。

表4 核型分析正常CMA检测异常患者情况分析
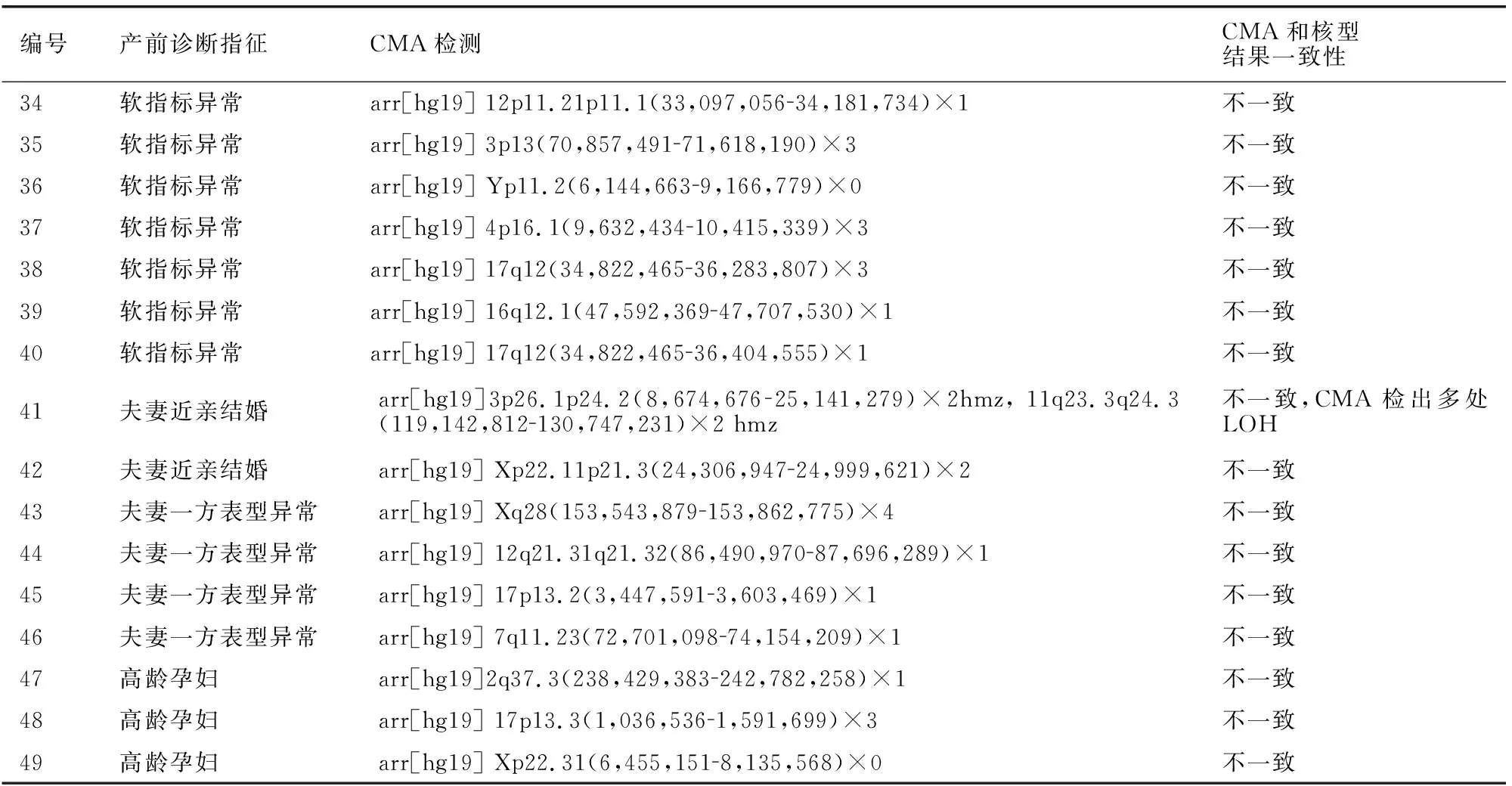
编号产前诊断指征CMA检测 CMA和核型结果一致性34软指标异常arr[hg19] 12p11.21p11.1(33,097,05634,181,734)×1不一致35软指标异常arr[hg19] 3p13(70,857,49171,618,190)×3不一致36软指标异常arr[hg19] Yp11.2(6,144,6639,166,779)×0不一致37软指标异常arr[hg19] 4p16.1(9,632,43410,415,339)×3不一致38软指标异常arr[hg19] 17q12(34,822,46536,283,807)×3不一致39软指标异常arr[hg19] 16q12.1(47,592,36947,707,530)×1不一致40软指标异常arr[hg19] 17q12(34,822,46536,404,555)×1不一致41夫妻近亲结婚arr[hg19]3p26.1p24.2(8,674,67625,141,279)×2hmz, 11q23.3q24.3(119,142,812130,747,231)×2 hmz不一致,CMA检出多处LOH42夫妻近亲结婚arr[hg19] Xp22.11p21.3(24,306,94724,999,621)×2不一致43夫妻一方表型异常arr[hg19] Xq28(153,543,879153,862,775)×4不一致44夫妻一方表型异常arr[hg19] 12q21.31q21.32(86,490,97087,696,289)×1不一致45夫妻一方表型异常arr[hg19] 17p13.2(3,447,5913,603,469)×1不一致46夫妻一方表型异常arr[hg19] 7q11.23(72,701,09874,154,209)×1不一致47高龄孕妇arr[hg19]2q37.3(238,429,383242,782,258)×1不一致48高龄孕妇arr[hg19] 17p13.3(1,036,5361,591,699)×3不一致49高龄孕妇arr[hg19] Xp22.31(6,455,1518,135,568)×0不一致
3 讨论
产前诊断中通过对羊水遗传物质的检测,对胎儿发育异常的诊断灵敏度、准确性显著高于超声筛查[9]。羊水穿刺介入性检查有一定有创性,对产妇会产生一定损伤[10]。羊水细胞是更为理想的产前诊断样本来源,对嵌合的检测敏感性更高[11]。嵌合体的临床表型与异常细胞比例、异常细胞表现出不同临床症状[12]。目前羊水诊断方法主要包括G显带染色体的核型分析和CMA技术,研究显示[13],染色体核型分析主要检测>10Mb以上的大片段结构畸变,并可发现平衡性易位;而CMA可检查>50kb以上的微缺失/微重复,并可识别嵌合体、LOH/UPD等,两者各有优势和局限性,核型分析+CMA联合诊断,检测结果更加准确、精确,避免漏诊风险,对发育异常胎儿的遗传学病因诊断具有重要临床价值[14]。
在本研究中,通过对核型分析联合CMA诊断分析,可以发现两种方法的一致性并不完全一致。在80例中,有19例检测结果一致,余61例检测结果不完全一致。在超声结构及软指标异常27例中,核型和CMA分别检出了11例和24例阳性样本,其中20例结果不完全吻合,在核型正常样本中CMA额外检出15例微缺失/微重复,而在CMA正常样本中核型额外检出1例多态性和2例染色体结构变异;在22例不良孕产史家系中,CMA额外检出15例亚显微结构畸变(如22q11.21微缺失综合征、16p11.2微缺失综合征、Xp22.31微缺失等)、杂合性缺失/单亲二倍体(LOH/UPD)等,核型额外发现4例多态性。在高龄孕妇、血清学筛查高风险、NIPT筛查高风险、夫妻一方表型/染色体异常或近亲婚配等高危因素样本中,二者联合分析也能够检出平衡性畸变、亚显微拷贝数变异、LOH/UPD、嵌合体畸变等。
而在诊断不一致情况分析中,CMA正常而核型分析异常显示,4例胎儿中分别检测出易位、衍生染色体、罗伯逊易位以及倒位;而在对49例核型正常而CMA异常中,除常见的微缺失、微重复综合征外,CMA还额外检出1例低比例嵌合体,2例多处LOH,以及一些临床意义不明变异。分析认为:在对胎儿常规染色体核型分析时,需要细胞培养过程,正常和异常的细胞选择性不对称生长问题,以及因检验人员分析计数误差等,均会造成一部分嵌合体检出率下降,而相比G显带染色体分析,CMA诊断采用的是未进行培养的胎儿细胞,结果更加贴近真实嵌合比例。但CMA检测精度更高,结果更加复杂多变,常检出一些临床意义不明的变异,往往会导致孕妇产生焦虑紧张情绪,严重的甚至会导致终止妊娠,所以通过对两种诊断方法的平行试验,对异常畸变的临床价值评估具有重要的意义。通过上述结果分析可知,核型分析可检测出染色体数目异常以及较大片段的缺失、重复、平衡性重排,CMA可检测出微缺失、微重复、嵌合体、LOH/UPD等,具有超高的灵敏度和特异度,同时CMA技术不依赖于羊水细胞培养,报告时间较短。但CMA也存在无法检测平衡性易位、倒位、罗氏易位等局限性[15]。因此通过核型分析联合CMA综合应用,提高对发育异常胎儿的遗传学病因诊断价值。
综上所述,染色体核型分析与CMA技术联合用于产前诊断,可综合两种诊断方式的优势,取长补短,提高阳性检出率,同时高效检出平衡性畸变、微缺失/微重复、LOH/UPD、低比例嵌合体等,提高异常胎儿的诊断率,明确胎儿遗传学发病因素,为胎儿预后评估及夫妻再生育提供科学依据。
