床旁超声与脉搏指示连续心排血量监测在脓毒症休克患者早期液体复苏治疗中的疗效比较*
2022-11-02张功伟王伟张诗渊张烨王义兵李金
张功伟,王伟,张诗渊,张烨,王义兵,李金
(南昌大学第二附属医院1.急诊科,2.超声科,江西 南昌 341000)
脓毒性休克又称感染性休克,在感染控制不佳特别是合并其他疾病时容易引起休克,是急诊科常见急症,病死率为18.0%~55.7%[1]。以目标为导向的液体疗法是治疗脓毒性休克引起低灌注的一线治疗方法[2-4],但是非洲一些临床研究提示大量补液导致病死率升高[5-6],亦有学者发现早期应用血管收缩药物来减少补液量是有益的[7-8]。因此,如何制定个体化补液量或者补液终点是临床医师面临的一道难题。目前除观察心率、血压等指标外,国内大部分医院的监测手段仍主要停留在中心静脉压(central venous pressure,CVP)监测、脉搏指示剂连续心排血量监测(pulse index continuous cardiac output,PiCCO)。PiCCO 是有创监测,操作风险高、感染风险大。近年来,床旁超声用于监测血流动力学的研究越来越多,本研究将床旁超声和PiCCO 指导脓毒性休克的液体复苏进行对比性研究,以探讨床旁超声指导脓毒性休克液体复苏治疗的临床价值。
1 资料与方法
1.1 临床资料
选取2018年12月—2020年5月在南昌大学第二附属医院急诊重症监护室(intensive care unit,ICU)诊治的脓毒性休克患者30 例,按不同治疗方法分为超声组和PiCCO 组,每组15 例。超声组采用床旁超声指导补液,PiCCO 组采用PiCCO 指导补液。两组患者入院时性别、有无容量反应性、年龄、平均动脉压(mean arterial pressure,MAP)、CVP、氧合指数、乳酸、急性生理学和慢性健康状况评估Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分、脓毒症相关性器官功能衰竭评价(sepsisrelated organ failure assessment,SOFA)评分、基础疾病(高血压、糖尿病、高脂血症)比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者临床资料比较 (n=15)
1.2 排除标准
①体质量指数>35 kg/m2或<18.5kg/m2;②妊娠期女性;③腹腔内高压;④严重循环系统疾病,如持续心律失常、主动脉瓣或肺动脉瓣疾病、二尖瓣狭窄或关闭不全>2 度、心内分流以及心力衰竭等;⑤重症肺炎、肺纤维化等无法获得良好肺部超声影像;⑥抬腿禁忌证,如下肢血栓、骨折;⑦需行主动脉内球囊反搏;⑧不能行股动脉置管;⑨循环休克持续时间>6 h;⑩尿毒症;⑪入院胸片或者CT 提示肺水肿。
1.3 监测方法及指标
患者入院后均进行心电监护,行血液细菌培养,1 h 内予以抗生素治疗。有手术指征的感染,如胆管感染需在入院24 h 内行穿刺引流或内镜下鼻胆管引流术;泌尿道梗阻感染需在24 h 内行外科治疗。入院30 min 内行右侧颈内静脉置管术,监测指标包括:有无容量反应性、MAP、CVP、氧合指数、乳酸、APACHE Ⅱ评分、SOFA 评分、28 d 病死率、住院时间、机械通气时间、补液量、尿量等。APACHE Ⅱ评分是权威危重病评估方法,评分越高表示病情越严重;SOFA 评分可评估器官功能或障碍程度,评分越高表示病情严重,预后越差。
1.4 治疗方法
1.4.1 容量反应性测试两组补液前均进行容量反应性测试,按是否存在容量反应性制订不同的补液方案。两组患者入院后进行被动直腿抬高试验(passive leg raising,PLR)测量容量反应性。两组患者入院后第1~3 天每天早中晚各进行1 次PLR,实验前受试者禁食>2 h 或胃肠减压。超声组患者取半卧位,床头抬高45℃,床尾放平,采用床旁超声获得心尖四腔心切面图像,分别手动勾画右心室和左心室心内膜缘描记面积,得到左心室舒张期容积、左心室收缩期容积,注意将肌小梁、乳头肌和调节束包含在右心室腔内。然后将床头放平,由助手协助抬高患者双下肢45℃。腿抬起后2 min 再行床旁超声,记录上述数据,计算每搏输出量(stroke volume,SV)。SV=左心室舒张期容积-左心室收缩期容积。PiCCO 组通过PiCCO 监控面板得到SV。将SV 在PLR 试验期间升高值(ΔSv)≥10%定义为容量有反应性,<10%定义为容量无反应性,分别进入液体复苏阶段。如患者出现明显气急加重、肺部湿啰音增多或心电图示心肌缺血加重,则立即终止PLR并认定为容量无反应性。
1.4.2 肺部超声探查补液治疗阶段进行肺部超声探查,以指导补液。以患者的胸骨旁线、腋前线、腋后线为界限,将胸廓分为左、右、前、侧胸壁4 个区,每个区再分为上下,共8 个区,在每个区域内滑动3 kMz 超声探头进行扫描。各区从中线开始,将探头的中轴线与骨性胸廓完全垂直(纵轴切面),探头的检查面完全接触皮肤,先向外侧滑行至分界线,返回至中线,再向内侧滑行至分界线,再返回中线。检查过程中如在一个检查区域内出现≥3 条B线(起自于胸膜,随胸膜滑动而运动,呈激光束样高回声,不随距离衰减,具有彗星尾的伪像)则称为B模式;如左右肺同时≥2 个区域B 模式,则表明存在超声肺间质综合征。
1.4.3 液体复苏①容量有反应性患者继续扩容,直至MAP>65 mmHg 和/或尿量>0.5 mL/(kg·h)。若次日再次出现循环波动,并符合试验指征,可再次进行PLR 试验。②容量无反应性患者以出现超声肺间质综合征或PiCCO 血管外肺水>7 mL/kg 作为补液终点。随着监测结果适时调整补液方案,必要时使用连续性肾脏替代治疗、利尿剂等控制出入量平衡。
1.5 统计学方法
数据分析采用SPSS 26.0 统计软件。计数资料以构成比或率(%)表示,比较用χ2检验,计量资料以均数±标准差(±s)表示,比较用t检验或重复测量设计的方差分析;相关性分析用Pearson 法,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者28 d病死率、住院时间、机械通气时间比较
两组患者28 d 病死率、住院时间比较,经t检验,差异无统计学意义(P>0.05);两组患者机械通气时间比较,差异有统计学意义(P<0.05),超声组机械通气时间短于PiCCO 组。见表2。
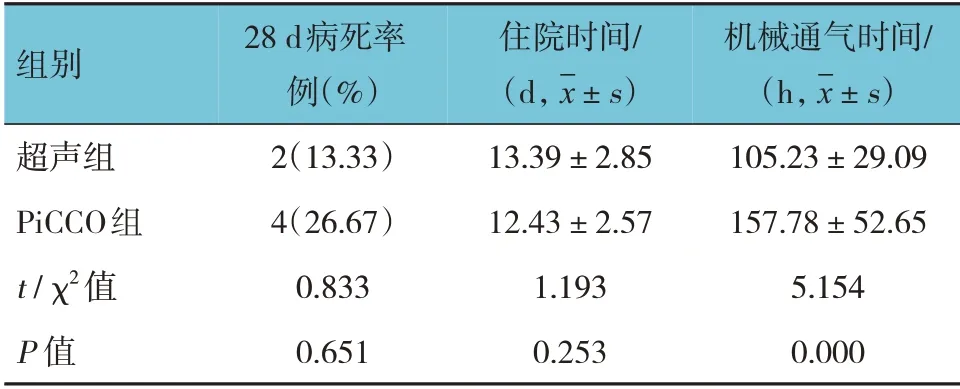
表2 两组患者病死率、住院时间、机械通气时间比较(n=15)
2.2 床旁超声与PiCCO测得SV的相关性分析
床旁超声测得SV 与PiCCO 测得SV 呈正相关(r=0.983,P=0.002)。见图1。
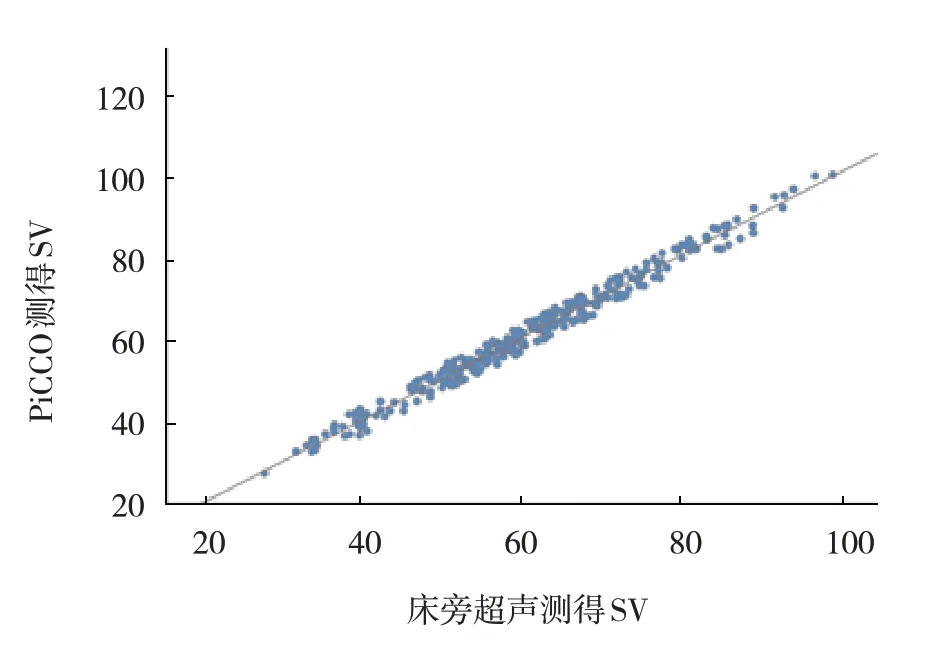
图1 床旁超声与PiCCO测得SV的相关性
2.3 两组患者治疗前后MAP、CVP、氧合指数、乳酸比较
超声组与PiCCO 组治疗前、治疗后6 h 和12 h 测量MAP、CVP、氧合指数、乳酸比较,采用重复测量设计的方差分析,结果:①不同时间点MAP、CVP、氧合指数、乳酸有差异(F=8.596、7.485、10.236 和8.124,均P=0.000);②超声组与PiCCO 组MAP、CVP、氧合指数、乳酸无差异(F=0.567、0.639、0.496 和0.496,P=0.457、0.532、0.375 和0.375);③两组MAP、CVP、氧合指数、乳酸变化趋势有差异(F=5.485、4.125、3.985 和5.452,P=0.015、0.023、0.034 和0.034)。见表3。
表3 两组患者不同时间点MAP、CVP、氧合指数、乳酸比较 (n=15,±s)
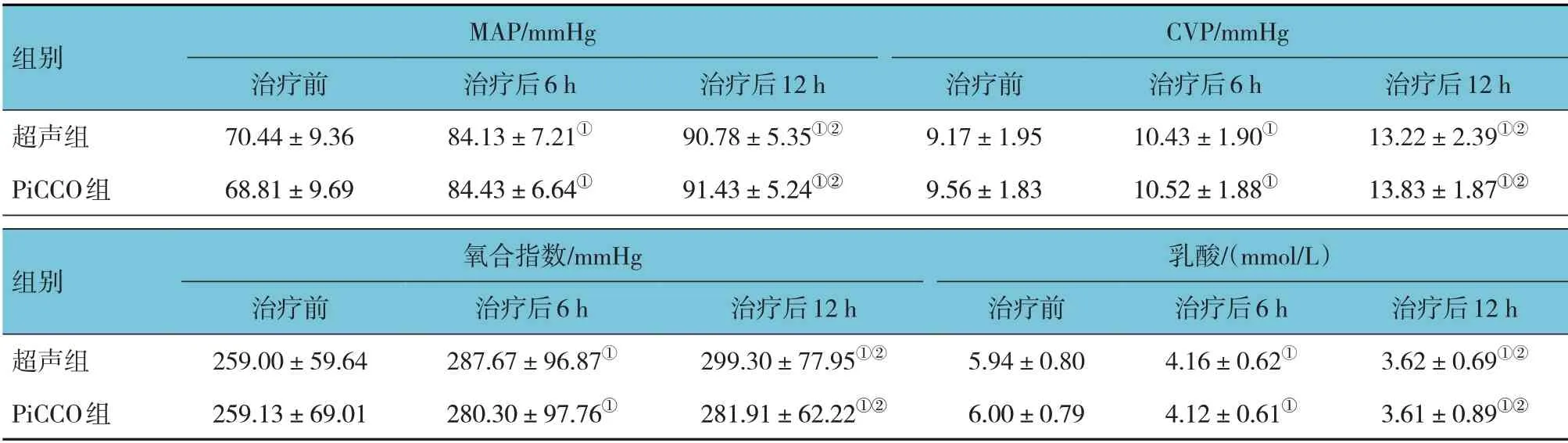
表3 两组患者不同时间点MAP、CVP、氧合指数、乳酸比较 (n=15,±s)
注:①与治疗前比较,P<0.05;②与治疗后6 h比较,P<0.05。
MAP/mmHg CVP/mmHg 组别治疗前70.44±9.36 68.81±9.69超声组PiCCO组治疗后6 h 84.13±7.21①84.43±6.64①治疗后12 h 90.78±5.35①②91.43±5.24①②治疗前9.17±1.95 9.56±1.83治疗后6 h 10.43±1.90①10.52±1.88①治疗后12 h 13.22±2.39①②13.83±1.87①②氧合指数/mmHg 乳酸/(mmol/L)组别超声组PiCCO组治疗后12 h 3.62±0.69①②3.61±0.89①②治疗前259.00±59.64 259.13±69.01治疗后6 h 287.67±96.87①280.30±97.76①治疗后12 h 299.30±77.95①②281.91±62.22①②治疗前5.94±0.80 6.00±0.79治疗后6 h 4.16±0.62①4.12±0.61①
2.4 两组患者治疗后6 h和12 h补液量、尿量比较
超声组与PiCCO 组治疗后6 h 和12 h 补液量比较,经t检验,差异有统计学意义(P<0.05),PiCCO组治疗后6 h 和12 h 补液量少于超声组。超声组与PiCCO 组治疗后6 h 和12 h 尿量比较,差异有统计学意义(P<0.05),PiCCO 组治疗后6 h 和12 h 尿量多于超声组。见表4。
超声组治疗后6 h 与12 h 补液量、尿量比较,经t检验,差异有统计学意义(t=15.987 和8.758,均P=0.000),超声组治疗后12 h 补液量、尿量多于治疗后6 h;PiCCO 组治疗后6 h 与12 h 补液量、尿量比较,差异有统计学意义(t=13.627 和11.390,均P=0.000),PiCCO 组治疗后12 h 补液量、尿量多于治疗后6 h。见表4。
表4 两组患者治疗后6 h和12 h补液量、尿量比较 (n=15,mL,±s)
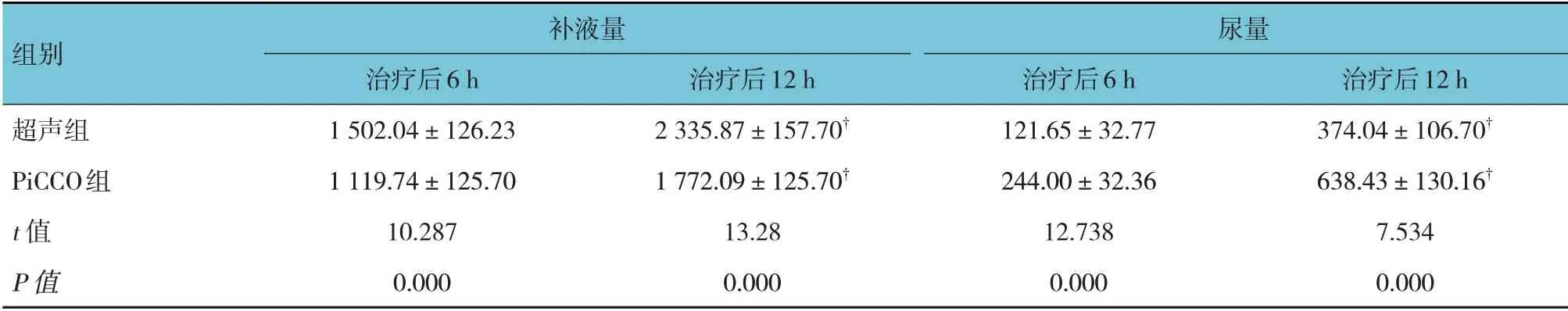
表4 两组患者治疗后6 h和12 h补液量、尿量比较 (n=15,mL,±s)
注:†与治疗后6 h比较,P<0.05。
组别补液量尿量超声组PiCCO组t 值P 值治疗后12 h 374.04±106.70†638.43±130.16†7.534 0.000治疗后6 h 1 502.04±126.23 1 119.74±125.70 10.287 0.000治疗后12 h 2 335.87±157.70†1 772.09±125.70†13.28 0.000治疗后6 h 121.65±32.77 244.00±32.36 12.738 0.000
3 讨论
脓毒性休克是临床常见危重症,多见于感染性疾病引发的综合性全身炎症反应疾病,可导致低血容量,且病情复杂、治疗难度大[9-11]。炎症反应首先诱发心血管细胞功能障碍,然后通过低灌注加重远端组织细胞损伤,导致心肌功能或结构异常、血管内皮细胞的损伤及其他重要脏器损伤,严重威胁患者生命安全[12-13]。
目前,国际上公认的脓毒症休克治疗方案之一为早期液体复苏。脓毒性休克患者微循环障碍导致缺氧加重,血管床持续开放,而扩容补液增加氧气含量,带走代谢产物的同时稀释炎性介质,确保机体重要内脏器官的血流灌注[14-15]。补液也存在一定风险,比如增加心脏做功、血管床非选择性扩张,导致组织内液体蓄积[16];同时补液对血压提升作用缓慢,导致炎症广泛损伤血管,白蛋白及胶体漏出可能引发血管外渗透压升高,反而更容易形成血管外肺水[17]。为避免过度补液,动脉漂浮导管是监测及指导补液的金标准[18],PiCCO 也沿用了此技术,其在限制补液量、减少肺水肿的发生上具有重要意义。近年来,床旁超声在脓毒性休克治疗中的应用也越来越广泛,如GERI 等[19]研究发现经食管心脏超声较常规心脏超声指导脓毒性休克患者液体复苏更佳,同时能够减少儿茶酚胺类升压药和强心药的用量,在预后方面优势更突出;但其缺点也明显,需要超声科医师及时会诊,并不适合基层医院急诊室。另一方面,肺部超声在气胸、胸腔积液、肺炎、肺间质综合征及呼吸困难的病因鉴别诊断方面较X 射线更优[20],与胸部CT 诊断的准确性无明显差异[21];FERRÉ 等[22]研究结果提示,前胸部4 个区域内≤6 个B 线的肺水肿征象与脱机成功率相关。
本研究中PiCCO 组患者28 d 死亡4 例,超声组死亡2 例,两组无差异。本研究中患者死亡时间集中在入院后4~7 d(4 例),早期病死率高于晚期,其中出院未死亡患者1 个月内未报告有明显认知功能障碍。由此可见,脓毒性休克病死率仍较高且无明显下降,主要是因为疾病进展迅速,临床医师往往在纠正患者低血压后才积极行血液净化治疗,但此时行血液净化并不能降低病死率,反而导致不良反应增加[23],而是否在脓毒症早期予以大剂量抗炎药物或血液净化纠正免疫紊乱尚存在较大争议。超声组CVP 低于PiCCO 组,提示床旁超声对容量变化更敏感。本研究结果表明,超声组患者机械通气时间短于PiCCO 组,分析其原因可能为床旁超声可对血流动力学进行持续性、动态性、反复性监测,有助于治疗方案的调整,保证液体复苏治疗达到心血管最佳灌注效果,针对血流动力学特点进行精准液体管理,准确反映心脏功能及肺血管通透性,减少肺水肿等并发症的发生,同时缩短肺水肿导致的机械通气时间。
本研究仅有30 例患者,实验结果可能存在一定偏倚性;另一方面,本研究对不同部位感染引起脓毒性休克未进行分析,且对使用的血管收缩药物类型(儿茶酚胺/非儿茶酚胺类)、用药时机与剂量未有细致的执行标准,而这对患者预后的影响尚不明确。
综上所述,床旁超声与PiCCO 测得SV 一致性较好,两者病死率及ICU 住院时间无差异,但床旁超声能减少肺水肿形成及所致机械通气时间。
