途径工程改造谷氨酸棒杆菌合成L-半胱氨酸
2022-11-02卞金玉张晓梅徐国强史劲松许正宏
卞金玉,张晓梅*,徐国强,史劲松,许正宏
1(江南大学 药学院,江苏 无锡,214122)2(粮食与发酵国家工程实验室(江南大学),江苏 无锡,214122)
L-半胱氨酸(L-cysteine)是一种重要的含硫化合物,属于非必需氨基酸,在大多数生物中,L-半胱氨酸是细胞代谢所需还原硫的唯一来源[1]。L-半胱氨酸除了参与细胞代谢外,在医药,食品和化妆品行业也有重要作用[2-4]。目前主要通过提取法和化学合成法生产L-半胱氨酸[5-7]。然而,这些方法存在过程复杂、产率低等问题[8]。微生物发酵法具有绿色、安全和环保等优点[9],其经济和环境效益也受到越来越多研究者的关注。目前,微生物发酵生产L-半胱氨酸的研究主要集中于大肠杆菌(Escherichiacoli),文献报道大肠杆菌生产L-半胱氨酸的最高产量为8.34 g/L[10]。与大肠杆菌相比,谷氨酸棒杆菌(Corynebacteriumglutamicum)不产内毒素,是食品及药物管理局(Food and Drug Administration,FDA)认可的生产食品和药品安全的(Generally Recognized as Safe,GRAS)微生物[11],但谷氨酸棒杆菌产L-半胱氨酸的研究相对较少[12-14]。
在谷氨酸棒杆菌和大肠杆菌中,合成L-半胱氨酸的前体均为L-丝氨酸。与大肠杆菌不同的是谷氨酸棒杆菌具有直接的硫化途径,而不是通过生物合成L-甲硫氨酸的转硫途径[15]。L-半胱氨酸的合成代谢途径如图1所示,前体L-丝氨酸在L-丝氨酸O-乙酰基转移酶(L-serineO-acetyltransferase,SAT,编码基因cysE)催化下生成O-乙酰基-L-丝氨酸(O-acetyl-L-serine,OAS),然后在OAS巯基化酶-A(OAS sulfhydrylase-A,OASS-A,编码基因cysK)催化下得到L-半胱氨酸。SAT的酶活力受到L-半胱氨酸的反馈抑制,该反应也是L-半胱氨酸合成的关键限速步骤[16-17]。目前在谷氨酸棒杆菌和大肠杆菌中主要采用以下策略提高L-半胱氨酸的产量[18-20]:(1)增强L-半胱氨酸生物合成;(2)弱化L-半胱氨酸降解途径;(3)加强表达L-半胱氨酸转运蛋白。WEI等[18]利用代谢工程策略构建了产L-半胱氨酸的谷氨酸棒杆菌,L-半胱氨酸产量为947.9 mg/L,是目前报道的谷氨酸棒杆菌产L-半胱氨酸的最高产量;然而仍存在产量较低的问题,推测前体L-丝氨酸水平可能是限制L-半胱氨酸生物合成的重要因素。
本课题组前期通过代谢工程改造获得了一株产L-丝氨酸30.57 g/L的谷氨酸棒杆菌A36[21],本文以高产L-丝氨酸的谷氨酸棒杆菌A36为出发菌株,通过加强表达L-半胱氨酸生物合成途径关键酶,敲除L-半胱氨酸降解途径关键酶弱化L-半胱氨酸的降解,强化L-半胱氨酸转运以及优化硫源这4个策略来提高L-半胱氨酸的产量,为L-半胱氨酸高效生物合成奠定基础。

图1 L-半胱氨酸在大肠杆菌和谷氨酸棒杆菌中的生物合成途径Fig.1 L-cysteine biosynthesis pathway in Escherichia coli and Corynebacterium glutamicum注:红色虚线表示本研究中执行的代谢工程步骤; 红色“X”表示目标基因的缺失;红色五星表示反馈抑制的脱敏
1 材料与方法
1.1 材料
1.1.1 菌株、质粒以及主要试剂
本文所用菌株与质粒如表1所示。细菌基因组DNA提取试剂盒、质粒DNA提取试剂盒和DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;EcoR I、XbaI和Hind Ⅲ等限制性内切核酸酶,宝日医生物技术(北京)有限公司。其他试剂,国药集团化学试剂有限公司。

表1 本文涉及的相关菌株和质粒Table 1 Strains and plasmids used in this study
1.1.2 培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10(固体培养基,琼脂粉20)。
种子培养基(g/L):脑心浸液37,葡萄糖20,(NH4)2SO410,MgSO4·7H2O 0.5,K2HPO40.2,NaH2PO40.3。
发酵培养基(g/L):葡萄糖 50,玉米浆 25,(NH4)2SO415,KH2PO40.8,K2HPO41.2,MgSO40.5,MnSO40.01,FeSO40.01,维生素B11,维生素B66,生物素0.2,CaCO320。发酵罐培养基采用氨水和磷酸替换CaCO3。
1.2 实验方法
1.2.1 质粒的构建
组成型加强表达质粒的构建:质粒pDXW-10是大肠杆菌和谷氨酸棒杆菌穿梭型质粒,为组成型表达质粒,可用于外源基因的高效表达,其携带tacM强启动子与Kan抗性标记。以加强表达cysEFr为例,由天霖生物科技(上海)有限公司合成cysEFr基因,cysEFr分别为来自大肠杆菌MG1655的解除反馈抑制的EccysEFr(M201R)以及来自拟南芥的AtcysEFr,目的基因经EcoR I和BglⅡ双酶切后与线性化的质粒pDXW-10连接,构建组成型加强表达质粒。
敲除质粒的构建:aecD基因利用敲除质粒pK 18 mobsacB-ΔaecD进行敲除。以A36基因组为模板,利用同源重组软件设计引物aecD-1/aecD-2和aecD-3/aecD-4,扩增上下游片段。采用EcoR I和XbaI双酶切敲除质粒pK 18 mobsacB,再将上下游同源片段与线性化质粒pK 18 mobsacB连接,构建敲除质粒pK 18 mobsacB-ΔaecD。
1.2.2 发酵方法
摇瓶发酵:吸取适量菌液,于种子平板上三区划线,30 ℃培养3 d,然后挑取单菌落在平板上密集划线,培养3 d。刮取1环菌落接种至20 mL种子液体培养基中,培养12~16 h。待种子液OD562=20~25,按照4%的接种量接种至25 mL发酵培养基中,30 ℃,120 r/min 往复式摇床培养48 h,每隔12 h取样,测定生物量及L-半胱氨酸产量。
5 L发酵罐发酵:取6 mL种子液接种至100 mL种子培养基中,30 ℃,120 r/min往复式摇床培养24 h,待种子液OD562值到达对数生长期,以10%的接种量接种至发酵罐中,在发酵24 h时添加12 g/L的Na2S2O3。在发酵过程中,采用50%氨水和50%磷酸调节pH,使pH保持在7左右,通过自动调节转速和通气量使溶氧(dissolved oxygen,DO)控制在10%左右,每隔12 h取样,测定生物量及L-半胱氨酸产量。
1.2.3 分析方法
生物量的测定:采用紫外分光光度计测定。首先将发酵液振荡混匀,吸取适量发酵液,加入1 mol/L盐酸溶液稀释至适当倍数,利用紫外分光光度计于562nm处测定生物量。
L-半胱氨酸的测定:采用HPLC方法测定发酵液中L-半胱氨酸的含量[22]。
糖的测定:采用西尔曼生物传感器测定发酵液中糖的含量。
2 结果与分析
2.1 强化合成途径对L-半胱氨酸生产的影响
2.1.1 强化合成途径重组菌株的构建
由于SAT是谷氨酸棒杆菌合成L-半胱氨酸重要的限速酶,该酶受到产物L-半胱氨酸的反馈抑制;如要提高L-半胱氨酸的产量,就需解除L-半胱氨酸引起的反馈抑制。目前主要采用以下两种方法获得对反馈抑制不敏感的SAT:(1)通过定点诱变或随机诱变改造SAT;(2)利用高等植物中对反馈抑制不敏感的天然SAT。因此本文选择来自大肠杆菌的cysEFr(M201R),降低L-半胱氨酸反馈抑制的敏感性,使其在谷氨酸棒杆菌中外源表达。另外选择来自拟南芥对反馈抑制不敏感的天然SAT在谷氨酸棒杆菌中进行外源表达。采用1.2.1 方法构建组成型加强表达质粒,选择不同来源的L-半胱氨酸关键酶cysEFr(大肠杆菌EccysEFr和拟南芥AtcysEFr),将目的片段与质粒pDXW-10相连接,构建了质粒pDXW-10-EccysEFr和pDXW-10-AtcysEFr。
在谷氨酸棒杆菌中,OAS在由cysK编码的OAS巯基化酶-A的催化作用下生成L-半胱氨酸,这是L-半胱氨酸合成途径的第二个关键酶,因此在加强表达cysEFr的质粒 pDXW-10-EccysEFr和pDXW-10-AtcysEFr中分别串联表达来源出发菌株A36中的cysK,构建了质粒pDXW-10-EccysEFr-cysK和pDXW-10-AtcysEFr-cysK。将质粒pDXW-10-EccysEFr、pDXW-10-AtcysEFr、pDXW-10-EccysEFr-cysK和pDXW-10-AtcysEFr-cysK电转化A36感受态细胞,挑选转化子,PCR验证质粒是否构建成功,验证结果如图2-a所示,EccysEFr和AtcysEFr基因长度分别为822 bp和945 bp,cysK基因长度为936 bp,PCR条带大小相符;经测序验证序列正确无突变,表明重组菌株S-C-1、S-C-2、S-C-3和S-C-4构建成功。
2.1.2 强化合成途径重组菌株的发酵评价
重组菌株的发酵结果如图2-b所示,S-C-1和S-C-2菌株分别产115.8 mg/L和105.8 mg/L,而出发菌株A36不产L-半胱氨酸。菌株S-C-3和S-C-4L-半胱氨酸的产量分别为95.2 mg/L和36.5 mg/L,与仅表达L-半胱氨酸关键酶cysEFr的菌株S-C-1和S-C-2菌株相比,L-半胱氨酸产量分别下降17.8%和65.5%,说明串联表达cysK并不利于L-半胱氨酸的积累,推测宿主菌株中cysK编码的OASS-A具有一定活性,自身可以维持L-半胱氨酸合成途径畅通,加强表达反而增加菌株负担,不利于重组菌株产L-半胱氨酸。由于加强表达cysK不利于L-半胱氨酸的积累,因此后续研究在菌株S-C-1和S-C-2中进行。

M-DNA Marker;1-原始菌株的PCR产物;2、3-cysEFr基因的PCR产物; 4、5-cysEFr-cysK基因的PCR产物;6、7-cysEFr-bcr基因的PCR产物 a-菌株S-C-1、S-C-2、S-C-3、S-C-4、S-C-5、S-C-6的PCR验证电泳图谱; b-菌株A36、S-C-1、S-C-2、S-C-3、S-C-4的发酵结果图2 加强表达合成途径对L-半胱氨酸生产的影响Fig.2 The effect of enhanced expression synthesis pathway on L-cysteine production
2.2 强化转运系统对L-半胱氨酸生产的影响
2.2.1 强化转运途径重组菌株的构建
胞内积累过多的L-半胱氨酸会对菌株产生毒性,强化L-半胱氨酸转运系统可以促进产物外排,减少L-半胱氨酸对X菌株的毒性,从而提高L-半胱氨酸的产量。因此在S-C-1(加强表达EccysEFr)和S-C-2(加强表达AtcysEFr)两个重组菌株中串联表达L-半胱氨酸转运蛋白Bcr,构建了重组菌株S-C-5和S-C-6。菌株构建的验证结果如图2-a所示,bcr基因长度为1 194 bp,条带大小相符;经测序验证序列正确,表明重组菌株S-C-5和S-C-6构建成功。
2.2.2 强化转运途径重组菌株的发酵评价
重组菌株S-C-5和S-C-6的发酵结果如图3所示,重组菌S-C-5和S-C-6L-半胱氨酸产量分别为253.3 mg/L和216.7 mg/L,与菌株S-C-1和S-C-2相比分别提高了1.2倍和1.0倍。结果表明,加强表达L-半胱氨酸转运可以将更多的L-半胱氨酸运输出胞外,显著提高谷氨酸棒杆菌L-半胱氨酸的产量。
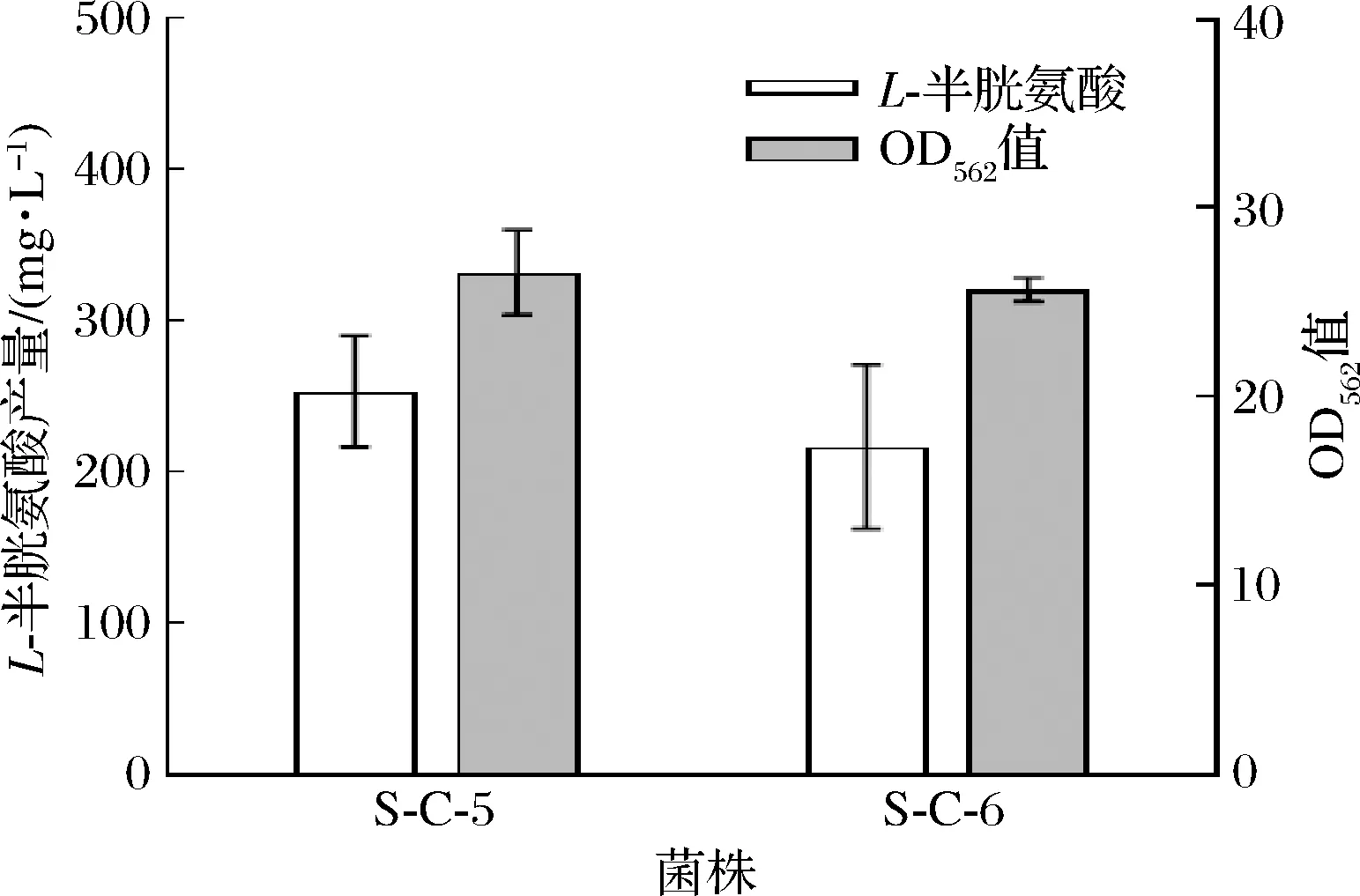
图3 菌株S-C-5和S-C-6的发酵结果Fig.3 The fermentation of strain S-C-5 and S-C-6
2.3 弱化降解途径对L-半胱氨酸生产的影响
2.3.1 弱化降解途径重组菌株的构建
弱化产物降解是进一步提高氨基酸产量的有效方法。L-半胱氨酸的降解主要由L-半胱氨酸脱硫酶(cysteine desulfurase,CD)催化。本文在加强表达合成途径的菌株S-C-1,S-C-2基础上敲除aecD弱化L-半胱氨酸降解。采用1.2.1中的方法构建基因敲除质粒pK 18 mobsacB-ΔaecD,将构建质粒pK 18 mobsacB-ΔaecD电转到A36感受态细胞中,在含Kan的平板上涂布,进行一次同源重组,然后挑选正确的转化子涂布于10%的蔗糖培养基进行二次重组,挑选转化子进行PCR验证,验证如图4-a所示,出发菌株的条带大小约2 000 bp左右,敲除重组菌株的条带大小为1 000 bp左右,表明敲除菌株A36-ΔaecD构建成功。将质粒pDXW-10-EccysEFr、pDXW-10-AtcysEFr、pDXW-10-EccysEFr-bcr和pDXW-10-AtcysEFr-bcr电转化A36-ΔaecD感受态细胞,于30 ℃培养,进行菌落PCR验证,验证结果如图4-b所示,表明重组菌株S-C-7、S-C-8、S-C-9和S-C-10构建成功。
2.3.2 弱化降解途径重组菌株的发酵评价
重组菌株的发酵结果如图4-c所示,与S-C-1(115.8 mg/L)和S-C-2(105.8 mg/L)相比,菌株S-C-7和S-C-8L-半胱氨酸的产量分别提高了1.5倍和1.0倍,说明敲除基因aecD后,可以使更多的碳流流向产物L-半胱氨酸。与S-C-7(286.7 mg/L)和S-C-8(236.7 mg/L)相比,菌株S-C-9和S-C-10的L-半胱氨酸产量并没有提高,甚至S-C-9还下降29.1%,这与WEI等[18]通过代谢改造构建的菌株CYS-13不同,强化L-半胱氨酸合成和转运同时减少其降解并没有进一步提高L-半胱氨酸产量,分析原因可能是采用的底盘细胞不同,文献中采用的底盘细胞为谷氨酸棒杆菌ATCC13032,本文采用的是一株高产L-丝氨酸的谷氨酸棒杆菌A36,底盘细胞对L-半胱氨酸的耐受能力存在差异。为进一步提高L-半胱氨酸的产量,选择构建的重组菌株中产量最高的S-C-7(图5)进行硫源的优化。

M-DNA Marker;1-A36原始菌的PCR产物;2、6-敲除成功aecD 基因后的PCR产物;3~5-未敲除成功aecD基因后的PCR产物; 7、8-cysEFr基因的PCR产物;9、10-cysEFr-bcr基因的PCR产物 a-aecD基因敲除后的PCR验证电泳图谱;b-菌株S-C-7、S-C-8、S-C-9、 S-C-10的PCR验证电泳图谱;c-菌株S-C-7、S-C-8、S-C-9、S-C-10 的发酵结果图4 弱化降解途径对L-半胱氨酸生产的影响Fig.4 The effect of weakening degradation pathway on L-cysteine production
2.4 硫源对重组菌株发酵的影响
2.4.1 不同硫源对重组菌株发酵的影响
L-半胱氨酸是含硫氨基酸,硫源的供给对提高L-半胱氨酸的产量至关重要。首先考察不同的硫源对L-半胱氨酸生产的影响,分别外源添加10 g/L的Na2S2O3、Na2S、Na2SO4和NaHS,以不添加硫源作为对照,发酵结果如图6-a所示,添加不同的硫源均会影响重组菌株的生长和产L-半胱氨酸,其中添加Na2S和NaHS导致重组菌株不再生长。添加Na2S2O3和Na2SO4会在一定程度上抑制重组菌株生长,与对照相比,生物量分别下降18.1%和23.6%,同时L-半胱氨酸的产量均有提高,当以Na2S2O3为硫源时,L-半胱氨酸产量最高,为461.5 mg/L,因此后续选择Na2S2O3作为硫源。

图5 本文构建的重组菌株L-半胱氨酸的产量Fig.5 The production of L-cysteine of the recombinant strain constructed
2.4.2 不同浓度 Na2S2O3对重组菌株发酵的影响
进一步考察Na2S2O3质量浓度(4、6、8、10、12、14、20、30 g/L)对重组菌株生长及产L-半胱氨酸的影响,结果如图6-b所示,随着Na2S2O3浓度的增加,L-半胱氨酸产量逐渐增加,当Na2S2O3质量浓度为12 g/L,L-半胱氨酸产量达到最大,为476.0 mg/L,此后再提高Na2S2O3的浓度,L-半胱氨酸产量不再变化,故选择12 g/L 作为Na2S2O3的最佳浓度。
2.4.3 不同时间添加Na2S2O3对重组菌株发酵的影响
考察不同时间(0、12、24、36 h)添加Na2S2O3对重组菌株生长及产L-半胱氨酸的影响,结果如图6-c所示,在第24 h时添加Na2S2O3,L-半胱氨酸产量达到581.6 mg/L,相对于0 h 添加Na2S2O3,提高了22.2%,说明在菌株生长24 h 时再添加Na2S2O3对重组菌株生长抑制减弱。

a-不同硫源对S-C-7发酵的影响;b-不同浓度Na2S2O3对S-C-7发酵的影响;c-不同时间添加Na2S2O3对S-C-7发酵的影响图6 优化硫源对S-C-7发酵的影响Fig.6 The effect of optimizing sulfur source on S-C-7 fermentation
2.5 重组菌株5 L发酵罐发酵评价
进一步考察重组菌株S-C-7在5 L发酵罐中的发酵性能,从图7可以看出,发酵48 hL-半胱氨酸的产量达到最高,为1.2 g/L,在发酵48 h时发酵液中糖基本消耗完全。与摇瓶条件下的最高产量相比,菌株S-C-7在5 L发酵罐上L-半胱氨酸的产量提高了1.1倍。我们进一步研究显示,在摇瓶条件下,当L-半胱氨酸超过0.5 g/L,即对A36菌株产生毒性(数据未展示),后续可以考虑采用适应性进化来提高底盘细胞A36对L-半胱氨酸的耐受性,从而进一步提高L-半胱氨酸的产量。

图7 重组菌株S-C-7在5 L发酵罐发酵过程曲线Fig.7 The fermentation curve of recombinant strain S-C-7 in 5 L bioreactor
3 结论
本文以实验室保藏的一株高产L-丝氨酸的谷氨酸棒杆菌A36为出发菌株,通过解除L-半胱氨酸对cysE的反馈抑制,增强L-丝氨酸O-乙酰基转移酶和OAS巯基化酶-A的表达,强化L-半胱氨酸的转运系统,并且弱化了L-半胱氨酸的降解,成功构建产L-半胱氨酸的重组菌株;其中菌株S-C-7的L-半胱氨酸产量最高,为286.7 mg/L;进一步对重组菌株S-C-7进行硫源的优化,发现在发酵24 h时添加12 g/L的Na2S2O3,菌株S-C-7的L-半胱氨酸达到581.6 mg/L,较优化前提高了1.0倍。最后在5 L发酵罐对菌株S-C-7进行发酵评价,L-半胱氨酸产量达到1.2 g/L,是目前报道的谷氨酸棒杆菌产L-半胱氨酸的最高产量。
