去氢延胡索素抗膀胱癌的作用机制
2022-11-01刘甜甜黄后宝李亚伟
刘甜甜,张 泽,王 冲,黄后宝,李亚伟
(皖南医学院第一附属医院 弋矶山医院 泌尿外科,安徽 芜湖 241001)
膀胱癌是一种常见的泌尿系统恶性肿瘤,每年新发病例约57万例[1]。虽然膀胱癌的手术方式和治疗手段在近些年有了可喜的进展,然而对于膀胱癌预后的改善却依然没有令人满意的成果[2-3]。外科手术和术后辅以化疗是膀胱癌的主要治疗方法,由于化疗药物的毒副作用和耐药性的产生,使其临床疗效大大降低[4]。因此,寻找新型化疗药物对膀胱癌的治疗和预后尤为重要。
天然产物是抗癌化合物的重要来源,如紫杉醇、喜树碱、长春碱等[5-7]都是直接或间接从天然产物中提取出来的。在各种植物活性化合物中,生物碱的抗癌作用最为显著。去氢延胡索素(Dehydrocorydaline,DHC)是从中药延胡索中分离得到的一种生物碱,具有抗炎、抗癌等功效[8-9]。目前关于DHC的抗肿瘤效应已经有相关报道,但其对膀胱癌细胞的具体生物学功能及其机制研究并不完善。本研究旨在探究DHC对膀胱癌细胞增殖,迁移,侵袭和凋亡能力的影响以及潜在的生物学机制,以探究其是否可作为潜在的抗膀胱癌候选药物。
1 材料和方法
1.1 细胞培养 人膀胱癌细胞系T24、EJ来自于富衡生物科技有限公司(上海)。T24和EJ细胞在RPMI-1640培养基(Gibco,美国)中培养。细胞培养在含有10%胎牛血清和1%青霉素和链霉素双抗的培养基中,置于37℃、5%CO2的恒温培养箱中。
1.2 CCK-8实验 采用CCK-8试剂盒(Yeason,上海)计算DHC的半抑制浓度(half maximal inhibitory concentration,IC50)。T24和EJ细胞(3×103细胞/孔)接种96孔板,细胞贴壁后,不同浓度的DHC(200、100、50、25、0 μmol/L,MCE,上海)添加到96孔板内孵育24、48、72、96 h,然后每孔添加10 μL CCK-8试剂,37℃避光孵育2 h。最后在450 nm处测量光密度(OD)值,计算DHC不同浓度组的生长抑制率=(1-实验孔平均OD值/对照孔平均OD值)×100%,然后用SPSS 26.0计算DHC的IC50值。
1.3 EdU实验 将处理后的膀胱癌细胞(1×104细胞/孔)接种于96孔板。细胞在恒温培养箱中孵育24 h,然后根据EdU试剂盒(锐博,中国)说明书,逐步添加相关试剂。细胞增殖率为EdU阳性细胞与hoechst染色细胞之比。
1.4 划痕实验 将处理后的膀胱癌细胞接种在6孔板中,待细胞长至80%~90%时,用200 μL的枪头垂直划线,PBS洗3次,并加入2%胎牛血清的培养基继续培养24 h,分别于0、24 h拍照。
1.5 Transwell小室迁移和基质胶侵袭实验 将处理后的膀胱癌细胞胰酶消化,无血清培养基重悬,然后每个小室加入2万个细胞,下室加入600 μL完全培养基,24 h后取出小室,经固定、染色后于倒置显微镜下拍照。侵袭实验是在小室内铺一层基质胶,然后加入4万个细胞,后续步骤同迁移实验。
1.6 Annexin V-FITC/PI双染实验 凋亡试剂盒购买于上海贝博生物科技有限公司。收集处理过的T24和EJ细胞,并重悬在1×Annexin V结合液中。经Annexin V-FITC和PI处理后,立即用流式细胞仪(CytoFLEX LX)测定。
1.7 Western blot 用含有1%蛋白酶抑制剂混合物的RIPA裂解液裂解处理细胞,提取的蛋白质经过电泳、转膜,脱脂奶粉封闭,孵育一抗和二抗后,最后用ECL显影。抗体BAX、BCL-2、β-actin和辣根过氧化物酶标记的山羊抗兔抗体购自Cell Signaling Technology(CST,USA)。
2 结果
2.1 DHC抑制膀胱癌细胞增殖 CCK-8法检测5种不同剂量的DHC处理膀胱癌细胞株48 h后的细胞活力,实验结果显示,与对照组0 μmol/L相比,25、50、100、200 μmol/L的T24和EJ细胞活性均降低(F=1 844.864、5 702.594,P<0.01)。根据DHC的不同药物浓度及其对应的药物生长抑制率计算出DHC对T24和EJ细胞的IC50值分别为129.323、150.274 μmol/L,见图1A;后续实验将DHC的IC50值设为140 μmol/L,用140 μmol/L的DHC处理T24和EJ细胞。结果表明,与对照组相比,随着时间的延长,DHC均明显抑制T24和EJ细胞的增殖(P<0.01),见图1B;EdU染色法进一步表明,140 μmol/L的DHC处理细胞后,对膀胱癌细胞有明显的抑制作用,与对照组相比,T24和EJ细胞的EdU阳性细胞比例均下降(t=33.586、44.042,P<0.01),见图1C。

A.CCK-8实验检测不同浓度DHC处理膀胱癌细胞48 h后的细胞活力;B.CCK-8实验检测140 μmol/L DHC处理膀胱癌细胞24、48、72、96 h后的细胞活力;C.EdU实验表明DHC可抑制膀胱癌细胞的增殖。与0 μmol/L或对照组(CTL)比较,**P<0.01。
2.2 DHC抑制膀胱癌细胞迁移和侵袭 采用划痕实验检测细胞迁移能力,结果表明,与对照组相比,DHC处理的T24和EJ细胞均阻断了细胞迁移速度(t=17.709、30.619,P<0.01),见图2A;Transwell迁移实验进一步表明,与对照组相比,DHC处理的T24和EJ细胞均抑制了细胞迁移能力(t=22.079、21.400,P<0.01),见图2B;同样,Transwell侵袭实验证实DHC处理降低了通过基质胶涂层膜的T24和EJ细胞的数量(t=22.419、23.098,P<0.01),见图2B。表明DHC可以抑制膀胱癌细胞的迁移和侵袭。
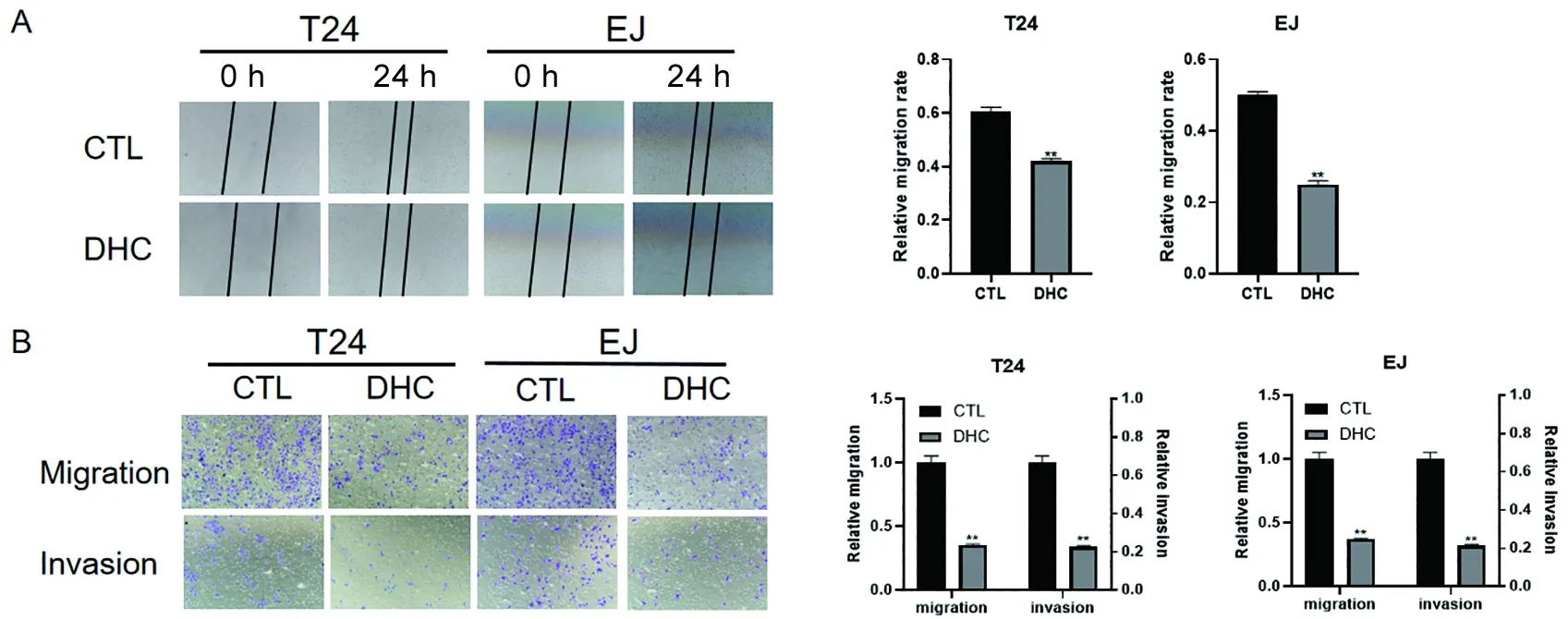
A.划痕实验表明DHC可抑制膀胱癌细胞的迁移;B.Transwell迁移和侵袭实验表明DHC可以抑制膀胱癌细胞的迁移和侵袭。与CTL比较,**P<0.01。
2.3 DHC诱导膀胱癌细胞凋亡 Annexin V-FITC/PI双染实验检测细胞凋亡水平,实验结果表明,与对照组比较,DHC处理后的T24和EJ细胞凋亡率均升高(t=-21.168、-36.406,P<0.01),见图3A;用0、25、50、100、200 μmol/L DHC处理膀胱癌细胞48 h,通过Western blot检测细胞凋亡相关蛋白,与对照组0 μmol/L相比,25、50、100、200 μmol/L的T24和EJ细胞BAX蛋白表达均升高(F=194.941、909.611,P<0,01),而BCL-2蛋白表达下降(F=107.573、454.587,P<0,01),见图3B。表明DHC可以诱导膀胱癌细胞凋亡。

A.Annexin V-FITC/PI双染实验表明细胞经DHC处理后,凋亡率增加;B.Western blot实验用于评估凋亡蛋白的表达。与0 μmol/L或CTL比较,**P<0.01。
3 讨论
目前膀胱癌的治疗方法在延缓肿瘤进展和复发方面效果不甚理想。由于化疗是影响膀胱癌预后的重要因素,在化疗无应答的非肌层浸润性膀胱癌患者中,约66%的患者会进展为肌层浸润性膀胱癌[10]。因此,越来越多的研究者将研究方向转为天然化合物,并且已经成为目前研究的热点。为改善膀胱癌患者预后和提高患者生存率,有必要寻找新的潜在药物和治疗策略。
据报道,DHC具有抗肿瘤作用,对肿瘤细胞的增殖,迁移和侵袭具有抑制作用,有望成为临床上一种新的有效的治疗药物,Huang等通过小鼠体内构建移植瘤和体外细胞实验证明DHC可以抑制乳腺癌MDA-MB-231细胞的增殖[9];Lee等报道了DHC通过抑制基质金属蛋白酶的表达而抑制非小细胞肺癌的转移[11];Hu等报道了DHC通过抑制MEK1/2-ERK1/2级联反应抑制黑色素瘤细胞增殖、迁移和侵袭[12]。然而,DHC在膀胱癌中的作用还没有相关研究,因此,本研究将探讨DHC在膀胱癌中的生物学作用。与上述提到的疾病相似,DHC在膀胱癌中也发挥着抗肿瘤的作用,首先用CCK-8实验检测DHC处理后的膀胱癌细胞的活力,本研究发现DHC对膀胱癌细胞的细胞毒性呈时间依赖性和剂量依赖性,EdU实验进一步证实了DHC可以抑制膀胱癌细胞的增殖。其次通过划痕实验和Transwell迁移实验证实了DHC可以抑制膀胱癌细胞的迁移;Transwell侵袭实验证明了DHC可以抑制膀胱癌细胞的侵袭。多数抗肿瘤药物是通过抑制肿瘤细胞增殖和诱导细胞程序性死亡发挥生物学作用[13],Xu等[14]报道了DHC通过诱导乳腺癌MCF-7细胞凋亡发挥抗肿瘤作用;Huang等报道了乳腺癌细胞经DHC处理后,其凋亡率显著增加[9]。本研究通过Annexin V-FITC/PI双染实验证实DHC处理后,凋亡细胞比例增加。Western blot实验进一步验证了细胞经DHC处理后,其促凋亡蛋白BAX蛋白水平增加,抗凋亡蛋白BCL-2蛋白水平下降。这些结果表明DHC可以抑制膀胱癌细胞的增殖、迁移和侵袭,并诱导其凋亡。
DHC可以抑制多种疾病的进展,Huo等[15]发现DHC通过调节小神经胶质细胞的M1/M2极化减小骨肿瘤的疼痛;Hu等[12]发现DHC通过抑制MAPK通路的相关蛋白(MEK1/2、ERK1/2)的表达进而抑制肿瘤的增殖、迁移和侵袭。本次研究发现,DHC可以调节膀胱癌细胞的增殖、迁移、侵袭和凋亡,但是局限在于其具体机制仍未阐明,且没有进行裸鼠皮下成瘤实验(或原位癌模型)和构建肺转移模型。因此DHC在膀胱癌中是否有更为复杂的调控机制,以及能否在体内抑制膀胱癌的生长和转移需要进一步的研究。
综上所述,DHC可以抑制膀胱癌细胞的增殖、迁移和侵袭,此外,DHC还通过上调BAX蛋白、下调BCL-2蛋白的表达,促进膀胱癌细胞凋亡。以上结果表明DHC有望成为一种有潜在应用价值的膀胱癌治疗药物。
