miR-495-3p在结直肠癌中的表达及其对结直肠癌细胞恶性生物学行为的影响
2022-11-01张洁玲郑惠芬朱益平
张洁玲,郑惠芬,李 凯,朱益平
(皖南医学院第一附属医院 弋矶山医院 肿瘤内科,安徽 芜湖 241001)
结直肠癌(colorectal cancer,CRC)是世界范围内发病率第三的恶性肿瘤,在癌症相关病死率中排第二,仅2018年新增病例1 096 601例,死亡551 269例[1]。在中国CRC发病呈现年轻化趋势[2],患者生存质量的下降和巨额的医疗费用给人类健康和社会发展带来威胁。近年来CRC诊疗手段有了很大提高,但患者的五年生存率仍无明显改善[3],提高对该疾病确切机制的认识、开发新的靶向治疗药物迫在眉睫。
MicroRNAs(miRNAs)是长度约为22个核苷酸的微小非编码RNA,通过结合靶mRNAs的3′-UTR区参与转录后基因表达的调控,导致mRNAs的降解或阻止其翻译,调控着包括癌症在内的许多疾病的发生发展[4]。研究表明,miRNAs在多种癌症中表达失调,失调的miRNAs在肿瘤细胞增殖、凋亡、侵袭和耐药等过程中发挥作用,充当癌症的促癌基因或者抑癌基因。miR-495-3p在多类肿瘤中报道有差异表达,如在食管癌[5]、骨肉瘤[6]、黑色素瘤[7]等中表达下调;Eun等报道miR-495-3p通过调节多种表观遗传修饰因子在胃癌发生过程中发挥抑癌作用[8]。也有报道称miR-495-3p在CRC中受到上游分子NEAT1的调控,在LncRNA促进CRC发展中起桥梁作用[9]。然而几乎没有关于miR-495-3p在CRC中是否存在差异表达的研究。本研究探讨miR-495-3p在CRC组织及细胞中的表达及其对CRC细胞增殖、迁移和凋亡的影响,希望发现CRC诊断治疗的新靶点。
1 材料和方法
1.1 材料 研究所用CRC组织及其癌旁组织均来自于弋矶山医院22位未经过放化疗的CRC患者。在患者签署知情同意书并得到医学委员会和弋矶山医院伦理委员会批准认可后,收集癌灶切除术中肿瘤组织及周围0.5 cm内的正常组织,并立即放入液氮中保存。
1.2 细胞培养 4种人CRC细胞系HT29、SW480、SW620、HCT116和人正常结肠上皮细胞FHC购自中国科学院上海细胞库(中国上海)。细胞完全培养基含10%的胎牛血清(Gibco,美国)及RPMI-1640(Gibco,美国)或DMEM(HyClone,美国)。4种CRC细胞系培养在RPMI-1640的完全培养基,正常结肠上皮细胞FHC培养在DMEM。细胞培养箱的环境在恒温37℃下保持5%的CO2。每1~2 d给予细胞换液或传代等操作。
1.3 RNA提取和实时荧光定量聚合酶链式反应(RT-qPCR) 组织和细胞的RNA按照商家说明书用Trizol(Invitrogen,美国)提取。使用分光光度计NanoDrop 2000 Spectrophotometer(Thermo Fisher,美国)测量RNA浓度后,取2 μL进行逆转录从而得到对应的cDNA(逆转录试剂盒,Takara,中国)。采用茎环法qPCR检测miRNA的表达(qPCR试剂盒,Takara,中国)。实验中所用引物的序列如下:U6上游CTCGCTTCGGCAGCACA,下游AACGCTTCACG-AATTTGCGT;miR-495-3p上游AAACAAACAUGGUGCACUUCUU,下游GAAGUGCACCAUGUUUGU-UUUU。以上引物购自锐博生物(中国广州),其中U6作为miR-495-3p的内参。采用2-ΔΔCt法分析组织或细胞中miR-495-3p的表达情况。
1.4 细胞转染 miR-495-3p模拟物和miR-495-3p阻断剂及各自对照由锐博生物合成。待6孔板中细胞达60%~70%汇合度将原培养基置换为无血清培养基opti-MEM(Gibco),按照厂家说明书使用Lipofectamine 3000 Kit(Invitrogen)进行转染。6 h后将opti-MEM培养基置换为含2%胎牛血清的培养基或完全培养基。转染48 h后收集细胞进行后续实验。
1.5 细胞生存实验(CCK-8) 使用Cell Counting Kit-8试剂盒(KeyGen Biotech Co.,中国南京),分析转染后细胞的生存能力。经过相应转染处理后的HT29和SW480细胞按照每孔1×104个细胞接种在96孔板。在转染后的12、24、36、48、60 h分别向每孔中加入10 μL CCK-8试剂。将细胞继续放回培养箱中孵育2 h后分别测量在450 nm处的吸光度。
1.6 细胞增殖实验(EdU) 转染6 h后将细胞接种至24孔板,待细胞生长至70%~80%汇合度时每孔按照1∶1 000加入EdU试剂孵育2 h,之后对细胞进行固定及染色(EDU细胞增殖试剂盒,Ribo,中国广州),最后用荧光显微镜观察细胞及成像。
1.7 细胞迁移实验(Transwell) 转染24 h后消化细胞,并用无血清RPMI-1640调整浓度为1×105个/mL,取100 μL加入Transwell小室的上室,而在下室中加入含20%血清的RPMI-1640培养基。放回细胞培养箱孵育48 h后,用4%多聚甲醛固定穿膜细胞,0.1%结晶紫染色,并用棉签轻拭掉未穿膜细胞,最后用倒置显微镜观察和成像。
1.8 细胞凋亡实验(流式细胞术) 使用细胞凋亡检测试剂盒(BD Biosciences,美国)检测细胞凋亡率。转染48 h后收集细胞,PBS清洗细胞3遍,适量binding buffer重悬细胞。加入1 μL annexin-V-fluorescein isothiocyanate(FITC)避光染色15 min后,再加入1 μL的 propidium iodide(PI)(每个细胞系都设有FITC单染、PI单染和空白对照来调试画门)。最后使用流式细胞仪检测凋亡率。
2 结果
2.1 miR-495-3p在CRC组织和细胞系中低表达 RT-qPCR结果显示,CRC组织中miR-495-3p水平表达低于癌旁组织(t=4.653,P<0.001;图1A)。与正常肠上皮细胞相比,CRC细胞中miR-495-3p水平表达均降低(P<0.001;图1B)。
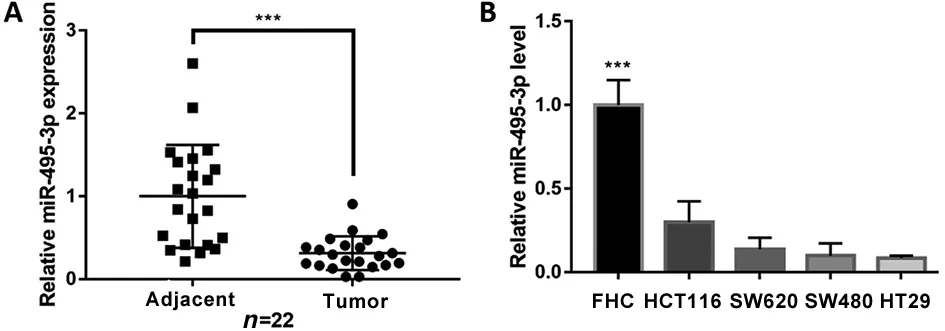
A.RT-qPCR比较CRC组织与癌旁组织中miR-495-3p表达水平;B.RT-qPCR比较CRC细胞与正常肠上皮细胞中miR-495-3p表达水平(FB=46.800,PB<0.001;与正常肠上皮细胞比较,***P<0.001)。
2.2 miR-495-3p抑制CRC细胞的增殖 通过RT-qPCR验证miR-495-3p mimic和inhibitor转染成功(P<0.05;图2),后进行功能实验CCK-8显示,分别在24、36、48、60 h与各自对照组相比,转染miR-495-3p mimic后细胞活力降低,而转染miR-495-3p inhibitor后细胞活力升高(P<0.05;图3)。同时,EDU增殖实验显示,miR-495-3p高表达组增殖细胞减少,miR-495-3p低表达组增殖细胞增多(P<0.05;图4)。以上结果表明miR-495-3p能够抑制CRC细胞的增殖。

HT29:t=6.079、3.845,P<0.05;SW480:t=10.35、5.173,P<0.01。
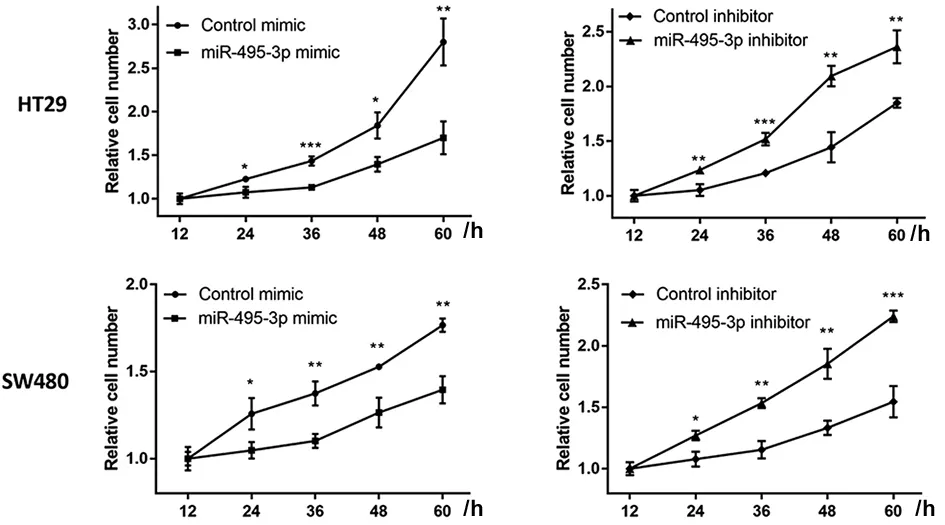
图3 CCK-8检测过表达或敲减miR-495-3p对CRC细胞活力的影响

HT29:t=6.948、2.945,P<0.05;SW480:t=4.831、5.803,P<0.01。
2.3 miR-495-3p抑制CRC细胞的迁移 Transwell实验探究miR-495-3p对CRC细胞迁移的影响。结果显示,过表达miR-495-3p组迁移细胞少于对照组,低表达组迁移细胞高于其对照组(P<0.05;图5),表明miR-495-3p能够抑制CRC细胞的迁移。
2.4 miR-495-3p促进CRC细胞凋亡 流式细胞术检测结果显示,和对照组相比,miR-495-3p mimic组凋亡细胞增多,miR-495-3p inhibitor组凋亡细胞则减少(P<0.01;图6)。说明miR-495-3p能够促进CRC细胞的凋亡。

HT29:t=7.250、5.120,P<0.01;SW480:t=3.670、5.580,P<0.05。

HT29:t=6.066、8.786,P<0.01;SW480:t=5.977、12.890,P<0.01。
3 讨论
miR-495-3p参与调节人体多种病理生理过程。有研究表明miR-495-3p通过靶向IL5RA抑制人髓核细胞炎症和凋亡从而在椎间盘退变中发挥作用[10],也有研究提示miR-495-3p可能与肺功能和慢性阻塞性肺气肿有关[11]。当然,miR-495-3p在癌症中的研究更为广泛,在癌症的发生发展以及耐药方面均发挥作用。研究表明,miR-495-3p的功能缺失或抑制可触发多种致癌表观遗传修饰因子的过表达,从而促进胃上皮细胞的恶性转化和生长[8];Chen等研究发现miR-495-3p通过GRP78/mTOR轴调节自噬来抑制胃癌的多药耐药[12]。但目前很少有研究人员报道miR-495-3p在CRC组织和细胞中的表达以及对CRC细胞的具体作用。
在本研究中,首先使用RT-qPCR检测miR-495-3p在22对CRC组织及其癌旁组织中的表达,结果发现癌组织中的miR-495-3p水平明显低于癌旁组织。同时也检测了4个CRC细胞系和1个正常肠上皮细胞系中miR-495-3p的表达,结果显示CRC细胞中miR-495-3p表达降低。为了进一步探究miR-495-3p对CRC细胞功能的影响,我们使用CCK-8、EdU增殖实验检测了细胞的增殖能力;Transwell实验检测了细胞的迁移能力;流式细胞术检测了细胞的凋亡率。结果发现,过表达miR-495-3p后,CRC细胞的增殖和迁移能力下降、凋亡比例升高;而敲减miR-495-3p后细胞的增殖和迁移能力提高、凋亡比例减少。这些结果提示miR-495-3p在CRC中可能扮演着抑癌基因的角色。
综上所述,我们发现miR-495-3p在CRC组织和细胞中表达下降,且能够抑制CRC细胞的增殖和迁移,促进CRC细胞的凋亡。揭示了miR-495-3p可作为CRC潜在治疗靶点的希望。未来本课题组会在体内验证miR-495-3p在CRC中的抑癌作用,以及探究miR-495-3p发挥作用的具体分子机制和下游通路。
