CA125动力学变化预测新辅助化疗晚期卵巢癌患者满意减瘤临床分析*
2022-11-01李胜霞朱晨辰张安娜颖1
李胜霞,朱晨辰,张安娜,倪 丽,周 颖1,
[1.安徽医科大学附属省立医院,合肥 230001;2.海军安庆医院,安庆 246003;3.中国科学技术大学附属第一医院(安徽省立医院),合肥 230001;4.霍邱县第一人民医院,六安 237400;5.寿县县医院,淮南 232200]
卵巢癌是世界上第六大常见肿瘤,也是女性第五大癌因性死亡的恶性肿瘤。卵巢位于盆腔深部,起病隐匿,早期无明显临床症状,亦缺乏特异性及敏感性均较高的早期筛查诊断方法,故70%的女性在诊断时已为晚期[1]。目前晚期卵巢癌的推荐治疗方法是行初次肿瘤细胞减灭术和术后以铂类为主的辅助化疗,术中能否做到无肉眼病灶残留的满意肿瘤细胞减灭术是患者预后的独立影响因素[2-3]。但是,对于因肿瘤广泛扩散,术前或术中评估无法完成满意减瘤,或本身合并肺栓塞、近期发生心梗、置入支架等基础疾病目前无法进行手术的晚期卵巢癌患者,需先使用新辅助化疗(new adjuvant chemotherapy,NACT)降低肿瘤负荷,给予基础疾病治疗时间,其后再行中间型减瘤手术(interval cytoreductive surgery,IDS)。IDS是初次肿瘤细胞减灭术(primary cytoreductive surgery,PDS)以外的有效补充治疗方法[4]。
无论是PDS还是IDS,能否达到满意减瘤均与患者的预后密切相关[5-6]。对于接受新辅助化疗的患者,亟需寻找一种可确定合适的IDS手术时机并预测手术中可达到满意减瘤效果的简单易行的策略,从而避免不必要的过度新辅助化疗,既可减少化疗耐药性与毒副反应,亦可改善患者预后。近年来,国外研究报道显示,术前CA125下降百分比大于95%可预测中间型减瘤术的满意减瘤[7]。也有研究显示,3次NACT后血CA125水平低于75U/mL可预测满意减瘤[8]。国内亦有相关研究显示,术前CA125≤500U/mL及术前CA125下降幅度≥80%可预测满意减瘤术[9]。基础血CA125水平相对较低,第一次化疗后CA125下降比例更高,CA125半衰期时间更短均与IDS满意减瘤相关[10]。因此,本研究通过分析中国科学技术大学附属第一医院(安徽省立医院)妇产科收治的晚期卵巢癌患者的临床数据,计算多种CA125动力学变化,以确定其对IDS减瘤满意程度的预测价值。
1 材料与方法
1.1 患者资料 回顾分析2018年1月1日至2021年12月31日在中国科学技术大学附属第一医院(安徽省立医院)妇产科治疗的晚期卵巢癌患者。纳入标准:(1)年龄≤80岁;(2)美国麻醉医师协会评分(American Society of Anesthesiologists class,ASA)≤4分,能耐受手术;(3)术前经腹腔镜、经腹或影像学引导下穿刺取活检确诊,或经腹水细胞学确诊的晚期卵巢癌患者;(4)接受以铂类药物为基础的2~4个周期的新辅助化疗,且完成中间型减瘤术及后续辅助化疗,各项资料完整;(5)术后病理证实为卵巢来源的恶性肿瘤。排除标准:(1)新辅助化疗周期≥5次;(2)化疗后CA125升高,疾病进展;(3)新辅助化疗前CA125<200U/mL;(4)研究所需临床信息不完整;(5)未于本中心完成所有治疗疗程;(6)患者或其家属拒绝参与此次研究。筛选出新辅助治疗患者103例,其中8例新辅助周期超过5次,2例化疗后CA125继续上升,4例患者新辅助化疗前CA125<200U/mL,5例未行手术治疗,18例外院化疗资料不全,最终纳入66例患者。
1.2 血清CA125的动力学变化指标 收集患者血清CA125结果,记录新辅助化疗前、每次NACT周期后及IDS前的CA125水平。第一周期CA125下降百分比=(NACT前CA125值-第一周期后CA125值)/NACT前CA125值。第二周期CA125下降百分比=(NACT前CA125值-第二周期后CA125值)/NACT前CA125值。第三周期CA125下降百分比=(NACT前CA125值-第三周期后CA125值)/NACT前CA125值。CA125≤35U/mL为正常范围。
1.3 统计学处理 采用SPSS 20.00软件分析,P<0.05为差异有统计学意义。连续变量表示为平均值(符合正态分布)、中位数(不符合正态分布)和范围,分类变量表示为计数和百分比。对于连续定量变量采用t检验,分类变量采用卡方检验或Fisher精确检验进行组间比较分析。定义R0为无肉眼病灶残留,R1提示残留病灶≤1cm,RX提示残留病灶>1cm。采用logistic回归模型对CA125各种动力学变化与满意减瘤之间进行单因素分析,对单因素分析中P<0.05的所有变量进行多因素分析,并使用bootstrap进行了自助抽样扩大样本量的多因素logistic回归分析。
受试者工作特征曲线(receiver operating characteristic curve,ROC)用于确定CA125的截断值,目的为预测满意减瘤的可能性,曲线下面积为1表明为理想的诊断,0.5表示基本无价值,根据灵敏度+特异度-1计算约登指数,最大值对应点为CA125的截断值。
采用Kaplan-Meier法评估总生存期(overall survival,OS)及无进展生存期(progression-free survival,PFS)。OS定义为从诊断到任何原因导致死亡的时间(存活者按末次随访时间计算);PFS定义为治疗结束至疾病复发(复发指血CA125超过正常上限2倍,或者超过上次随访结果2倍或影像学提示新病灶)。
2 结 果
2.1 患者的临床病理特征 66例卵巢癌患者的平均年龄为58.83岁(34~79岁),86.36%的患者已绝经,14例(21.21%)患者存在肿瘤家族史,4例(6.06%)患者合并其它肿瘤(3例合并乳腺癌,1例合并胃癌)。浆液性癌61例(92.42%),黏液性癌1例,子宫内膜样癌2例,1例患者为混合型癌(高级别浆液性癌+癌肉瘤),1例患者因新辅助化疗,术后病理无法得出详细病理类型;低分化癌60例(90.91%),高分化1例,分化程度未确定5例。中间型减瘤术后,49例患者达R0水平,15例达R1水平,RX患者2例。R0组患者中22例进行基因检测,其中含9例BRCA1突变,5例BRCA2突变,1例HRD(+)。非R0组中6例进行基因检测,其中3例BRCA1突变。R0组与非R0组的临床病理特征见表1,其中,NACT前的CA125中位数R0组为818.80IU/L,非R0组为1802.00IU/L,差异有统计学意义(P=0.011)。R0组与非R0组的围手术期情况见表2。R0组合并高血压(12例)、糖尿病(3例)、慢性肝炎(3例)、脑梗病史(2例)、血栓(3例)。非RO组高血压(5例)、糖尿病(1例)、慢性肝炎(1例)、脑梗病史(2例)、血栓(1例)。新辅助化疗方案均为紫杉醇类+铂类药物,其中R0组新辅助化疗方案紫杉醇+顺铂/卡铂31例,白蛋白紫杉醇+顺铂/卡铂 18例;非R0组新辅助化疗方案紫杉醇+顺铂/卡铂7例,白蛋白紫杉醇+顺铂/卡铂 10例。
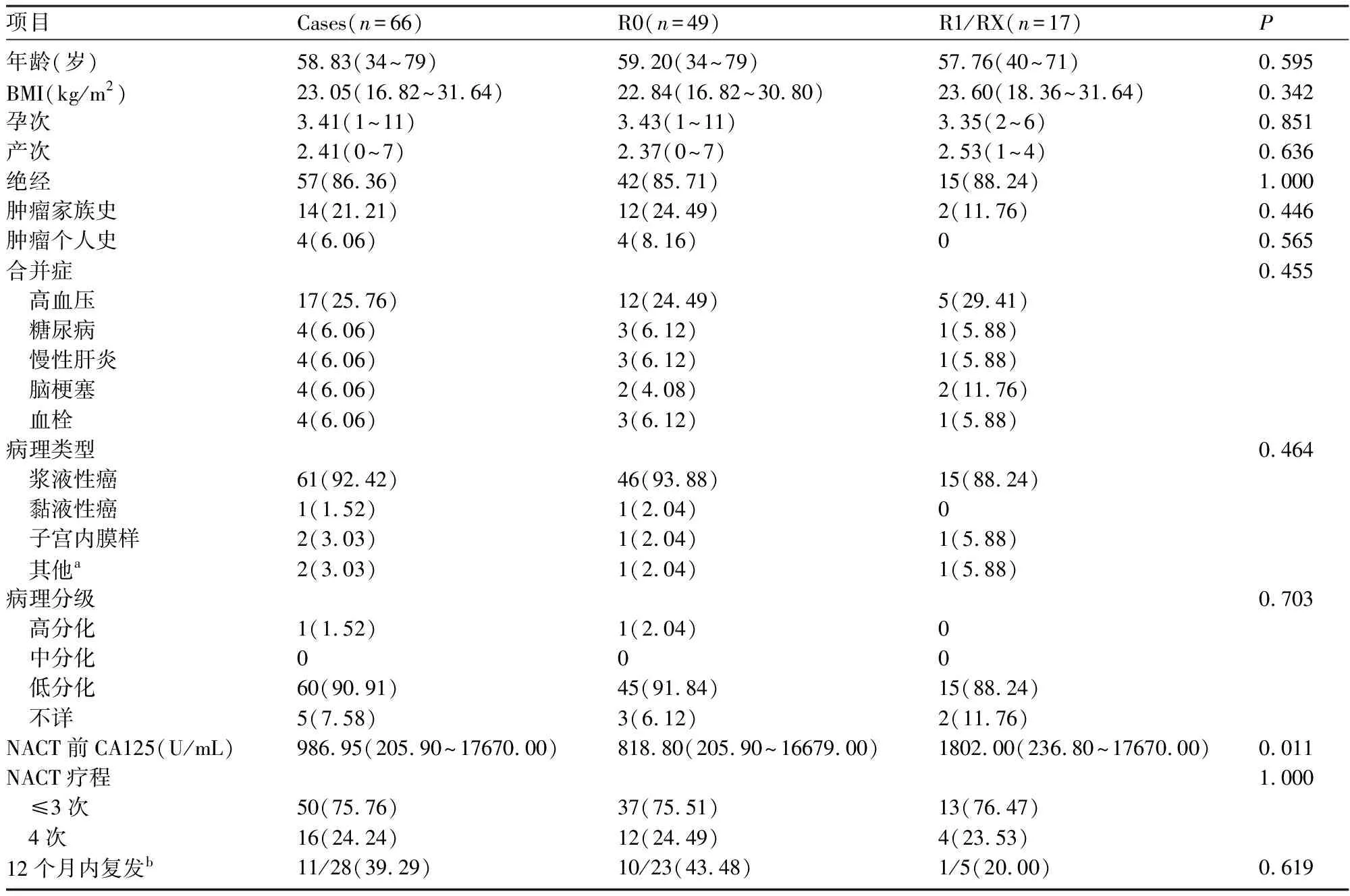
表1 66例新辅助化疗患者临床病理特征[n(%)]

表2 66例新辅助化疗患者中间型肿瘤细胞减灭术围手术期情况[n(%)]
2.2 CA125动力学变化指标与中间型减瘤术满意减瘤的相关性分析 单因素logistic分析结果显示,NACT前CA125、第一次NACT后CA125、第三次NACT后CA125及第一周期后CA125下降百分比可能是满意减瘤的预测因子。将P<0.05的所有指标纳入多因素分析,分析发现第三次NACT后CA125水平和第一周期后CA125下降百分比仍为有效的预测满意减瘤因子(P=0.026,P=0.027),扩大样本量分析后仍有统计学意义(P=0.024,P=0.014)。见表3。绘制ROC曲线发现,第三次NACT后CA125水平预测满意减瘤术具有更高的AUC(AUC=0.688,P=0.029)(图1)。

表3 CA125动力学变化指标与中间型减瘤术满意减瘤相关性的单因素分析与多因素分析
2.3 28例患者的生存分析 随访截止2022年2月,仅纳入随访超过2年的28例患者进行生存结果分析。通过Kaplan-Meier生存分析发现,第一周期后CA125下降百分比≥55.9%组患者的PFS及OS均显著优于第一周期后CA125下降百分比<55.9%组(P=0.001,P=0.046)(图2A、B),而第3次新辅助化疗后CA125水平<33.34U/mL组与≥33.34U/mL组生存预后情况无明显差异(P>0.05)(图2C、D)。
3 讨 论
高龄、基础状态较差、晚期、基础CA125水平高、疾病高负荷状态是卵巢上皮性肿瘤患者选择应用NACT+IDS的标准[11]。满意减瘤术带来的生存效益已得到充分证实,但需行IDS的患者术前预测术中满意性减瘤的方法,目前尚无统一共识。CA125的动力学变化用于满意减瘤的预测被广泛研究。美国的研究发现,IDS前CA125水平正常化是满意减瘤手术的准确预测因子[12]。而一项日本的研究指出,IDS前CA125水平<20U/mL是满意IDS的独立预测因素[13]。法国Pelissier等认为,第三次NACT后的CA125<75U/mL是预测最佳IDS的唯一显著因素,并且其与更高的生存率显著相关[8]。以色列犹太总医院的研究表明,IDS前CA125的正常化能预测满意减瘤手术[14]。四川省肿瘤医院的研究数据也提示IDS前CA125水平正常患者的PFS和OS均显著改善[15]。本研究发现,第一周期后CA125下降百分比及第三周期后CA125水平均可预测满意减瘤术,其中第三周期后CA125<33.34U/mL具有更高的预测价值;第一周期后CA125下降百分比≥55.9%能预测更佳的生存预后。各研究中心对于CA125的动力学变化取值并不相同,这可能与纳入排除标准、CA125检测方法、诊疗水平以及人种间的差异等因素有关,因此对于CA125的动力学变化用于满意减瘤的预测仍需多中心大样本的临床试验进行验证。
亦有学者表示,IDS前的CA125水平以及其它CA125的动力学变化并不是很好的满意减瘤预测因子,其预测满意减瘤的准确性并不是太高[16]。从严格意义上讲,CA125本身在反映PDS或IDS的可切除性方面是有限的,因为其值主要与肿瘤体积相关。所以即使术前CA125水平相同,但病变分布范围不同,是否满意减瘤也有所不同,因为晚期卵巢癌易出现腹腔广泛播散,有的甚至出现弥漫性肠系膜、肠管播散,不同个体病变播散方式不一样可能出现不同的减瘤效果。一个孤立的病灶,即使体积很大,也可以完全切除达到满意减瘤。相反,密集的肠系膜、肠管播散的粟粒样病灶却难以达到满意切除。此外,手术是由什么医疗机构以及手术是由妇科医生还是妇科肿瘤专科医师操作完成,其满意减瘤率也有所不同,因为他们具有不同的经验和技术水平,手术所能做到的范围也不一致,故满意减瘤手术的比率不同。本研究中17例无法做到肉眼无残留的满意减瘤患者均为弥漫性肠管或肠系膜播散病例,非此种病变分布的患者均能通过根治性或超根治手术,包括全子宫双附件切除、大网膜切除为基础手术构成,根据病变情况可能需联合行盆腔腹膜切除、腹腔腹膜切除、膈肌切除、脾脏切除、部分肝脏切除、肠管切除、胆囊切除、部分胰腺切除等上腹部及肠道手术方式,故满意减瘤率较高。
CA125预测满意减瘤有其局限性,部分学者希望通过结合化疗前后影像学下的肿瘤变化,提高预测满意减瘤的准确率。美国纽约凯特琳癌症中心的研究结论显示,计算机断层扫描(CT)是评估肿瘤扩散的标准设备,但对<1cm转移灶敏感性仅为25%~50%,螺旋CT的总敏感性为85%~93%[17]。即使使用多维重建CT,对<1cm转移灶的灵敏度也只有64%[18]。在一项纳入51例患者的结合IDS术前CT评估及CA125水平预测满意减瘤效果的前瞻性研究中[19],发现化疗后CA125<35U/mL以及化疗前后CA125减少百分比>50%在预测满意减瘤方面具有统计学意义(敏感性为64.5%,特异性为70%)。而该研究中CT评估采用Bristow等开发的预测指数模型,易遗漏亚实体疾病,在检测腹膜<1cm疾病以及弥漫性肠壁及肠系膜小病灶方面的敏感性较低,经验证,化疗前后进行CT评估无统计学意义,不能很好地预测满意减瘤。故评估CT扫描在预测满意减瘤中的作用仍需进一步研究。
本研究优点是纳入病例均为新辅助化疗2~4周期的患者,排除了周期大于5次的患者,以避免延长化疗周期对满意减瘤率的干扰。但本研究系回顾性研究,具有一定局限性,包括样本量相对较小及NACT的异质性持续时间。但此次研究依然有利于本中心对于预测中间型减瘤术满意减瘤认识的积累,有待采用更为严格的纳入排除标准以及更大的样本量进行进一步的前瞻性研究,以验证当前的结论。
CA125被作为新辅助化疗反应的预测指标存在一定局限性,但目前除了CA125之外,还没有可靠的生物标志物来识别新辅助化疗后的良好反应者或不良反应者。CA125仍是目前唯一推荐作为诊断或预后指标的肿瘤标志物,同时也是监测化疗疗效和术后疾病复发的指标。本数据表明,在晚期上皮性卵巢癌进行NACT+IDS治疗的患者中,第三次NACT后CA125<33.34U/mL可成为满意性中间型减瘤术的潜在预测因子,而第一周期后CA125下降百分比≥55.9%的患者可获得更优的生存预后。
