拟南芥EPF/EPFL基因对核盘菌抗性的功能分析
2022-11-01黄幼梅柴梦楠席鑫鹏朱文辉齐金岗蔡汉阳
黄幼梅, 柴梦楠, 席鑫鹏, 朱文辉, 齐金岗, 秦 源, 蔡汉阳
(1.福建农林大学生命科学学院;2.福建农林大学农学院,福建 福州 350002)
核盘菌(Sclerotiniasclerotiorum)属于子囊菌门柔膜菌目核盘菌属,是一种典型的死体营养型植物病原真菌,主要通过产生细胞壁降解酶和毒素等方式使寄主细胞致病[1].核盘菌的生态分布广泛,能够寄生400多种植物,尤其对豆科植物、茄科植物和十字花科植物的生长发育造成严重危害[2].在我国东南部地区,核盘菌严重威胁了作物的产量和品质,造成巨大的经济损失[3-4].由于核盘菌破坏性极强,因此,关于植物对核盘菌防御机制的研究具有重要的意义.
表皮模式因子EPF/EPFL(EPIDERMALPATTERNINGFACTOR/EPF-LIKE)基因家族具有11个成员,包括2个EPF(EPF1~2)和9个EPFL(EPFL1~9)基因,这些基因能够编码一类富含半胱氨酸的植物特异性分泌肽[5].通常在EPF/EPFL肽链的碳端具有6个或8个保守的半胱氨酸残基,能够形成分子间二硫键,从而影响肽链的折叠以及蛋白活性[6].迄今为止,部分EPFs基因家族成员的功能已经被揭示.其中,拟南芥EPF1、EPF2和EPFL9(STOMAGEN)在调控植物表皮气孔的形成和发育过程中发挥着重要作用[7].研究表明,EPF1/2和EPFL9的二级结构具有一定的相似性,都由一个环状结构和两个较为保守的β-折叠所组成[8].在气孔发育过程中,这段环状结构决定了每个EPF/EPFL肽的功能特异性.在EPF1和EPF2的环状结构区域中,两个半胱氨酸残基间能够形成额外的二硫键,在叶片气孔发育过程中具有负调控作用,而EPFL9无法形成额外的二硫键,能够正向调控叶片气孔密度,并且对EPF1和EPF2具有拮抗作用[8-10].此外,核磁共振结果显示,EPFL9具有两个反向平行的β-折叠,两个β-折叠之间由3个二硫键以及一个310-螺旋所组成,继而决定了EPFL9的功能[8].
在拟南芥中,类受体蛋白激酶ERECTA(ER)基因家族有3个成员,分别是ER、ERECTA-LIKE1(ERL1)和ERL2,该家族成员之间能以共受体形式在植物生长发育中起着重要的调控作用[11].前人研究表明,细胞表面类受体蛋白激酶ER通过激活丝裂原活化蛋白激酶(MAPK)级联信号通路,促进植物对不同病原体的抗性[12-16].此外,ER类受体蛋白激酶的活性还会受到其配体蛋白表皮模式建成因子EPF/EPFL的调控[15,17].研究表明,EPF/EPFL在调控气孔密度过程中起重要作用,同时也参与其他发育过程,如在植物茎顶端分生组织中,EPFL1、EPFL2、EPFL4和EPFL6具有冗余功能,并激活ER/ERL活性共同调控茎尖分生组织的生长[18].然而,关于EPFL基因在植物免疫中的作用尚不清晰.本实验室前期研究表明,在ER-MPK信号途径中,YDA下游基因YDDs(YDADOWNSTREAMGENEs)在植物对核盘菌的抗性反应过程中发挥着重要的作用[19].为了研究EPF/EPFL分泌肽在植物免疫反应中的作用,本研究通过实时荧光定量PCR检测、核盘菌接种和二氨基联苯胺(diaminobenzidine, DAB)染色,揭示了EPFL1、EPFL2、EPFL4和EPFL6通过激活YDDs基因的表达从而在植物对病原菌的防御反应中发挥作用,为EPF/EPFL基因在植物免疫中的作用机制研究提供依据.
1 材料与方法
1.1 材料
供试核盘菌由福建农林大学海峡联合研究院基因组中心提供.
供试材料为野生型拟南芥(Col-0,用WT表示,由本实验室保存)和epfl1,2,4,6四突变体拟南芥(由美国田纳西大学Elena D. Shpak教授惠赠[18]).将拟南芥播种于1/2MS培养基上,置于温度22 ℃、空气湿度70%、光照强度50 μmol·m-2·s-1、光周期为光照∶黑暗=16 h∶8 h的温室中培养,萌发后将幼苗移植至营养土中培养,30 d后进行核盘菌接种处理.
1.2 方法
1.2.1 核盘菌接种处理 取长、宽均为90 mm的方形培养皿,在其底部放置大小相近的滤纸,加入适量的水将滤纸浸湿.选取大小相近、表面平整的拟南芥叶片,将其平铺于滤纸上,在叶脉处放置灭菌棉条,用移液枪吸取适当的水将棉条浸湿,保持叶片湿润.取直径约为2.5 mm的核盘菌菌块,置于拟南芥叶片上,放置温室中处理36 h后测量病斑面积并进行拍照记录.
1.2.2 DAB染色 接菌处理后,使用1 mg·mL-1DAB对叶片进行染色,避光处理8 h后转移至75%乙醇中煮沸10 min进行脱色,晾干后进行拍照记录.
1.2.3 RNA提取与cDNA合成 采用RNA提取试剂盒OMEGA Plant RNA Kit(广州飞扬生物工程有限公司)提取拟南芥叶片的RNA,使用Superscript Ⅳ试剂盒(北京全式金生物技术有限公司)进行反转录,具体操作步骤参照试剂盒说明书进行,合成的cDNA置于-20 ℃保存备用.
1.2.4 实时荧光定量PCR检测 实时荧光定量PCR检测采用试剂盒Taq Pro Universal SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司),在Bio-Rad CFX384 Touch荧光定量PCR仪(上海土森视觉科技有限公司)上运行.荧光定量PCR反应程序设置为:95 ℃,30 s;95 ℃,5 s,60℃,34 s,40个循环;95℃,15 s.本研究选取拟南芥HK2基因(基因ID:AT4G26410)作为内参基因[19-20],其他引物序列如表1所示.采用2-ΔΔCt方法对荧光定量PCR数据进行分析,呈现的数据来自3个生物学重复样本的平均值.
2 结果与分析
2.1 EPF/EPFL基因在植物免疫过程中的表达
为了研究EPF/EPFL基因家族是否参与核盘菌的响应过程,采用实时荧光定量PCR检测拟南芥11个EPF/EPFL基因成员在WT接种核盘菌后不同时间点的表达水平.结果(图1)显示,接种核盘菌后,EPFL1、EPFL2、EPFL3、EPFL4、EPFL5、EPFL6和EPFL9的表达量都有显著的上调.其中,EPFL1、EPFL2、EPFL3、EPFL4和EPFL6在接种核盘菌12~48 h时均能持续上调表达;EPFL5在接种核盘菌48 h时才有明显的上调表达,而在接种核盘菌12和24 h时的表达量没有明显的变化;EPFL9在接种核盘菌12 h有下调表达的趋势,然而在接种核盘菌24和48 h时则出现显著的上调表达.这些结果表明,EPFL1、EPFL2、EPFL3、EPFL4、EPFL5、EPFL6和EPFL9可能在植物对核盘菌的防御反应中发挥作用.
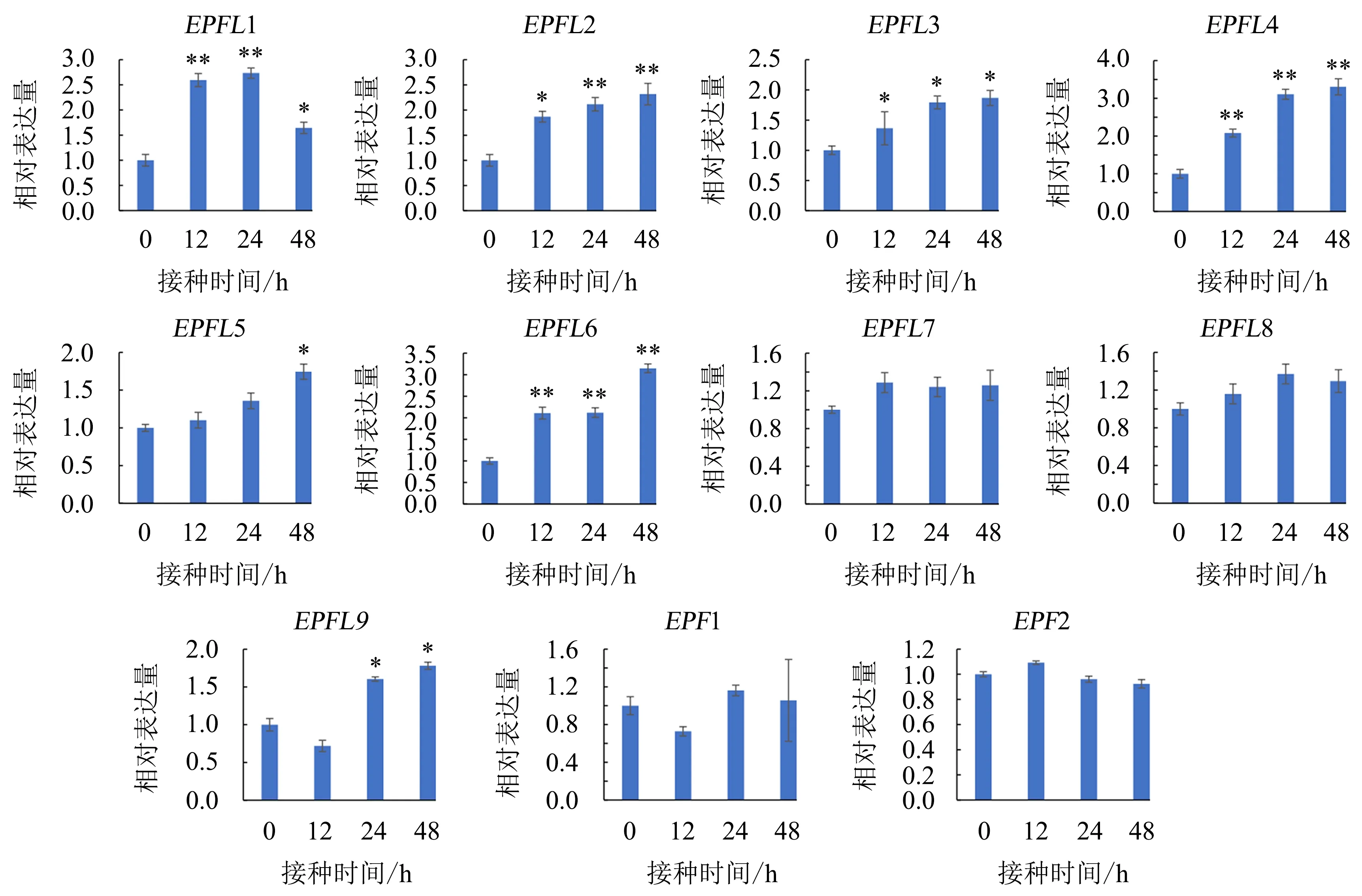
误差线表示±标准差(n=3);显著性差异分析采用t检验法;*表示差异显著(P<0.05),**表示差异极显著(P<0.01).图1 EPF/EPFL基因在拟南芥接种核盘菌后不同时间点的表达量Fig.1 Expressions of EPF/EPFL genes in Arabidopsis leaves at different time points after S.sclerotiorum inoculation
2.2 EPFL1、EPFL2、EPFL4和EPFL6的抗病性
为了进一步验证EPFL1、EPFL2、EPFL3、EPFL4、EPFL5、EPFL6和EPFL9是否在植物免疫中发挥作用,对苗龄为30 d的WT和epfl1、epfl2、epfl3、epfl4、epfl5、epfl6、epfl9拟南芥单突变体进行核盘菌接种处理.结果显示,与WT相比,epfl1、epfl2、epfl3、epfl4、epfl5、epfl6和epfl9单突变体叶片的病斑大小没有明显差异(图2A).DAB染色显示,WT中H2O2的含量与单突变体没有明显差别(图2B).结果暗示,EPFL基因家族成员之间可能存在冗余功能.同时,前人的研究也表明了EPFL1、EPFL2、EPFL4和EPFL6在调控茎尖分生组织发育过程中存在冗余功能[18].为此,对本实验室保存的epfl1,2,4,6四突变体拟南芥进行了核盘菌接种处理.植物活体接种结果表明,epfl1,2,4,6四突变体拟南芥叶片的病斑面积明显大于WT(图3A),且叶片离体接种结果与此一致(图3B).此外,本研究提取了经过接菌处理的拟南芥叶片的总DNA,通过实时荧光定量PCR检测叶片组织中核盘菌的内参基因SsTUBb(S.sclerotioruhousekeeping gene encoding b-tubulin)和拟南芥的内参基因HK2的相对含量,从而确定叶片组织中核盘菌的生长情况.结果表明,epfl1,2,4,6四突变体拟南芥叶片中的核盘菌含量明显多于WT(图3C).DAB染色结果显示,接种核盘菌后,epfl1,2,4,6四突变体拟南芥叶片中的H2O2的含量明显大于WT(图3D).细胞内H2O2的大量产生会导致细胞衰老和死亡,在epfl1,2,4,6四突变体拟南芥中H2O2的含量明显高于WT,暗示epfl1,2,4,6四突变体拟南芥对核盘菌更敏感.这些结果共同表明,EPFL1、EPFL2、EPFL4和EPFL6在拟南芥应答核盘菌中起着重要作用,同时也存在较强的冗余性.

A:植株叶片离体接种处理36 h;B:DAB染色.图2 epfl1、epfl2、epfl3、epfl4、epfl5、epfl6和epfl9拟南芥单突变体抗病性鉴定Fig.2 Resistance evaluation of epfl1, epfl2, epfl3, epfl4, epfl5, epfl6 and epfl9 single mutant plants in response to S.sclerotiorum
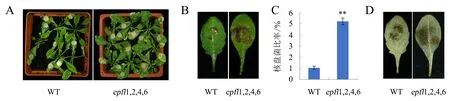
A:植株叶片活体接种处理36 h;B:植株叶片离体接种处理36 h;C:叶片中的核盘菌含量[误差线表示±标准差(n=3);显著性差异分析采用t检验法,**表示差异极显著(P<0.01)];D:DAB染色.图3 epfl1,2,4,6四突变体拟南芥抗病性鉴定Fig.3 Resistance evaluation of epfl1,2,4,6 quadruple mutant in response to S.sclerotiorum
2.3 EPFL1、EPFL2、EPFL4和EPFL6介导YDDs基因的表达参与植物免疫
本实验室前期研究表明,在植物免疫反应中,YDDs基因作用于ER-MPK-WRKY33信号途径下游,正向调控植物对核盘菌的抗性[19].为了进一步研究EPFL1、EPFL2、EPFL4和EPFL6是否通过影响YDDs基因的表达参与拟南芥对核盘菌的防御反应,本研究采用实时荧光定量PCR技术比较接种核盘菌前后YDDs基因在WT和epfl1,2,4,6四突变体拟南芥中的表达情况.在正常条件下,与WT相比,在21个YDDs基因中,有部分基因在epfl1,2,4,6四突变体拟南芥中的表达水平明显下调,如YDD3、YDD4、YDD5等;而有些基因没有明显的变化,如YDD6、YDD7等(图4).在接种核盘菌后,在WT中,21个YDDs基因的表达水平均显著上调;而与WT相比,21个YDDs基因在epfl1,2,4,6四突变体拟南芥中的表达水平显著下调(图4).这些结果表明,EPFL1、EPFL2、EPFL4和EPFL6基因通过介导YDDs基因的表达,从而在拟南芥响应核盘菌的过程中起正向调控作用.
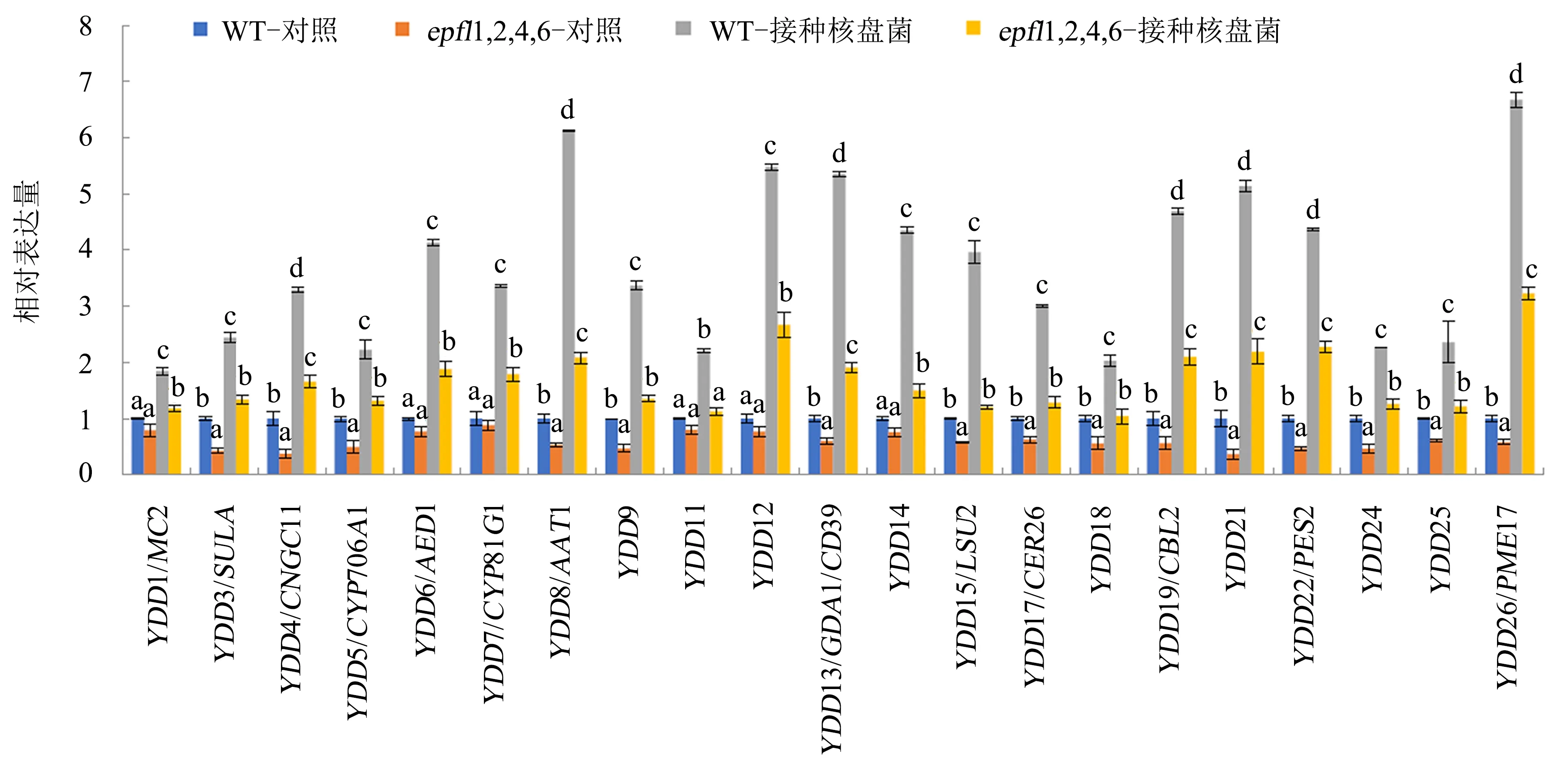
误差线表示±标准差(n=3);显著性差异分析采用单因素方差检验法;附不同字母表示差异显著(P<0.05),附相同字母表示差异不显著(P>0.05).图4 YDDs基因在WT和epfl1,2,4,6四突变体拟南芥中的表达量Fig.4 Expressions of YDDs genes in wildtype and epfl1,2,4,6 quadruple mutant
3 讨论
在病原菌胁迫条件下,ER类受体激酶能够接收并传递病原菌入侵的信号,激发植物体内一系列的防御反应[13-14,16].EPF/EPFL作为ER/ERL类受体激酶家族成员的配体,在多种生物过程中发挥作用,包括气孔发育、花序形态建成以及茎顶端分生组织构成[11,21].研究表明,ER/ERL类受体激酶家族参与调控植物的防御反应[19,22].然而,关于EPF/EPFL分泌肽在植物对病原菌的防御反应中的功能仍有待解析.本研究发现,与WT相比,epfl1、epfl2、epfl3、epfl4、epfl5、epfl6和epfl9拟南芥单突变体接种核盘菌后没有明显表型,而epfl1,2,4,6四突变体拟南芥对核盘菌比WT更加敏感,暗示了EPF/EPFL基因家族成员存在冗余功能.前人研究表明,EPFL1、EPFL2、EPFL4和EPFL6在调控茎顶端分生组织生长中具有冗余功能[18].研究表明,根据EPF/EPFL基因家族的进化关系和结构特征显示,EPF/EPFL基因家族成员可能是由4个共同的祖先基因通过复制而来的:如拟南芥EPFL1、EPFL2和EPFL3这3个基因可能来自同一个祖先基因;EPFL4、EPFL6和EPFL8这3个基因也可能来自同一个祖先基因.此外,也可能是由于EPF/EPFL基因家族和ER/ERL1/2数目不对称所导致,11个EPF/EPFL都能分别与ER/ERL1/2结合而形成冗余功能[23].本研究结果表明,EPFL1、EPFL2、EPFL4和EPFL6可能在植物响应核盘菌胁迫反应中存在冗余功能,共同调控植物对病原菌的防御反应.
在植物免疫过程中,活性氧(ROS)不仅能够抑制病原物的生长,还能作为重要的信号分子,从而激活植物体内一系列的防卫机制,参与宿主与病原体的相互作用[24].在病原菌的侵染下,植物体内可以通过大量产生H2O2促进细胞壁木质化及细胞凋亡,从而导致宿主植物产生过敏反应(HR)来发挥抗病作用.因此,H2O2含量增加是植物抗逆的一个重要指标[25-26].本研究中,在核盘菌侵染下,epfl1,2,4,6四突变体拟南芥叶片中的H2O2含量明显大于WT,epfl1,2,4,6四突变体拟南芥对核盘菌比WT更敏感,这与核盘菌接种处理的结果相吻合:进一步说明了EPFL1、EPFL2、EPFL4和EPFL6在植物对核盘菌的抗性反应中可能发挥正向调控作用.此外,本实验室前期研究表明,ER-MPK6-WRKY33信号途径共同促进YDDs基因的表达从而调控拟南芥对核盘菌的防御反应[19].因此,YDDs基因可以作为拟南芥参与核盘菌防御反应的重要标记基因.本研究结果表明,EPFL1、EPFL2、EPFL4和EPFL6也能够通过调控YDDs基因的表达,从而在植物对核盘菌的免疫过程中发挥作用.进一步暗示,EPF/EPFL基因家族可能是通过激活ER-MPK6-WRKY33信号途径促进YDDs基因的表达从而调控拟南芥对核盘菌的防御反应.综上所述,本研究揭示了EPF/EPFL基因在植物对核盘菌的防御反应中起正调控作用,为将来选育高抗核盘菌作物提供参考.
