大豆蛋白与植物多酚相互作用的研究进展
2022-10-31代世成江连洲
代世成, 王 欢, 江连洲
(东北农业大学食品学院, 哈尔滨 150030)
蛋白质是具有一定空间结构的生物大分子,是多肽链经过盘曲折叠形成的物质。人们每天饮食中的蛋白质主要来源于瘦肉、蛋类、豆类及鱼类。大豆是我国重要的经济作物之一,营养丰富,约含有40%蛋白质,是一种重要的蛋白质食品来源[1]。大豆中的大豆蛋白是一种重要的植物蛋白,因其营养价值高、产量高、优良的生物相容性和加工特性,被广泛应用于食品工业、农业、生物技术等领域。大豆分离蛋白中的主要成分7S 蛋白和11S 蛋白的三维结构式见图1。前期研究发现,蛋白质可以通过物理、化学和酶添加的方法进行处理,以提高蛋白质的功能特性。但是,这些方法都存在一定的缺陷。前两种方法对反应条件要求严格,能耗高,试剂特异性弱。此外,酶解过程中容易产生苦味肽,降低了蛋白质的利用率[2]。因此,结合生物活性物质(植物多酚)对蛋白质进行修饰可能是一种合适的方法。
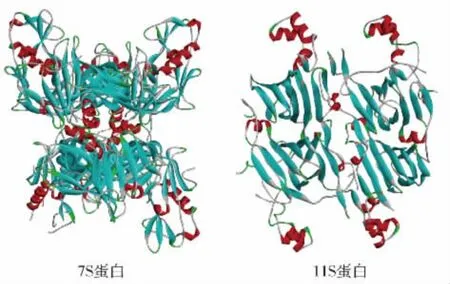
图1 7S蛋白和11S蛋白的三维结构式
多酚广泛存在于植物中,具有极高的生物活性,被人们称为“第七类营养素”。多酚类化合物是指分子结构中有若干个酚羟基的植物成分总称。常见的植物多酚如儿茶素、原花青素、姜黄素、槲皮素的结构式如图2 所示。多酚类物质具有很强的抗炎、抗菌和抗氧化特性,能够减少炎性反应,在预防心血管疾病中发挥作用[3]。因此,人们对多酚作为功能性食品中的生物活性成分颇感兴趣。有大量研究表明,多酚能与蛋白质结合改变蛋白质和多酚的结构及其功能性质[4]。
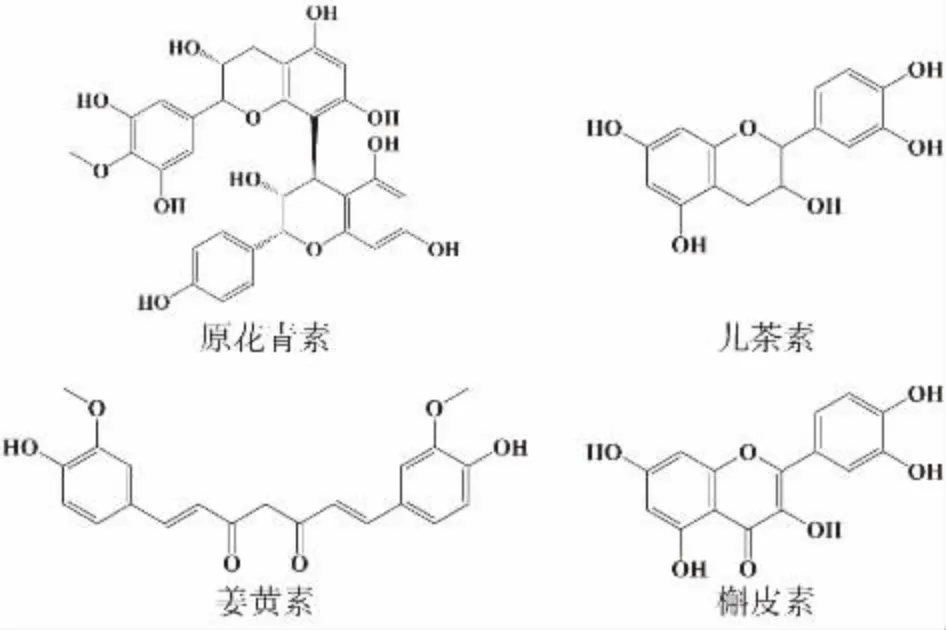
图2 常见植物多酚的结构式
近年来,随着对功能性复合食品需求的增加,多酚类物质对蛋白质功能特性的影响研究成为热点[5]。蛋白质和多酚是重要的食物成分,二者之间的相互作用对食品的生产和营养价值起着重要作用,这些相互作用对二者的结构和功能性质会产生极大的影响,为了更好地了解及阐述大豆蛋白与植物多酚的相互作用,文中综述了大豆蛋白与植物多酚发生相互作用对二者结构和功能的影响,并列举了一些表征二者相互作用的常用方法。这对于大豆蛋白-多酚复合物在食品加工和应用中提供了参考,具有重要意义。
1 大豆蛋白与植物多酚的相互作用
大豆蛋白与多酚可以在不同条件下(pH,酶的添加,自由基的引入)发生相互作用,包括可逆的和不可逆的相互作用。在可逆的相互作用中,通常涉及非共价键,如氢键、疏水作用、静电作用和范德华力。而在不可逆的相互作用中,大豆蛋白与多酚可在碱性条件下、酶的添加或自由基的引入时发生,形成共价键如C-N,C-S键[6]。
1.1 大豆蛋白与植物多酚非共价相互作用
大豆蛋白与多酚的非共价相互作用主要是蛋白质上的氢原子受体和多酚的酚羟基结合形成氢键,蛋白质上的某些氨基酸基团或残基也会和酚羟基或者苯环结合形成离子键、疏水作用、范德华力等[7]。图3 所示为大豆分离蛋白(SPI)与儿茶素非共价作用机理,蛋白质肽键上的氧原子和多酚的羟基之间可以形成氢键(a)。蛋白质中的疏水氨基酸残基可以通过疏水相互作用与多酚的非极性芳环结合(b)。并且在多酚和蛋白质之间的静电力中,蛋白质上的正电荷基团与多酚的负电荷羟基基团相互作用(c)[8]。
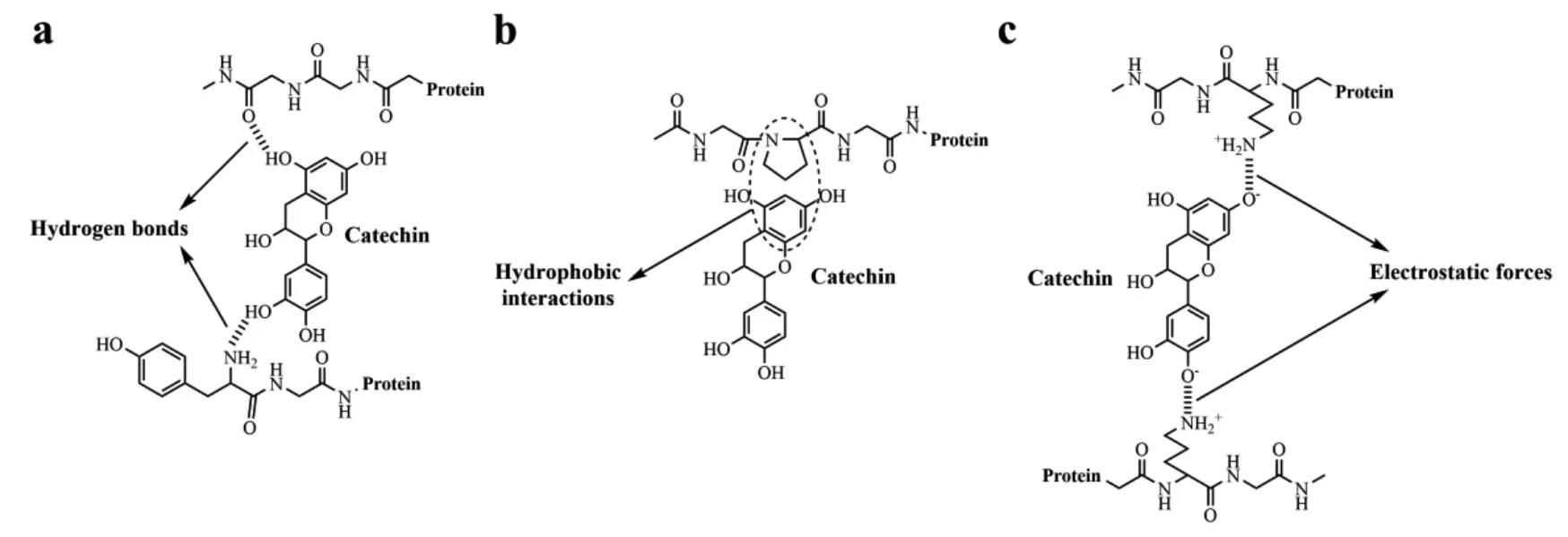
图3 SPI 与儿茶素的非共价相互作用机制
有研究表明,在很多情况下大豆蛋白与多酚的非共价相互作用中氢键和疏水在二者结合过程中起着重要作用,比如SPI 与表没食子儿茶素没食子酸酯(EGCG)[2],SPI 与儿茶素[7],SPI 与茶多酚[9]。非共价相互作用对大豆蛋白和多酚结构和功能性质有一定影响。You等[2]发现EGCG的非共价修饰可以提高SPI 的功能特性,包括起泡、乳化和抗氧化性能。EGCG显著改变了SPI 的二级和三级结构,增强了分子微环境的极性,并暴露更多的官能团。Zhang等[10]发现花青素通过非共价作用可以显著改变SPI 的二级结构,形成的复合物改善了大豆蛋白产品的蛋白质消化率和营养质量,提高其在食品中的应用。
1.2 大豆蛋白与植物多酚共价相互作用
图4 是蛋白质与多酚的共价相互作用机理,主要包括碱法、酶法和自由基接枝法,前两种方法是多酚可以在碱性或者氧化酶存在的条件下,氧化生成醌类物质,与蛋白发生亲核加成反应形成共价复合物(亲核基团包括氨基、巯基或者某些氨基酸残基)。而自由基接枝法的原理是通过双氧水和抗坏血酸的引入使体系内发生氧化还原反应,产生的羟自由基进攻蛋白质侧链的氨基酸残基,生成一种活性中间产物,再与多酚形成共价键[8]。
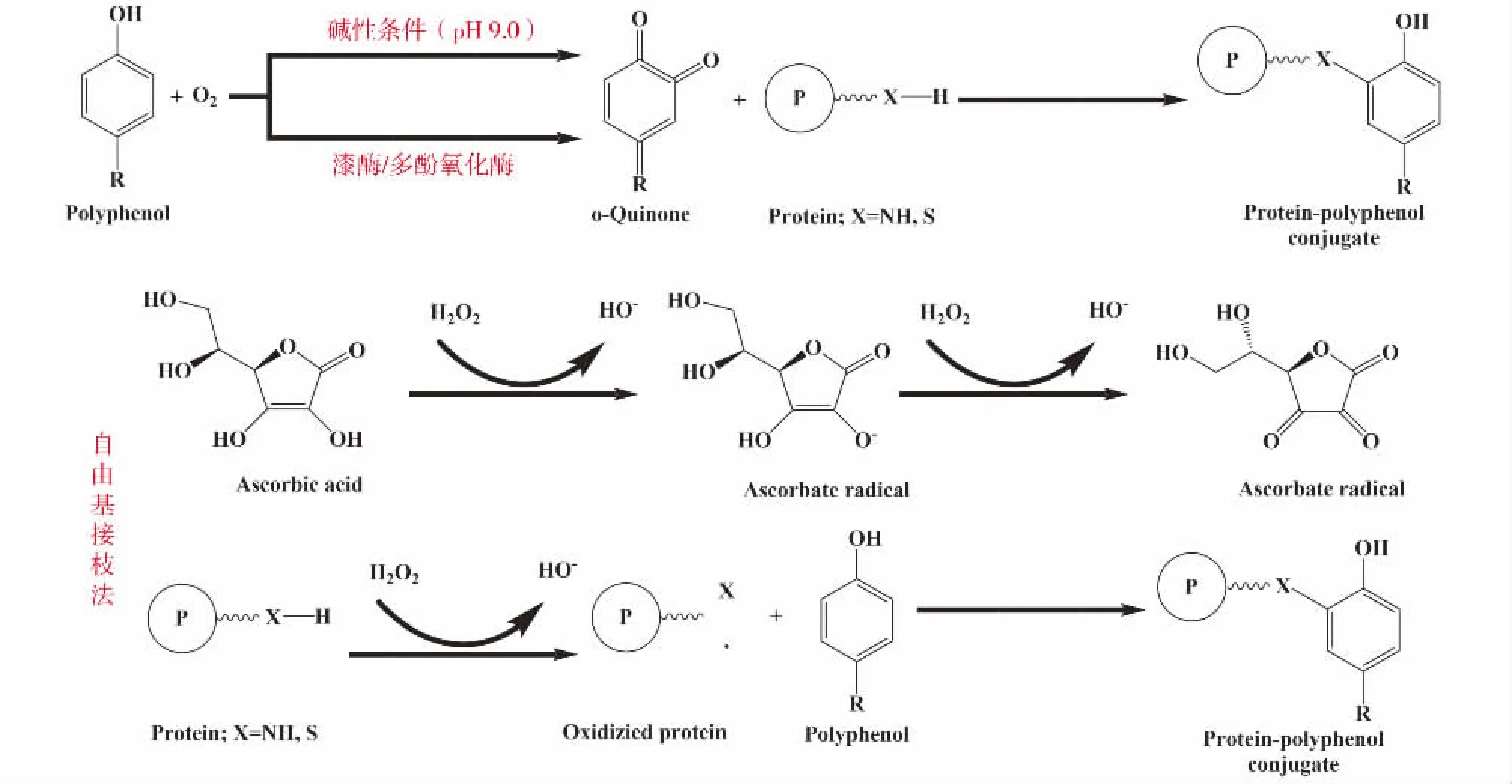
图4 蛋白质与多酚的共价作用机理
与非共价相互作用相比,可能是由于共价作用不可逆,使得共价相互作用对大豆蛋白和多酚结构和功能性质的影响更显著。李杨等[11]发现在pH 7.4、2 h和pH 9.0、24 h处理条件下,SPI和花青素形成共价复合物的起泡性和乳化性显著强于非共价复合物。代世成等[7]通过对比SPI与儿茶素的共价和非共价相互作用,发现在碱法下的共价相互作用对SPI的结构影响更显著,更大程度地提升了SPI的功能性质,比如起泡性和抗氧化活性。
2 常见表征大豆蛋白- 植物多酚相互作用的方法
多酚与大豆蛋白结合的体系是非常复杂的,因此为了更好地表征复合物的性质和相互作用仅仅用单一的分析方法是不够的,往往要几种分析方法联用来分析复合物某一性质或结构变化。研究多酚与蛋白质相互作用的方法有很多种,文中主要对电泳法、紫外-可见吸收光谱法、圆二色光谱法、傅里叶变换红外光谱法、荧光光谱法、生物质谱技术和分子对接技术(见附表)对多酚和蛋白质相互作用的研究进行探讨,旨在为多酚与大豆蛋白相互作用的研究提供一定参考。

附表 表征蛋白质-多酚相互作用的方法
2.1 电泳法
电泳法分为天然聚丙烯酰胺凝胶电泳(Nativepolyacrylamide gel electrophoresis,Native-PAGE)和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),是一种方便、快速、廉价的方法,通常用于确定蛋白质和多糖、多酚等小分子的结合。
Native-PAGE是指电泳体系中未添加SDS和巯基乙醇等变性剂和还原剂的一种方法,由于在Native-PAGE处理过程中样品是处于非变性状态的,即仍保留蛋白质本身的高活性,因此蛋白质样品或复合物样品能保持原有的形状和活性,电泳时蛋白的迁移率取决于蛋白的电荷和分子量,这有助于探究大豆蛋白和多酚结合后对大豆蛋白分子量的影响。而SDS-PAGE由于添加了SDS和巯基乙醇,SDS作为变性剂和助溶试剂,能破坏体系内的非共价键。巯基乙醇作为强还原剂破坏二硫键。而大豆蛋白中含有多聚体,因此经过SDS和巯基乙醇的处理,蛋白质样品会被完全还原成单体甚至是更小的亚基。SDS与蛋白质样品结合后会降低或消除蛋白质分子之间的电荷差异,这就使得蛋白质分子的迁移率只取决于蛋白质分子大小,这有助于探究多酚对大豆蛋白亚基分子量的影响[12-13]。比如Li等[14]通过电泳法探究了乳铁蛋白和EGCG通过非共价和共价(酶法,碱法,自由基接枝法)结合对蛋白质分子量的影响差异。孙洪波等[15]通过SDS-PAGE证实了SPI-花青素非共价复合物和共价复合物的形成,SPI在碱性条件下和花青素形成了更强的共价交联,这种交联形成的作用不会被SDS和巯基乙醇阻断。
2.2 紫外- 可见吸收光谱法
紫外-可见吸收光谱图可以反映出分子内共轭体系的结构信息[16]。紫外-可见吸收光谱法是目前研究多酚与蛋白质相互作用较基础的方法之一,该方法的特点是简单、快捷,检出限低[17]。刘英杰等[18]发现花青素使SPI芳香族氨基酸处的微环境发生了改变,进而诱导SPI多肽链伸展,发生解折叠。生物酶法交联比化学碱法交联更能促进花青素与SPI的共价相互作用。
2.3 圆二色光谱法
圆二色光谱法常被用于测定蛋白质的二级结构[19]。蛋白质的圆二色谱分为两段:一段远紫外区(185~245nm);另一段是近紫外区(245~320nm)。远紫外区是肽键的吸收峰范围,反映蛋白质主链的构象,包括蛋白质的二级结构类型(α螺旋、β折叠、β转角、无规卷曲)及相对含量[20]。在近紫外区,谱峰可以较好地反映出蛋白质构象的细微变化。圆二色光谱法的特点是简单、快速、准确,而且干扰较少。同时不同的植物多酚与蛋白质的结合具有选择性,通过该方法可以探究不同多酚对不同蛋白质二级结构影响程度以及亲和力的差异性。You等[2]发现SPI 与EGCG非共价结合后,α螺旋、β折叠和β转角向无规卷曲转化,导致SPI 的二级结构变得无规则化。由此可知,圆二色谱法可以有效地用于分析多酚与蛋白质相互作用导致蛋白质结构的变化。
2.4 傅里叶变换红外光谱法
傅里叶变换红外光谱法是研究蛋白质二级结构的另一种常用方法,这种方法的特点是可以测定固体或液体,需要的样品量较少。同时可以探究体系内是否存在疏水作用、氢键和静电作用的参与[21]。赵思明等[22]发现EGCG可以与SPI形成氢键,同时随着EGCG添加浓度的增大,SPI中β折叠的含量随之减小,α螺旋的含量随之增大。这表明红外光谱法对探究大豆蛋白与多酚相互作用及对蛋白结构影响是不可缺少的研究方法。
2.5 荧光光谱法
荧光光谱法被广泛用来探究蛋白质的三级结构以及蛋白质与多酚的相互作用程度大小。该方法的特点是灵敏度高、选择性好、操作简便、重复性好、线性范围宽,但该方法对环境极为敏感,酸度、污染物及温度等干扰均会限制此方法的使用。同时荧光光谱法可以探究非共价复合物体系内的荧光淬灭类型以及热力学参数,并确定多酚与蛋白质相互作用的结合常数和作用力类型[23]。刘勤勤等[24]通过荧光光谱法发现茶多酚对大豆分离蛋白存在静态淬灭,二者的作用力主要是范德华力和氢键。
2.6 生物质谱技术
用于研究分子结构、动力学和分子间相互作用的常规研究方法,包括X射线结晶学、核磁共振光波谱、溶液中的光散射技术(动态、静态、小角度X射线散射)、圆二色性(CD)、远紫外圆二色性、振动光谱学(傅里叶变换红外光谱、拉曼光谱)、荧光光谱法、量热法、凝胶色谱法和凝胶电泳。这些方法也有一些缺点,只能测量蛋白质的整体结构。比如X射线衍射需要大量的纯物质才能精确测量分子结构。光谱法只能测量蛋白质的二级、三级和更高级结构的变化。质谱法的使用可以弥补传统方法的这些缺点,并在分子水平上准确地确定蛋白质内部结构的变化。质谱主要用于确定原子质量和同位素丰度。随着高分辨率质谱仪的出现,科学技术的进步拓宽了质谱在有机化合物分析和结构鉴定中的应用。生物质谱技术的基本原理是将分析物电离形成离子,然后通过电场(或磁场)按质荷比(m/z)分离并分析和检测m/z比。生物质谱仪主要用于准确测定生物大分子,如蛋白质、核苷酸和糖,同时还提供分子结构信息。比如电喷雾离子质谱(ESI-MS)技术,其电离过程相对于其他方法更温和,被广泛应用于研究小分子与生物大分子相互作用,比如蛋白质和多酚的非共价相互作用,可以测定出非共价结合力的相关参数[25]。
2.7 分子对接技术
通过对多酚与蛋白质分子对接结果进行分析,可以得出多酚与蛋白质之间的结合自由能、结合位点和相互作用力等,可以用来辅助验证实验结果。Yang等[5]通过7S/11S 与EGCG 的分子对接结果发现,大豆蛋白和EGCG的作用中涉及静电作用、氢键和疏水作用,其中氢键占主导。You等[2]发现SPI与EGCG作用过程中主要是氢键和疏水相互作用占主导,这与热力学实验结论一致。以上实验均证明了分子对接对于分析多酚与蛋白质相互作用的有效性和可行性。
3 展望
目前,虽然大豆蛋白与植物多酚的相互作用中非共价相互作用研究的比较明确,而关于共价相互作用中很多反应机制的研究还尚不透彻,比如蛋白质与多酚复合后构象的改变对多酚具体结构和功能的影响研究还不够深入,需要从微观和宏观的角度采用多种分析方法去表征复合物的结构变化和功能性质,只有探明蛋白质与多酚的相互作用机制,才能更好地应用于食品体系中,从而为蛋白质与多酚的食品加工提供相关理论指导。
