一株产低温脂肪酶酵母菌的鉴定及酶学性质
2022-10-30史程风贾冉冉阎振丽惠丰立
史程风,贾冉冉,阎振丽,惠丰立
(1 南阳师范学院生命科学与农业工程学院,河南 南阳 473061;2 河南天冠企业集团有限公司车用生物燃料技术国家重点实验室,河南 南阳 473000)
脂肪酶(EC3.1.1.3)又称为三酰基甘油水解酶,不仅可催化甘油三酯水解为游离脂肪酸和甘油,还能催化酯化、酯交换、酸解、醇解和氨解等反应。作为水解酶,脂肪酶参与的反应过程中不需要辅因子,表现出良好的化学、区域以及对映选择性,因而成为最通用的生物催化剂。
目前工业上应用广泛的脂肪酶是中高温脂肪酶。中高温脂肪酶在30~50℃之间表现出较高酶活性,在0℃时几乎为零,而低温脂肪酶在0~20℃范围内就可以表现出较高的酶活性,在30℃左右酶活性达到最高。低温脂肪酶为适应寒冷环境进化出了一系列的结构特征,表现为高灵活性、高弹性,具有高催化活性、低活化能、高底物亲和力、热不稳定性等特点,在低温环境中具有广泛的应用前景。
在生物质能源领域,低温脂肪酶催化酯化反应生产生物柴油可代替目前以酸或碱为催化剂的化学法,可解决工艺复杂、能耗高、污染大等制约其发展的瓶颈,且使生物柴油具有良好的发动机低温启动性能。在养殖业,低温脂肪酶水解油脂产生的短链脂肪酸可作为生理功能添加剂替代传统抗生素,用于维护肠道健康,解决仔猪断奶应激问题。低温脂肪酶还可解决温度处理带来的诸多难题,如在油脂、啤酒及奶制品等加工过程中可避免长时间高温灭活酶而影响其质量和风味。在皮制品工业,低温脂肪酶可以实现对皮革低温脱脂,省却加热和冷却步骤,在不损坏皮革质量的基础上省时省耗。工业废水为自然温度,甚至10℃以下,利用低温脂肪酶可实现冷水除污,有利于节省能源,保护环境。
现有报道的低温脂肪酶最适反应温度一般为24~37℃,主要来源于海洋深处、极地和高山地区等极端环境中的低温微生物,主要包括耶式酵母属()、红酵母属()、假单胞菌属()、耶尔森氏菌()、芽孢杆菌属()、曲霉属()、沙雷氏菌属()、 伯克霍尔德氏菌属()等。为了寻找工业上有应用价值的低温脂肪酶,国内对其产生菌已进行了较为深入的研究,但主要是细菌。谢玉婷等对伯克霍尔德氏菌sp.JXJ-16低温脂肪酶的酶学性质进行了研究,该酶在35℃、pH 8.5~9 有最大水解活性,对硝基苯酚辛酸酯为最适底物。王春雨等研究了苏云金芽胞杆菌sp.CZW001 低温脂肪酶的性质,该低温脂肪酶最适反应温度为25℃,最适反应pH为8,对Ca有较大依赖性。国外学者Park 等筛选出一株嗜温毕赤酵母NRRL Y-7723,但仅对该菌产低温脂肪酶条件进行了优化。Maharana等从南极东部湖泊沉积物样品中分离得到一株耐冷红酵母sp. Y-23,该菌所产的低温脂肪酶最适反应pH 为8,最适反应温度为35℃,且在pH为5、温度20℃时更具稳定性。
本文作者课题组从实验室所保藏的55 株产低温脂肪酶菌株中筛选出一株高产酵母菌株NYNU 19160,对该菌株进行鉴定,并对该菌株所产脂肪酶进行初步纯化,研究其酶学性质,为工业低温脂肪酶资源的开发及应用提供理论依据。
1 材料和方法
1.1 材料
1.1.1 菌株
55 株产低温脂肪酶酵母菌株是从我国东北及西北地区采集的土壤样品中分离获得,保藏于本实验室。
1.1.2 试剂与仪器
试剂:棕榈酸对硝基苯酯(PNPP),上海麦克林生化有限公司;无水乙醇,天津市风船化学试剂科技有限公司;阿拉伯胶,美国生命科学与高科技集团公司;TritonX-100,北京索莱宝科技有限公司;Ezup 柱式酵母基因组DNA 抽提试剂盒,生工生物工程(上海)股份有限公司;BCA 蛋白浓度测定试剂盒,北京索莱宝科技有限公司。
主要仪器:YQT-33QCE 全自动生化培养箱,上海申安医疗器械设备有限公司;STIK 高压蒸汽灭菌器,施都凯仪器设备上海有限公司;ZWYRD2403恒温培养振荡器,上海智城分析仪器制造有限公司;磁力搅拌器,海门市其林贝尔仪器制造有限公司;多功能酶标仪,珀金埃尔默股份有限公司。
1.1.3 培养基
YM 液体培养基(g/L):无水葡萄糖10,麦芽粉3,酵母粉3,蛋白胨5,pH自然。
YM 固体培养基:YM 液体培养基基础上添加琼脂20g/L。
罗丹明B 筛选培养基(g/L):无水葡萄糖10,麦芽粉3,酵母粉3,蛋白胨5,琼脂20,罗丹明B 0.01,三丁酸甘油酯乳化液1%(体积分数),pH自然。三丁酸甘油酯乳化液参照文献[23]制备。
发酵培养基(g/L):无水葡萄糖10,玉米浆40,三水磷酸氢二钾6.6,硝酸钠5,三丁酸甘油酯2.5,吐温80 1,pH 7.0。
YCBS 固体培养基(g/L):酵母碳源基础17.9,硫酸铵0.1,琼脂20。
5%麦芽粉固体培养基(g/L):麦芽粉50,琼脂20。
1%玉米琼脂培养基(g/L):玉米粉50,琼脂10(需将玉米粉70℃水浴至水发白,用纱布过滤后添加琼脂配制)。
2%玉米琼脂培养基(g/L):玉米粉50,琼脂20(需将玉米粉70℃水浴至水发白,用纱布过滤后添加琼脂配制)。
氮源同化测试基础培养基(BMN)(g/L):酵母碳源基础17.9。
碳源同化测试基础培养基(BMC)(g/L):酵母氮源基础10。
YEPD 固体培养基(g/L):葡萄糖20,蛋白胨20,酵母粉10,琼脂20。
维生素基础固体培养基(g/L):维生素基础培养基17,琼脂20。
1.2 菌株筛选
(1)初筛 将待筛选菌株在YM固体培养基上涂布平板,15℃培养3天,挑取单菌落转移到罗丹明B 筛选平板上,15℃培养3 天,于350nm 紫外光下观察。依据培养平板上形成的荧光圈的早晚和荧光圈直径与菌落直径比值的大小进行筛选,直径比大的菌落表明水解脂肪酶能力强。
(2)复筛 将初筛的菌株挑取单菌落接入YM液体培养基,15℃、200r/min摇瓶培养1~2天,以10%接种量接种于发酵培养基,15℃、200r/min 摇瓶发酵3~7 天后,12000r/min 离心20min,取上清液即得粗酶液,测定酶活性。
酶活性测定参考Margesin 等的测定方法并略作修改。取棕榈酸对硝基苯酯(PNPP)溶液0.3mL( 体 系 为 0.0378g PNPP、 0.1g 阿 拉 伯 胶、0.4mLTritonX-100溶于50mmol pH7.0的Tris-HCl 缓冲液中,加热至溶解,定容至100mL),待测酶液0.2mL,充分混合后15℃条件下反应15min,立即取出加入0.5mL无水乙醇终止反应。分别取200μL反应液加入96孔板中,灭活的酶液作为空白对照,测定410nm 下吸光值。1 个酶活性单位定义为:在15℃条件下,脂肪酶水解棕榈酸对硝基苯酯,每分钟生成1μmol对硝基苯酚所需酶量,单位以U表示。
1.3 形态和培养特征
菌株NYNU 19160的形态学和培养特征的观察依据文献[25]进行。在YM固体培养基平板上划线,15℃培养4~7天后,观察菌落形态。在YM液体培养基中,15℃静置培养3天后,显微镜观察细胞形态。在1%玉米琼脂培养基中,15℃培养15~20天,定期镜检,观察假菌丝。在YCBS 固体培养基、5%麦芽粉固体培养基和2%玉米琼脂培养基上,15℃培养2~10周,定期镜检,观察担孢子。
1.4 生理生化特征
参考文献[25-26]对菌株NYNU 19160进行生理生化鉴定。除了特别说明外,菌株培养温度均为15℃。利用杜氏管发酵法进行糖发酵测试,连续2周每天观察记录杜氏管中气泡现象。分别采用BMN 和BMC 培养基对菌株进行饥饿培养,7 天后进行碳源、氮源转接实验,观察记录15 天内菌株同化或生长情况。设定4~45℃温度梯度,YEPD固体培养基作为温度测试培养基。利用维生素基础固体培养基进行维生素生长测试,配制生长测试培养基进行其他生长测试实验。
1.5 ITS和26S rDNA序列分析
1.5.1 基因组DNA的提取
挑取单菌落于YM 液体培养基中,15℃、200r/min过夜培养24h,离心弃上清液,收集菌体。提取基因组DNA 操作步骤依据酵母基因组DNA 抽提试剂盒进行。
1.5.2 ITS和26S rDNA PCR扩增和测序
利用引物ITS1(5′-TCC GTA GGT GAA CCT GCG G-3′) 和ITS4 (5′-TCC TCC GCT TAT TGA TAT GC-3′)PCR 扩增ITS 区域序列;利用引物NL1 (5′-TAA GCG GAG GAA AAG-3′) 和NL4(5′-GGT CCG TGT TTC AAG ACG G-3′)PCR 扩增26S rDNA D1/D2区域序列。PCR扩增条件:94℃预变性5min,30 个循环(94℃变性40s,55℃退火40s,72℃延伸30s)72℃延伸5min。扩增完成后以1%的琼脂糖凝胶电泳对产物进行检测,送到生工生物工程技术服务(上海)有限公司测序。
1.5.3 构建系统发育树
通过NCBI 中blastn 工具,将测序得到的菌株NYNU 19160 ITS 序列以及26S rDNA D1/D2 区域序列在GeneBank 核酸数据库中进行序列相似搜索,利用Clustal X软件按照最大同源性的原则,将亲缘关系较近的典型菌株作为参比对象进行比对。利用MEGA 7.0 软件采用邻接法构建系统发育树。选择1000 次重复取样进行进化树拓扑分析,确定进化地位。
1.6 脂肪酶的纯化
将发酵液离心取上清液即得粗酶液,在冰水浴及磁力搅拌条件下缓慢加入研磨好的硫酸铵粉末,添 加 至 饱 和 度(20%~100%), 静 置30min,10000r/min冷冻离心,取上清液测定酶活性。以上清液中的酶活性对硫酸铵饱和度作图。根据确定出的硫酸铵饱和度进行分级沉淀,沉淀复溶于PBS(50mmol/L,pH7.0)中,4℃透析12~14h 后进行浓缩,0.22μm 滤膜过滤后,测定酶活性并使用BCA 蛋白浓度测定试剂盒测定蛋白含量,计算酶纯化倍数和活性回收率。保存纯化后的酶液用于后续酶学性质研究。
2 结果与分析
2.1 菌株筛选
经过罗丹明B 平板初筛,筛选出12 株荧光圈与菌落直径比值较大的菌株(表1)。通过对上述菌株进行复筛,菌株NYNU 19160产脂肪酶活性较高,达到34.47U/mL。
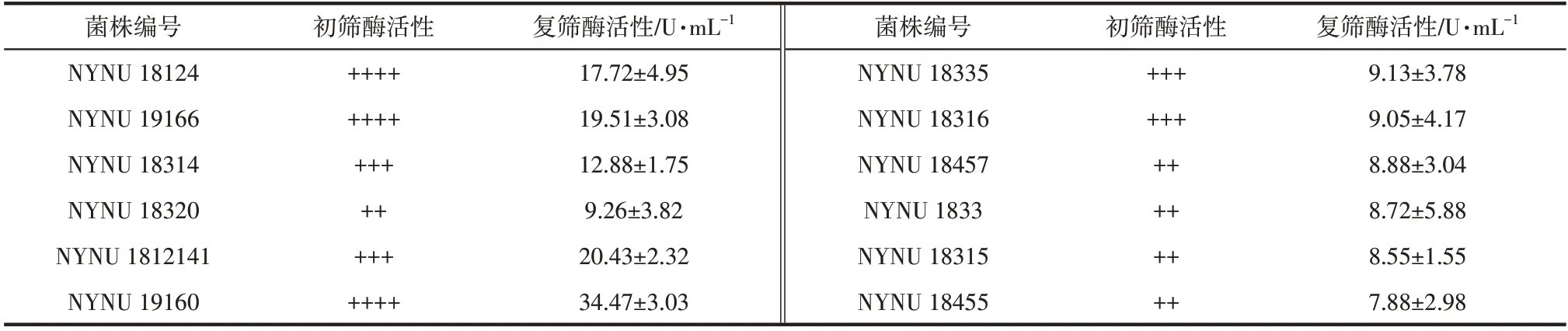
表1 不同的菌株脂肪酶活性
2.2 菌株鉴定
2.2.1 形态与培养特征
菌株NYNU 19160 在YM 固体培养基中,15℃培养5 天后,菌落呈奶油色,表面光滑且有光泽,具有完整边缘。在YM 液体培养基15℃静置培养3天后镜检,细胞呈卵圆形(图1),单个或成对出现,细胞大小为[(3~6)μm×(3~5)μm],呈极性出芽。在1%玉米琼脂培养基中15℃培养15~20 天,定期镜检,不形成假菌丝。在YCBS 固体培养基、5%麦芽粉固体培养基和2%玉米琼脂培养基中15℃培养2~10周,定期镜检,不形成担孢子。

图1 菌株NYNU 19160的细胞形态
2.2.2 生理生化特征
菌株NYNU 19160不发酵糖。可利用乙胺、硝酸盐、D-色氨酸、亚硝酸盐、氨基葡萄糖、肌酸、D-葡萄糖、D-半乳糖、蔗糖、木糖醇、D-麦芽糖、5-酮-D-葡糖糖盐、水杨苷、L-阿拉伯糖醇,不可利用尸胺、肌酐、L-赖氨酸、L-山梨糖、甲醇、D,L-乳酸,弱同化咪唑、D-阿拉伯糖,延迟同化核糖醇、柠檬酸、乙醇。在维生素基础固体培养基上可生长。在15~25℃下生长较快,在40~45℃下不生长。在添加0.01%放线菌酮培养基中弱生长,在添加0.1%放线菌酮、1%乙酸培养基中均不可生长(表2)。菌株NYNU 19160形态和生理生化特征与最相近。
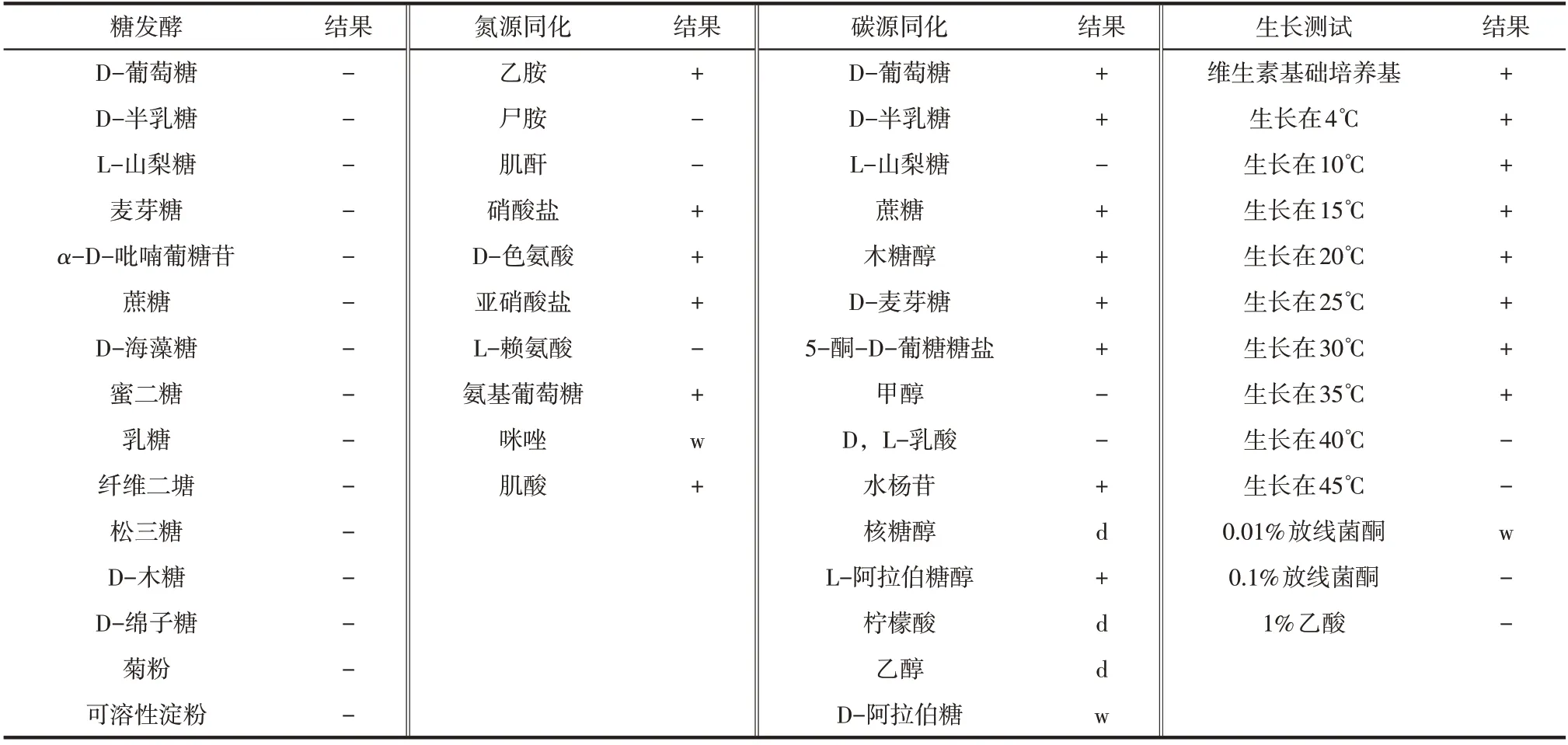
表2 菌株NYNU 19160的生理生化特征
2.2.3 ITS和26S rDNA序列分析
扩增菌株NYNU 19160 的ITS 和26S rDNA D1/D2 区域序列,序列长度分别为504 bp 和597 bp。在GeneBank 核酸数据库中,通过NCBI 中blastn 工具进行比对后,发现菌株NYNU 19160 的ITS 序列与EX F-4087的相似性为100%,26S rDNA D1/D2 区域序列与EX F-4087相似性为99.83%。图2 为菌株NYNU 19160 与所 构 建 系 统 发育树。由系统发育树可以看出,菌株NYNU 19160与EX F-4087聚为一群。结合形态学和生理生化特征,将菌株NYNU 19160鉴定为。
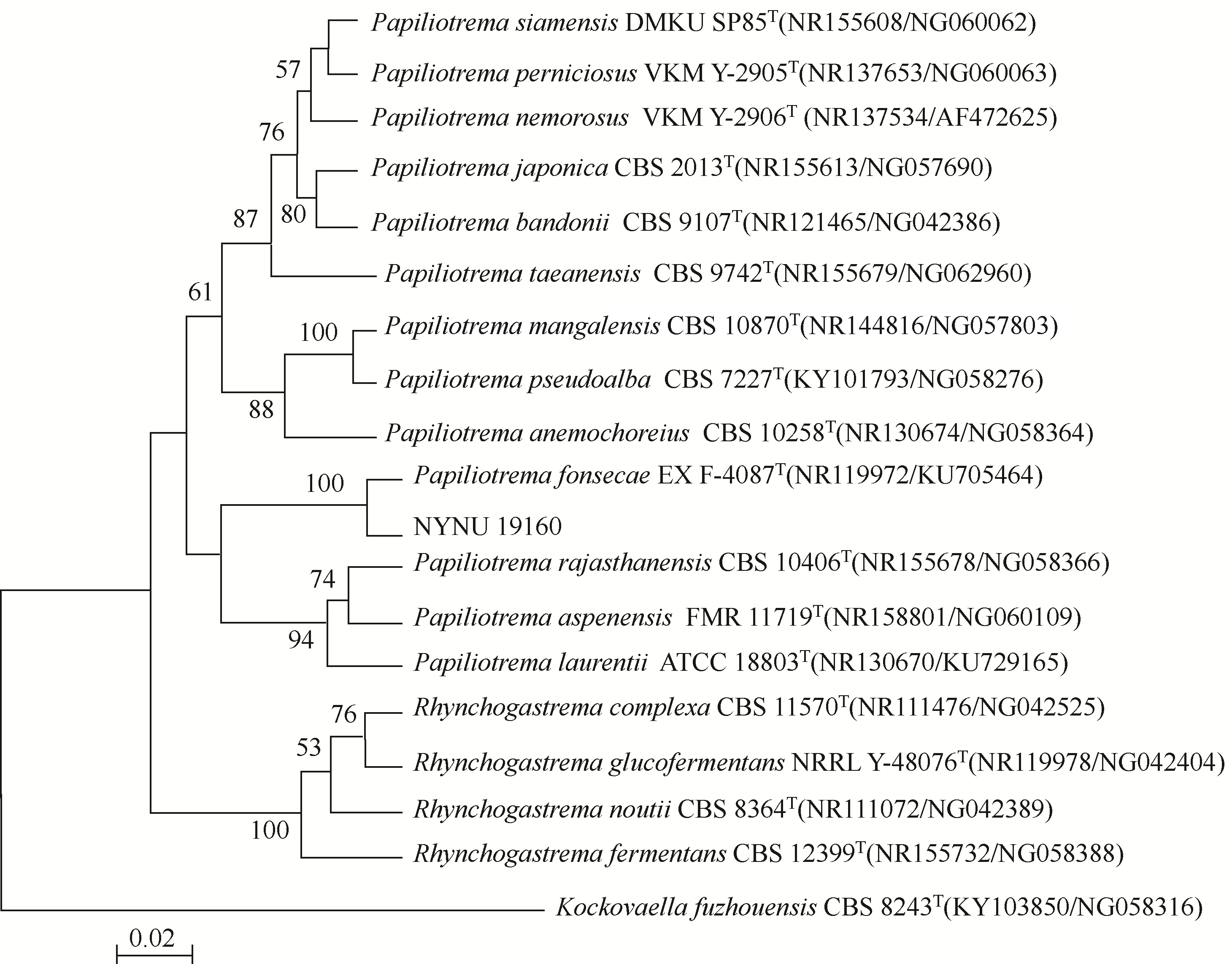
图2 菌株NYNU 19160 ITS和26S rDNA D1/D2区域序列系统发育树
2.3 低温脂肪酶的纯化
菌株NYNU19160 硫酸铵沉淀上清液中低温脂肪酶活性变化曲线表明,饱和度为20%~60%时,酶活性较高,其中饱和度为30%时酶活性最高,为65.6U/mL,随着硫酸铵饱和度增加到70%,酶活性急剧下降,当饱和度达到90%时,酶活性很低,表明该饱和度下大部分脂肪酶已沉淀(图3)。因此可选用30%饱和度进行硫酸铵一级沉淀,以除去部分杂质蛋白,选用90%饱和度进行硫酸铵二级沉淀。

图3 菌株NYNU 19160硫酸铵沉淀上清液中脂肪酶活性变化曲线
经过粗酶液、一级沉淀上清液以及浓缩后酶液的总蛋白质量和总酶活性的计算,得出纯化后酶液的比活性为97.93U/mg,纯化倍数为2.12,酶活性回收率为33.5%,见表3。
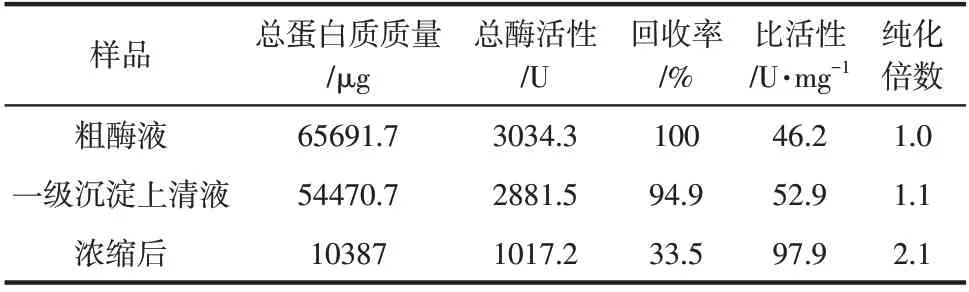
表3 菌株NYNU 19160低温脂肪酶纯化结果
2.4 低温脂肪酶酶学性质
2.4.1 酶最适反应温度及温度对酶稳定性的影响
取纯化后的酶液,于0~50℃条件下分别进行酶反应, 测定酶活性。 结果表明, 菌株NYNU19160 所产脂肪酶在20℃条件下酶活性达到最高,0℃仍有12%的相对酶活性,25~35℃条件下相对酶活性在60%以上,证明该酶符合低温酶的特性(图4)。将酶液在不同温度下保温不同时间后测定剩余酶活性,菌株NYNU19160 脂肪酶在20~30℃条件下酶活性稳定性最好,但热稳定性较差,在50℃下保温30min酶活性损失80%(图5)。
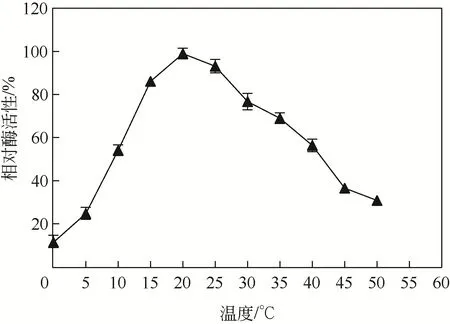
图4 温度对低温脂肪酶活性的影响

图5 温度对低温脂肪酶稳定性的影响
2.4.2 酶最适反应pH及其酸碱稳定性
在最适反应温度条件下,将纯化后的酶液置于不同pH反应体系中,测定酶活性。pH为7~8.5时酶活性达80%以上,最适反应pH为7.5。将酶液在不同pH 缓冲液中保温处理1h,以原酶活性为100%,测定剩余酶活性。随着pH增大,酶稳定性逐渐提高,pH 为7~8 时仍存留80%酶活性,pH为4 以下时酶活性几乎丧失,剩余3.87%,证明菌株NYNU19160脂肪酶在酸性环境中不稳定(图6)。
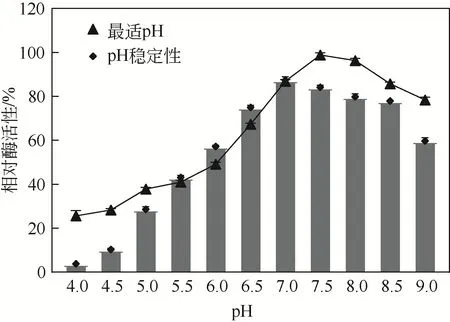
图6 低温脂肪酶最适反应pH及酸碱稳定性
2.4.3 金属离子对酶活性的影响
将Mg、Ni、Mn、Ba、Zn、K、Li、Na、Ca、Co、Fe、Cu、Pb、La添加到酶反应体系中,使终浓度为1mmol/L,以未与金属离子混合的原酶液作为对照,在最适反应条件下反应15min后测定酶活性,考察不同金属离子对菌株NYNU19160 脂肪酶的影响。由图7 可知,Co、Cu、La可明显促进酶活性,其中Cu对酶活性促进作用最为显著,达到186%,Li可能影响了该酶蛋白构象,明显抑制了酶活性,使酶活性降低近60%。
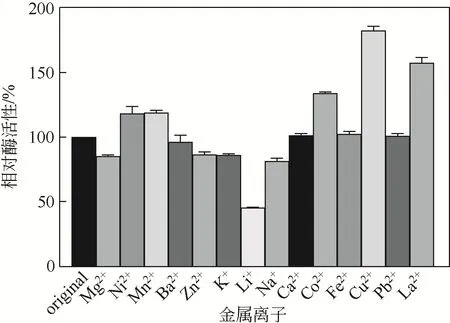
图7 金属离子对低温脂肪酶活性的影响
2.4.4 有机溶剂对酶活性的影响
添加一定浓度的有机溶剂可在酶促有机合成应用中起重要作用。由图8 可以看出,菌株NYNU19160 脂肪酶活性随着有机溶剂极性减弱而降低。苯与正己烷均对该酶有抑制作用,30%的正己烷在4℃混合1h 酶活性仅剩30%,而乙腈、甲醇、乙酸、异丙醇均对酶活性有促进作用,但浓度增大抑制了酶活性,正丁醇、乙醚、乙醇对酶活性促进作用不明显。
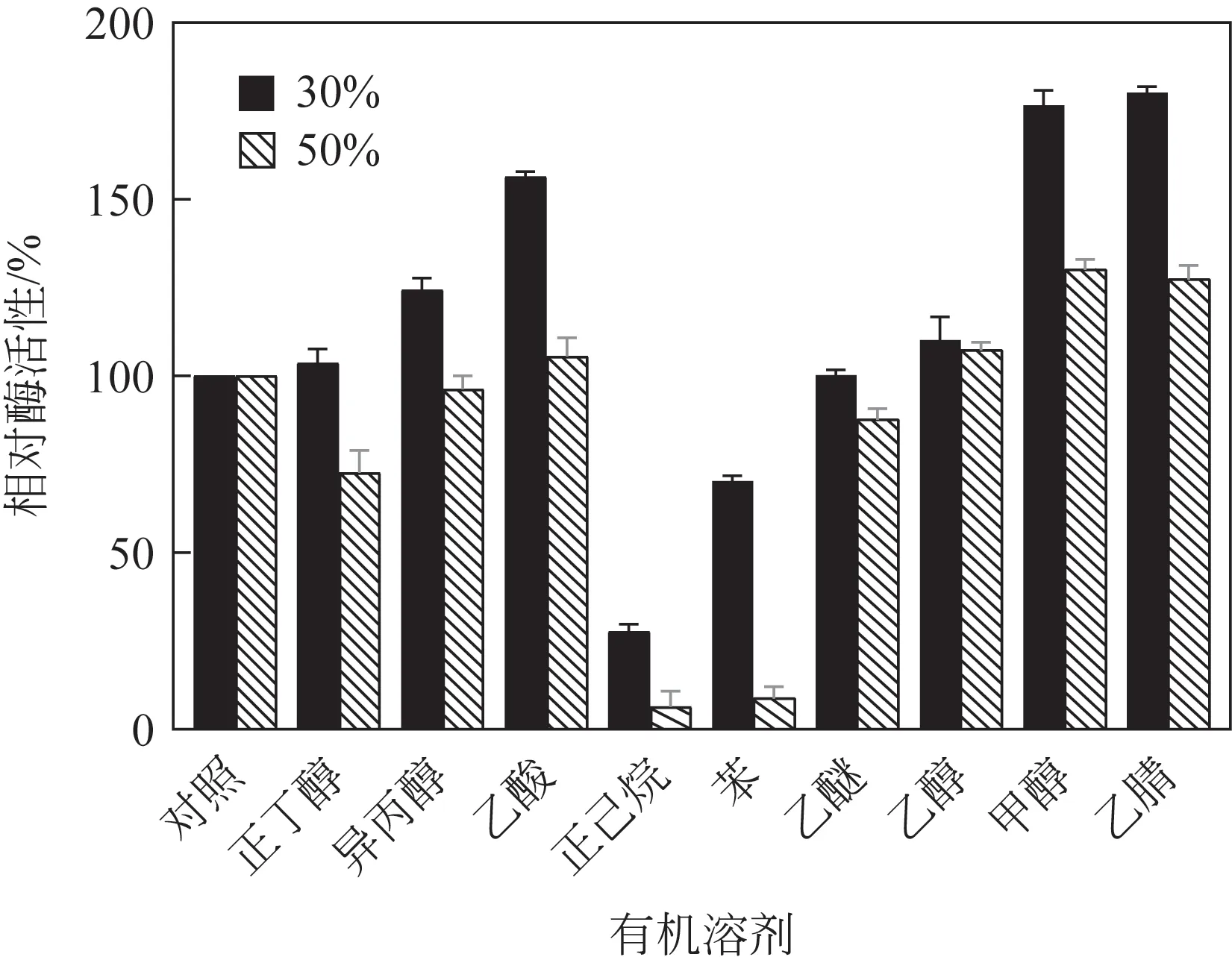
图8 不同有机溶剂对低温脂肪酶的影响
2.4.5 底物特异性
选取不同碳链长度的对硝基苯酚酸酯作为底物分别进行酶反应,结果如图9所示。该脂肪酶对对硝基苯酚丁酸酯(-nitrophenyl butyrate,NPC4)催化活性最大,对对硝基苯酚硬脂酸酯(nitrophenyl Stearate,NPC18)催化活性最小,说明菌株NYNU19160脂肪酶对中短链底物具有特异性。
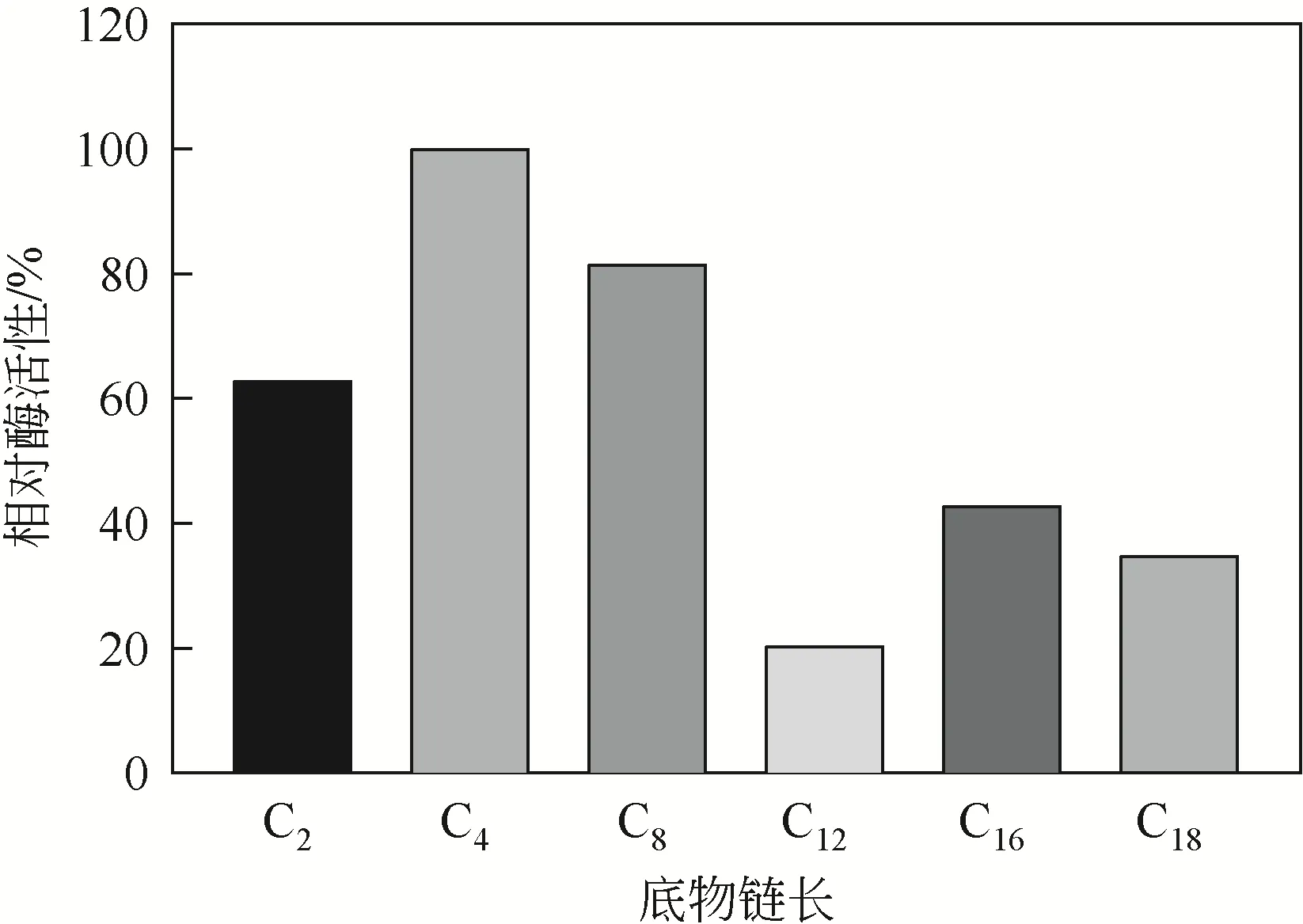
图9 低温脂肪酶对不同碳链对硝基苯酚酯的水解活性
3 结论
本文从实验室所保藏的55 株产低温脂肪酶酵母菌株中筛选出一株高产菌株,对该菌株进行了鉴定,经初步纯化后,研究了该酶的酶学性质,结果如下。
(1)通过初筛和复筛获得一株低温脂肪酶高产酵母菌株NYNU 19160,通过形态学、生理生化以及ITS和26S rDNA D1/D2区域序列分析,将该菌株鉴定为。
(2)粗酶液通过硫酸铵分级沉淀、透析、浓缩,纯化后酶液比活性为97.93U/mg,纯化倍数为2.12,酶活性回收率为33.5%。
(3)菌株NYNU 19160 产生的脂肪酶最适反应温度为20℃,在温度20~30℃的条件下,酶较稳定,但对热敏感,在50℃下处理30min仅残留20%的酶活性;酶的适宜作用pH范围在6.5~8.5,最适pH 为7.5;Cu对该脂肪酶有显著的激活作用,而Li显著抑制了酶活性;该脂肪酶适宜与极性较强且浓度较低的有机溶剂混合反应,如乙腈、甲醇、乙酸等,而苯和正己烷则对酶活性抑制作用较强;对硝基苯酚丁酸酯为该脂肪酶的最适反应底物。
(4)该脂肪酶为典型低温碱性脂肪酶,在生物质能源、洗涤剂、皮制品、废水处理等低温碱性环境中具有广泛的应用前景。
