外源性S100A5蛋白抑制人卵巢癌细胞SKOV3增殖、迁移和侵袭
2022-10-29于雪梅
廖 茜,陈 炜,于雪梅,卿 清
(四川绵阳四○四医院妇产科,四川 绵阳 621000)
卵巢癌是特发于女性卵巢的恶性肿瘤,在50岁以上女性中尤为常见,约占女性癌症的3.4%,主要(约占90%)以上皮型为主[1-2]。卵巢癌患者早期缺乏特异性症状,确诊时多处于中晚期,其病死率位列乳腺癌和宫颈癌之后,是第三大致命的妇科恶性肿瘤[1-2]。卵巢癌治疗以手术治疗和化疗为主,临床常用的化疗药物为紫杉类药物(如紫杉醇、多西他赛),但化疗药物常有骨髓抑制、过敏反应、神经毒性和水钠潴留等副作用,且易产生耐药性,影响治疗效果[1,3]。
S100A5是一种钙结合蛋白,属于E-F手型钙结合蛋白S100家族成员[4]。目前对S100A5的生物学作用了解相对较少,有研究表明S100A5对蛋白质与Ca2+和Cu2+的结合具有拮抗作用,且与炎症和嗅觉信号有关[5-6]。近年来,有研究发现,在卵巢癌患者中S100A5表达量越高,其总生存期越长[7-9],提示其可能是卵巢癌的抑制因子。本研究利用外源性S100A5蛋白处理卵巢癌细胞SKOV3,分析其对卵巢癌细胞SKOV3增殖、迁移和侵袭的影响,以进一步明确S100A5对卵巢癌的具体作用及可能的分子机制。
1 材料与方法
1.1 材料
人卵巢癌细胞株SKOV3购自上海盖宁生物科技有限公司,用含10%胎牛血清(FBS)的RPMI 1640培养基进行培养。人源重组S100A5蛋白冻干粉购自北京义翘神州科技股份有限公司,灭菌PBS复融为终浓度1 mmol/L的储存液,于-80 ℃保存备用。CCK-8试剂购自美国Bimake生物科技有限公司;Transwell小室和基质胶(Matrigel)购自美国BD公司;结晶紫染液购自北京百泰克生物技术有限公司;所有一抗、内参β-actin抗体和HRP标记二抗均购自美国Affinity Biosciences公司。
1.2 CCK-8实验
在96孔板中按照每孔1 000个的数量接种人卵巢癌细胞SKOV3,并使用不同浓度的S100A5蛋白(0 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L)处理细胞,每组5个重复孔。分别在24 h、48 h和72 h后彻底吸除孔内培养基,CCK-8原液按1∶9的比例稀释为工作液,每孔加入0.1 mL CCK-8工作液,继续培养2 h,读取450 nm波长下的OD值。
1.3 克隆形成实验
在6孔板中按照每孔800个的数量接种人卵巢癌细胞SKOV3,使用不同浓度的S100A5蛋白(0 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L)处理7 d后,每孔加入0.1 mL结晶紫染液染色20 min,扫描成像后采用Image J软件计数克隆形成数目。
1.4 划痕愈合实验
在6孔板中按照每孔3×105个的数量接种人卵巢癌细胞SKOV3,待细胞融合度达到90%时,用10 μL无菌枪头沿孔板直径划线制造划痕,使用不同浓度的S100A5蛋白(0 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L)处理0 h和16 h后,于相同位置对划痕进行成像,采用Image J软件测量划痕宽度,划痕愈合率=(0 h宽度-16 h宽度)/0 h宽度×100%。
1.5 Transwell小室(含基质胶)实验
使用RPMI 1640培养基将基质胶原液按1∶5的比例稀释为工作液,60 μL基质胶工作液均匀包被上室,放置于37 ℃培养箱中使其完全凝固。将含有不同浓度S100A5蛋白(0 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L)的完全RPMI 1640培养基添加到下室,将400 μL含有2.5×104个细胞的RPMI 1640培养基添加到上室。24 h后进行结晶紫染色,显微镜下成像,采用Image J软件计数侵袭细胞数量。
1.6 Western blot
将人卵巢癌细胞SKOV3以1×106个/瓶的浓度接种于T-25培养瓶中,使用不同浓度的S100A5蛋白(0 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L)处理36 h后,裂解细胞提取总蛋白,经SDS-PAGE分离并转移至PVDF膜,TBST(5%脱脂奶粉、4 g NaCl、1.214 g Tris-HCl和0.2% Tween-20)封闭2 h,分别用Ki67、PCNA、MMP2、MMP7、MMP9、E-cadherin、N-cadherin、Snail和Vimentin一抗37 ℃孵育过夜,HPR标记二抗37 ℃孵育1 h,ECL显影、成像和分析。Quantity One软件进行灰度值定量,计算蛋白相对表达量。
1.7 统计学分析

2 结果
2.1 外源性S100A5蛋白抑制人卵巢癌细胞SKOV3增殖
CCK-8实验检测结果显示,与0 μmol/L组相比,外源性S100A5蛋白对人卵巢癌细胞SKOV3增殖具有明显抑制作用,且该抑制作用具有一定的浓度依耐性(图1a)。Western blot分析显示,与0 μmol/L组相比,外源性S100A5蛋白可降低增殖标志物Ki67和PCNA蛋白的表达水平(图1b)。克隆形成实验发现,与0 μmol/L组相比,给予不同浓度外源性S100A5蛋白处理后,SKOV3细胞克隆形成数目减少(P<0.01),见图2。以上结果表明外源性S100A5蛋白可抑制人卵巢癌细胞SKOV3的增殖。
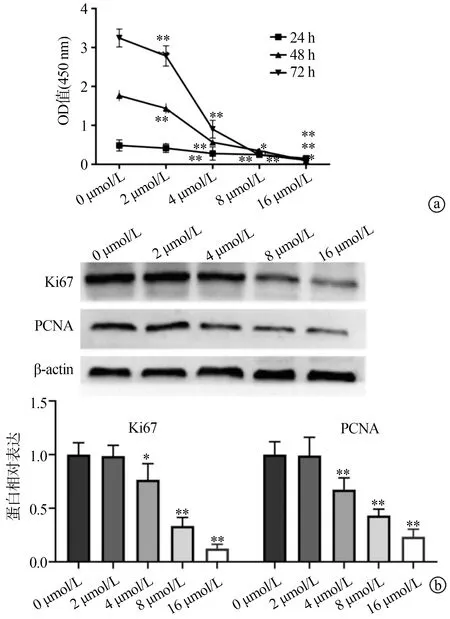
a:外源性S100A5蛋白对SKOV3细胞增殖的影响(CCK-8);b:外源性S100A5蛋白对SKOV3细胞增殖的影响(Western blot) *:与 0 μmol/L相比,P<0.05;**:与0 μmol/L相比,P<0.01

**:与0 μmol/L组相比,P<0.01
2.2 外源性S100A5蛋白抑制人卵巢癌细胞SKOV3迁移和侵袭
划痕愈合实验结果显示,与0 μmol/L组相比,外源性S100A5蛋白处理组SKOV3细胞划痕愈合率下降,迁移能力明显受抑制(图3a)。Transwell小室实验结果显示,与0 μmol/L组相比,外源性S100A5蛋白处理组穿过基质胶(Matrigel)包被小室的侵袭性SKOV3细胞数量减少(P<0.01),见图3b。以上结果表明外源性S100A5蛋白可抑制SKOV3细胞的迁移和侵袭。

a:外源性S100A5蛋白对SKOV3细胞迁移的影响(划痕愈合实验,×40);b:外源性S100A5蛋白对SKOV3细胞侵袭的影响(Transwell小室实验,×100) *:与0 μmol/L组相比,P<0.05;**:与0 μmol/L组相比,P<0.01
2.3 外源性S100A5抑制人卵巢癌细胞SKOV3中MMP2、MMP7和MMP9蛋白表达水平
Western blot检测发现,与0 μmol/L组相比,外源性S100A5蛋白可抑制MMPs家族成员MMP2、MMP7和MMP9蛋白表达水平,见图4。

*:与0 μmol/L组相比,P<0.05;**:与0 μmol/L组相比,P<0.01
2.4 外源性S100A5蛋白抑制人卵巢癌细胞SKOV3的上皮间质转化进程
Western blot结果显示,与0 μmol/L组相比,外源性S100A5蛋白处理组中Vimentin、Snail、N-cadherin蛋白表达水平下调,而E-cadherin蛋白表达水平上调。表明外源性S100A5蛋白可能通过抑制MMPs和上皮间质转化进程进而抑制人卵巢癌细胞SKOV3的迁移和侵袭,见图5。

*:与0 μmol/L组相比,P<0.05;**:与0 μmol/L组相比,P<0.01
3 讨论
S100蛋白家族是一类小分子钙结合蛋白,人S100蛋白家族包括至少21个成员[4]。几乎所有S100蛋白家族成员都与肿瘤密切相关,但各成员在不同类型肿瘤中的具体作用并不尽相同,如S100A2是口腔癌的抑制因子,但却是肺癌的促进因子[10],S100A7抑制雌激素受体-α阳性乳腺癌进程,但促进雌激素受体-α阴性乳腺癌进程[11]。S100A5在肿瘤中的具体作用报道较少,有研究发现,高表达S100A5的脑膜瘤患者更不易复发或者复发时间延后[12]。另有研究显示,在卵巢癌中高表达S100A5的患者具有更为良好的预后,提示S100A5极可能是卵巢癌的抑制因子[7]。因此,本研究利用外源性S100A5蛋白处理人卵巢癌细胞SKOV3,结果显示S100A5蛋白可抑制SKOV3的增殖、迁移和侵袭。
核Ki67蛋白主要位于细胞核,在有丝分裂时被募集到浓缩染色体,通常仅在增殖细胞中表达,Ki67可独立预测癌症进展[13]。PCNA是一种重要的蛋白,参与DNA复制和修复、姐妹染色单体粘连和能量代谢,并与细胞存活密切相关[14]。Ki67和PCNA均是良好的细胞增殖标志物,也可作为肿瘤治疗的靶点[13-14]。本研究结果显示,S100A5蛋白可抑制Ki67和PCNA蛋白的表达,CCK-8实验和克隆形成实验亦表明外源性S100A5蛋白可抑制人卵巢癌细胞SKOV3的增殖。
MMPs是一类Zn2+依耐性的内肽酶,可降解细胞外基质的各种蛋白成分,是癌症侵袭和转移中关键的调节分子[8]。上皮间质转化是肿瘤细胞从非运动性上皮表型向迁移性间充质表型转化的过程,其共同特征是上皮E-cadherin表达下调或缺失,伴随N-cadherin表达上调,增加了肿瘤的远端转移能力,上皮间质转化可赋予肿瘤转移能力,预示着预后不良[9,15]。Snail作为上皮间质转化中E-cadherin表达的关键转录抑制因子,可使肿瘤保持高度的迁移侵袭能力,并促进耐药性、肿瘤复发和转移[16]。Vimentin作为上皮间质转化的标志物,在大多数肿瘤细胞中高表达,在肿瘤转移中起关键作用[17]。本研究结果显示,S100A5显著抑制MMP2、MMP7和MMP9蛋白的表达水平,有效降低了N-cadherin、Vimentin和Snail蛋白的表达水平,同时提高了E-cadherin蛋白的表达水平。因此,我们推测外源性S100A5蛋白可能通过抑制MMPs和逆转上皮间质转化过程,从而降低人卵巢癌细胞SKOV3的迁移和侵袭。
综上,外源性S100A5蛋白极可能是卵巢癌的抑制因子,可抑制人卵巢癌细胞SKOV3的增殖、迁移及侵袭。因此,外源性S100A5蛋白可作为一种潜在的治疗卵巢癌的方法。
