C型产气荚膜梭菌外毒素致小鼠肠道损伤的转录组分析
2022-10-29张思雨王玉炯
张思雨,王玉炯*,曾 瑾*
(1.宁夏大学西部特色生物资源保护与利用教育部重点实验室,银川 750021;2.宁夏大学生命科学学院,银川 750021)
产气荚膜梭菌()是一种短杆状、无鞭毛、不运动、有荚膜、可形成内生孢子的专性厌氧的革兰阳性菌。该菌能产生至少18种外毒素和酶类;传统上,依据其产生的主要致死性毒素与其抗毒素的中和试验可将产气荚膜梭菌分为A、B、C、D和E 5个血清型,而在2017年美国安娜堡举行的“第十届梭状芽胞杆菌分子生物学及其发病机制”国际会议上对该菌的分类扩展到7个类型(A~G)。其中,毒力较强的主要是A型和C型产气荚膜梭菌,C型菌株定义为携带2个分型毒素基因(编码α毒素)和(编码β毒素)的产气荚膜梭菌。
该菌引起的多种动物的气性坏疽、肠毒血症、坏死性肠炎(intestine necrotic, IN)难以预防和治疗,流行范围广,从而引起大量的关注。在产气荚膜梭菌引起的人类食源性疾病中,原因通常是病患食用了受到该菌污染的生肉及其制品,这些受污染的食品会由于不当的加工和保存,造成该菌的大量繁殖并分泌外毒素,从而引起食源性感染疾病。据美国疾病预防控制中心(CDC)统计,产气荚膜梭菌病是美国第二大常见的食源性疾病,占总发病率的26%。我国居民饮食结构多以熟食为主,由产气荚膜梭菌所引起的食源性感染事件较少,但也有相关的感染食源性疾病暴发的事件报道。
产气荚膜梭菌病在畜禽养殖生产中的危害性更令人关注。特别是近年来“禁抗令”的实施,伴随抗生素类生长促进剂从动物饲料中撤出,产气荚膜梭菌所引发的坏死性肠炎的患病率明显增加。该菌所产生的外毒素可影响牛、羊、猪以及禽类等几乎所有的养殖动物,患病动物往往在短时间内迅速发病,常常会出现休克乃至死亡;该病对幼年动物的影响尤为严重,即使是经大量抗生素治疗后存活下来的幼畜,也常常会出现发育迟缓以及坏死性肠炎的亚临床现象,而亚临床感染可以削弱畜禽的生长速度,降低饲料转化率,减少体重增加,使其养殖生产性能受到严重的影响,并导致重大经济损失。据报道仅C型产气荚膜梭菌每年给全球家禽业造成约60亿美元的生产损失和控制成本。
产气荚膜梭菌是利用其分泌的大量蛋白质毒素在人类和动物中产生肠道感染、组织毒性以及神经反应等疾病状态的。在一些条件下,人或动物摄入产气荚膜梭菌,或黏附在消化道内壁上的该菌过度繁殖,迅速产生多种毒素和侵袭性酶,毒素作用于肠道中的多种靶细胞上的受体,激活细胞内信号通路,进而产生多种效应。在研究产气荚膜梭菌感染的发病机制时,宿主和细胞敏感性似乎是需要考虑的关键因素,因此,常常选择产气荚膜梭菌相关疾病的体外或动物模型解决这个问题,而发病机制作为病理机制中的初期环节,可提供治疗该病的重要靶点。而机体在响应产气荚膜梭菌感染时,也会启动免疫应答、代谢调控等一系列复杂的生物学过程。在这其中,涉及大量调控反应的相关蛋白的表达,以及关键信号通路的激活或抑制。目前,随着现代技术的日益发展,越来越多的研究者采用高通量测序技术分析基因表达和信号通路富集情况,探究病原菌致病的分子机制,挖掘关键基因作为靶点。比如刘乐文对感染肠炎沙门菌鸡的盲肠组织进行mRNA与miRNA测序,分析后发现:表达上调的mRNA包含169个表达下调miRNA的靶基因,主要富集在免疫反应、炎症反应、细菌防御反应、Toll样受体信号通路等与机体免疫相关的生物学过程。张旭等对感染鸭肠炎病毒的樱桃谷鸭的十二指肠组织进行测序,通过GO和KEGG数据库分析发现,差异表达基因主要富集在NOD样受体信号通路、Toll样受体信号通路、IL-17信号通路等。也有关于产气荚膜梭菌的转录组研究,比如姜天团对灌服C型产气荚膜梭菌培养菌液的仔猪回肠组织进行蛋白组学和转录组学测序,联合分析发现能量代谢、免疫响应、细胞膜结构、肠道炎症等方面的变化可能介导仔猪对C型产气荚膜梭菌的耐受性或易感性。但是,产气荚膜梭菌的致病因子是其产生的多种外毒素和侵袭酶,该菌所分泌的毒素种类和数量受培养基成分、pH以及培养温度等条件的影响而具有显著的差异;同时还受到菌体VirS/VirR毒力调节系统以及Agr群体传感系统的影响。因此,本研究规避了产气荚膜梭菌的产毒条件所带来的干扰,直接采用经脑心浸液中培养的C型产气荚膜梭菌培养上清感染小鼠,通过RNA-seq技术对肠道组织转录组的变化进行分析,筛选差异表达基因,通过GO功能注释和KEGG通路富集筛选关键信号通路,以期为C型产气荚膜梭菌分泌外毒素致机体损伤的致病机理研究提供理论基础和新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级6周龄BALB/c雌性小鼠,体质量均为20 g左右,购自北京维通利华实验动物技术有限公司。实验动物常温培养于12 h明暗交替的动物实验室,保证其自由饮水、摄食。标准饲养3~5 d后进行试验。
1.1.2 菌株与试剂 产气荚膜梭菌中国标准株C59-2(C型)由本实验室保存,脑心浸液培养基购自英国OXOID公司,产气荚膜梭菌B型菌株鉴定血清和C型菌株鉴定血清均来自于中国农业科学院兰州兽医研究所,1K19单克隆抗体和2G7单克隆抗体均由本实验室制得。
1.2 方法
1.2.1 毒素蛋白表达检测 将产气荚膜梭菌C59-2菌株复壮后培养于脑心浸液培养基中,培养至第4代,离心菌液收集培养上清,并通过0.22 μm细菌滤器过滤获得上清,加入2×蛋白上样缓冲液,于100 ℃金属浴中煮5 min,制得蛋白免疫印迹样品。样品分别经过电泳、转膜、封闭、孵育一抗(具体见图1图注)、洗涤、孵育二抗(山羊抗鼠IgG,Proteintech)、洗涤以及显影过程,以分析毒素蛋白表达情况。
1.2.2 样本采集 产气荚膜梭菌C59-2培养上清经0.22 μm滤器过滤后备用;以不同剂量(10、20、40、80 μL)的培养上清对BALB/c小鼠腹腔注射进行攻毒,每组设置4只小鼠,24 h后观察小鼠死亡情况。发现当注射培养上清的剂量为20 μL时BALB/c小鼠全部死亡,即绝对致死量LD为20 μL,因而确定在后续试验中每只小鼠的最佳攻毒剂量为20 μL。对照组和处理组各随机设置10只小鼠,处理组小鼠腹腔注射新鲜制备并稀释的培养上清20 μL(原液),对照组注射等体积脑心浸液培养基。在处理组小鼠出现濒临死亡状态时解剖各组小鼠,快速收集小肠(空肠)病变部位于液氮速冻后,保存于-80 ℃超低温冰箱待用。
1.2.3 总RNA提取 取两组小鼠的肠道组织,使用RNA提取试剂盒(RNeasy Mini Kit,QIAGEN,德国),按照说明书分别提取每个样品的总RNA,并通过超微量分光光度计(Nanodrop 8000)检测RNA的浓度及纯度,通过Agilent 2100 bioanalyzer精确检测RNA完整性。
1.2.4 测序及原始数据质控 每个样品构建一个文库,库检合格后,通过Illumina测序平台进行测序。经过原始数据过滤、测序错误率检查、GC含量分布检查,获得后续分析使用的clean reads。并且使用HISAT2软件将质控后的clean reads与参考基因组进行精确的比对,以获取reads在参考基因组上的定位信息。进而采用Subread软件中的Feature Counts工具,根据获取的位置信息统计每个基因从起始到终止范围内覆盖的reads数。过滤掉不合格数据后进行定量分析,以及后续的差异分析和富集分析。
1.2.5 差异表达基因分析 完成基因表达定量后,通过DESeq2对其表达数据进行统计学分析,筛选样本在不同状态下表达水平显著差异的基因。并且引入adj对假设检验的-value进行校正,从而控制假阳性的比例。筛选标准为| lb(FoldChange)| ≥1.5,adj<0.05。
1.2.6 富集分析 采用cluster Profiler软件对差异基因集进行GO功能富集分析、KEGG通路富集分析等,筛选得到生物学过程中起关键作用的信号通路和相关分子途径。
1.2.7 q-PCR验证测序结果 在“1.2.5”筛选结果中随机选取上调表达以及下调抑制基因各5个,使用Primer BLAST网站设计引物(表1)。将测序送样后所剩余的RNA通过TaKaRa逆转录试剂盒反转为cDNA,以-作为内参基因,通过Quant Studio 5仪器进行实时荧光定量PCR,采用2法分析数据,对测序结果进行验证。
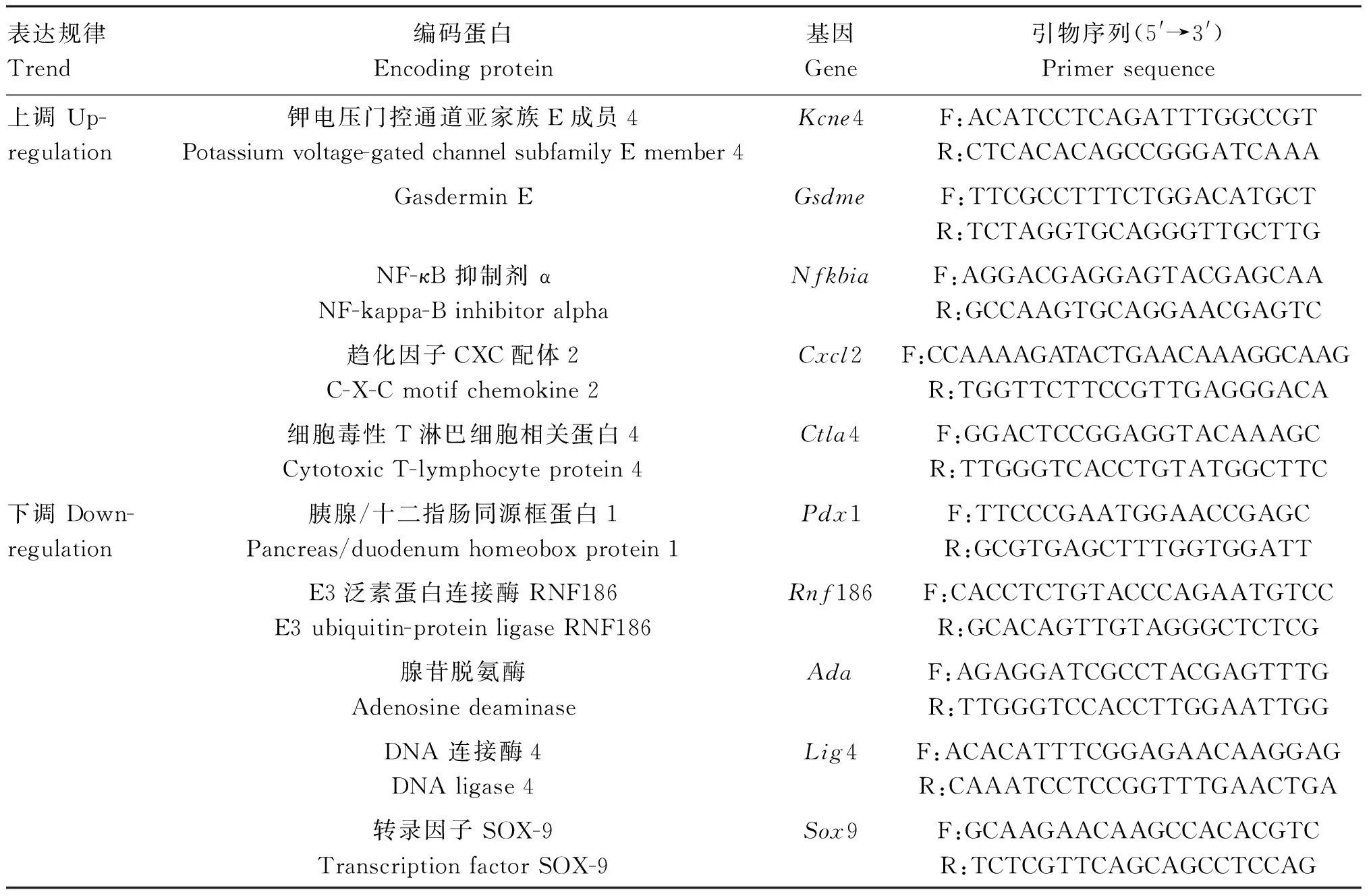
表1 引物序列信息Table 1 Primer sequence information
2 结 果
2.1 产气荚膜梭菌培养上清中的毒素蛋白表达检测
通过“1.2.1”方法分析毒素蛋白的表达情况,结果表明,产气荚膜梭菌C59-2菌株经脑心浸液培养基培养后上清中具有外毒素,包括Alpha毒素(较少)和Beta1毒素(图1),符合C型产气荚膜梭菌分型条件。
A. 孵育识别Alpha毒素的B型菌株鉴定血清;B. 孵育识别Alpha毒素的C型菌株鉴定血清;C. 孵育识别Beta1毒素的1K19单克隆抗体;D. 孵育识别Beta2毒素的2G7单克隆抗体;M. 蛋白相对分子质量标准;1. BL21(DE3)pET-32a诱导后全菌液;2.液体硫乙醇酸盐培养基培养上清;3.脑心浸液培养基培养上清A. Type B strain identification serum(recognizes Alpha toxin); B. Type C strain identification serum (recognizes Alpha toxin); C. 1K19(recognizes Beta1 toxin); D. 2G7(recognizes Beta2 toxin); M. Protein marker; 1. BL21(DE3)pET-32a Whole bacterial solution after induction; 2. Culture supernatant of fluid thioglycollate medium; 3. Culture supernatant of brain heart infusion medium图1 检测产气荚膜梭菌C59-2菌株通过脑心浸液培养基培养后毒素的蛋白表达情况Fig.1 Detection of protein expression of toxin in Clostridium perfringens C59-2 strain cultured in brain heart media
2.2 腹腔注射产气荚膜梭菌培养上清后小鼠观察结果
产气荚膜梭菌培养上清对BALB/c小鼠的LD为20 μL(表2)。

表2 产气荚膜梭菌C型菌(C59-2)培养上清BALB/c小鼠LD100的测定Table 2 Determination of LD100 of culture supernatant of Clostridium perfringens type C (C59-2) in BALB/c mice
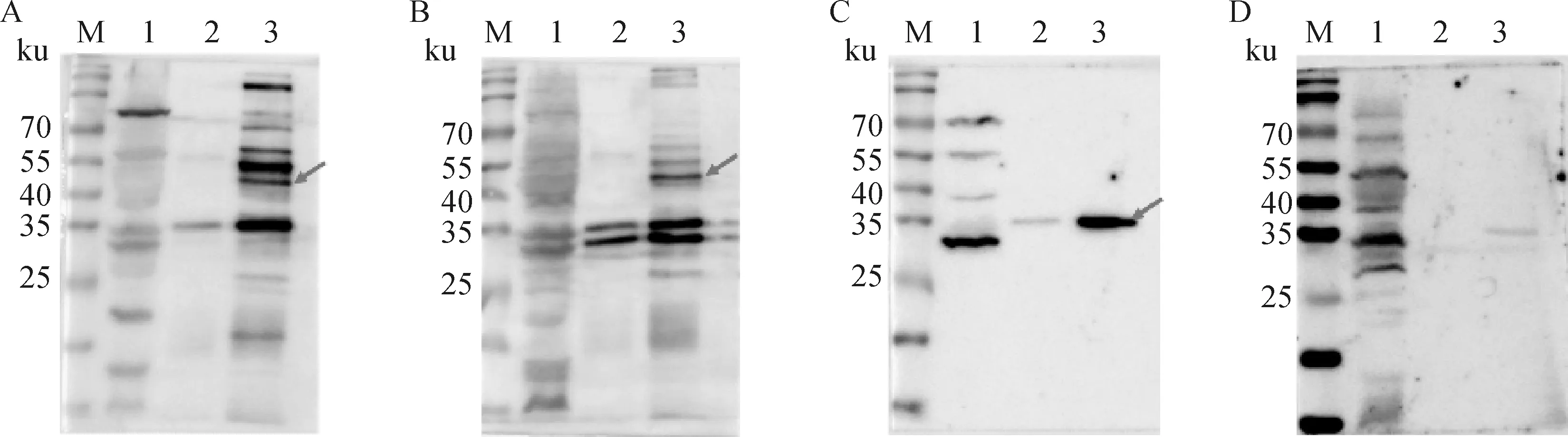
接种C59-2培养上清后,观察发现小鼠短至2~3 h内即出现呼吸窘迫、精神萎靡、被毛杂乱、抱团取暖、食欲消失等症状,并在24 h内全部死亡(图2)。剖检结果可以看到病变主要在回肠和空肠部分;处理组死亡小鼠肠壁因充满气体扩张而菲薄,肠壁黏膜出血呈现血肿状态(图3)。

图2 攻毒后小鼠生活状态(左为对照组,右为处理组)Fig.2 The represent of mice after challenge(left is the control group, right is the treatment group)
图3 攻毒后小鼠解剖图(左为对照组,右为处理组)Fig.3 Anatomy of mice after challenge(left is the control group, right is the treatment group)
2.3 数据质控
将采集好的小鼠空肠组织样品送北京诺禾致源科技股份有限公司,分别提取总RNA,检测结果显示,所有样本浓度均>702 ng·μL,RIN值>8.7,质量全部合格,可以正常建库(表3)。通过Illumina 2000测序平台的nova-seq分别对两组样品进行测序,经过滤、整理原始数据后,共获得273 195 306条高质量数据,共计40.99 Gb碱基,且每个样品的碱基量均达到6.45以上。各样品的错误率均<0.03,Q20均>96%,Q30均>90%,GC含量均在50%左右,表明测序数据有效,可以用于后续分析。另外,6个样本与参考基因组的对比率均>92.62%,比对到参考基因组唯一位置,即用于后续定量数据分析的reads数及其百分比为77.09%~88.87%,比对到基因组外显子区域的reads数及其占clean reads数的比例为94.08%~97.70%,具体内容如表4所示。
表3 总RNA质量检测Table 3 Examination of total RNA quality

表4 转录组测序数据统计分析Table 4 Statistical analysis of transcriptome sequencing data
2.4 差异表达基因分析与验证
通过方法“1.2.5”分析比较对照组和处理组的基因表达情况,如图4A火山图所示,共得到795个差异基因,与对照组相比,处理组中有229个基因表达上调,有566个基因表达下调,有23 669个基因表达无显著性差异。为了后续进行差异基因的功能富集分析,对所有样本的基因表达值(FPKM表达矩阵)进行聚类分析,对行(Row)进行均一化处理(Z-score)。如图4B热图所示,表达模式相近的基因被聚集在一起,共有4个不同的功能相关类群,且每组有3个生物学重复样品间相互关联。以上结果进一步说明试验结果准确、可靠,组内不同个体的基因表达谱具有较低的变异。
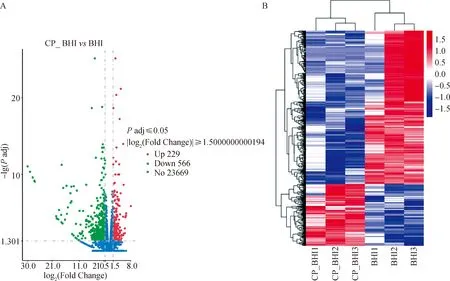
A.火山图:每一个点代表一个基因,红色表示上调表达的基因,绿色表示下调表达的基因,蓝色表示非显著差异表达基因。B.热图:每列表示一个样本,每行表示一个基因;颜色代表该基因在单个样本中的表达量,红色代表表达量较高,蓝色代表表达量较低;左侧为基因聚类的树状图和子聚类的模块图A. Volcano map:Each dot represents a single gene. Red dots represent the up-regulated genes;green dots represent the down-regulated genes;Blue dots represent stably expressed genes. B. Heat map:Each column represents a sample and each row represents a gene. The color represents the expression level of the gene in a single sample, with red representing higher expression and blue representing lower expression. On the left is a dendrogram of gene clusters and a block diagram of subclusters图4 差异表达基因火山图(A)及热图(B)Fig.4 Volcano map (A) and heat map (B) of DEGs
另外,为了验证筛选后的转录组测序数据的准确性,随机挑选5个上调差异表达基因(4、、、2、4)和5个下调差异表达基因(1、186、、4、9),进行实时荧光定量PCR试验。结果如图5所示,上述所挑选的差异表达基因的q-PCR变化规律与RNA-seq中表达规律一致,进一步表明所分析的数据准确可信。
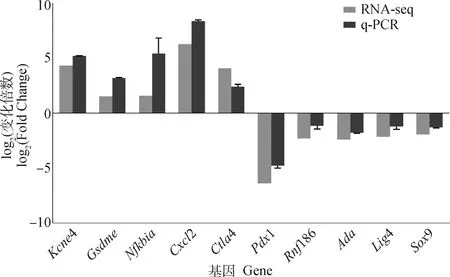
图5 差异表达基因的实时荧光定量PCR验证Fig.5 q-PCR verification of DEGs
2.5 GO注释分析
GO(Gene Ontology)是描述基因功能的综合性数据库,可分为生物过程(biological process)、细胞组成(cellular component)和分子功能(molecular function)3个部分。将筛选获得的差异表达基因通过GO功能富集,以校正值<0.05作为显著性富集的阈值进行再次筛选,分析GO注释结果,绘制条形图如图6所示。其中,上调的差异表达基因注释主要涉及生物过程部分,如G蛋白偶联核苷酸受体活性、G蛋白偶联嘌呤核苷酸受体活性、嘌呤核苷酸受体活性以及核苷酸受体活性等(图6A)。而下调的差异表达基因注释主要涉及分子功能部分,如酶活性、受体活性、转录激活因子活性以及MHC Ⅰ类蛋白结合等(图6B)。

A为上调的差异表达基因注释,B为下调的差异表达基因注释。横坐标为基因数,纵坐标为各注释内容A is the up-regulated differential expression gene annotation, and B is the down-regulated differential expression gene annotation. The ordinate is the number of genes, and the abscissa is the annotation content图6 差异表达基因的GO数据库注释Fig.6 GO database annotation of DEGs
2.6 KEGG富集分析
KEGG(kyoto encyclopedia of genes and genomes)是整合了基因组、化学和系统功能信息的综合性数据库。将筛选获得的差异表达基因通过KEGG通路富集,以校正值<0.05作为显著性富集的阈值进行再次筛选,从富集结果中选取最显著的20个通路,绘制散点图(图7)。结果显示,KEGG通路主要富集在TNF信号通路、IL-17信号通路、p53信号通路、FOXO信号通路、Toll样受体信号通路、NF-κB信号通路等信号通路。
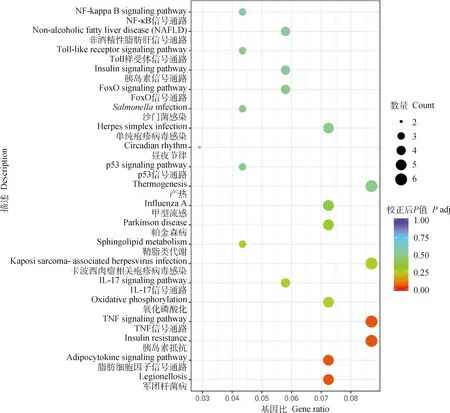
横坐标为注释到KEGG通路上的差异基因数与差异基因总数的比值,纵坐标为KEGG通路,点的大小代表注释到KEGG通路上的基因数,颜色从红到紫代表富集的显著性大小The abscissa is the ratio of the number of differential genes annotated to the KEGG pathway to the total number of differential genes, and the ordinate is the KEGG pathway. The size of the dots represents the number of genes annotated on the KEGG pathway, and the colors from red to purple represent the significance of enrichment图7 差异表达基因的KEGG富集分析Fig.7 KEGG enrichment analysis of DEGs
3 讨 论
产气荚膜梭菌作为人畜共患病原菌,引发的疾病具有发病快,病死率高的特点,引起了世界性的广泛关注,成为严重影响公共卫生和社会经济发展的问题。但是该菌的致病机理尚不清晰,还需进一步研究相关分子机制,为产气荚膜梭菌病的治疗方案提供新的思路。由病原菌产生的毒素(例如产气荚膜梭菌和艰难梭菌)可以刺激肠黏膜大量分泌黏液,同时小肠绒毛细胞受到毒素的作用会启动多种死亡机制,细胞损伤时产生的多种炎性细胞因子,例如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin 1β, IL-1β)等炎症细胞因子会加剧细胞脱落的情况,致使小肠绒毛表面积减少,黏膜吸收能力降低,造成临床上的腹泻症状。在此过程中,原本机体内受到严格调控的免疫耐受和防御性炎症反应之间的平衡发生紊乱,导致肠道微生物种群生态进而出现紊乱,肠道固有层通透性发生变化,黏膜免疫系统反应异常,最终发展为炎症性肠病(IBD)。而本研究中对小鼠进行攻毒的产气荚膜梭菌培养上清,即含有病原菌的主要毒力因子——单独或协同作用的多种外毒素。本研究中小鼠腹腔剖检结果发现,小鼠肠壁因充满气体扩张而菲薄,肠壁黏膜出现血肿,呈明显的炎症状态。进一步采集小鼠肠道组织样品进行转录组测序分析,筛选差异表达基因,并对差异基因集进行基因功能富集分析, 进而研究产气荚膜梭菌引起坏死性肠炎的生物学过程中起关键作用的生物通路。
在C型产气荚膜梭菌分泌的多种毒素中,Beta1毒素对于坏死性肠炎的发病机制至关重要。许多上皮细胞系,包括猪和人肠上皮细胞对Beta1毒素的作用不敏感,而内皮细胞、血小板和不同的白细胞系则对Beta1毒素高度敏感。这表明Beta1毒素的作用可能是细胞类型特异性的,推测可能与细胞类型特异性受体的表达相关。同时也有研究表明,细胞膜上ATP门控的P2X purino receptor 7(P2X7)可能是Beta1毒素的潜在受体,Beta1毒素与靶细胞上的P2X7受体的结合可诱导ATP 从Pannexin 1通道快速释放。释放的ATP将进一步刺激Beta1毒素与内皮细胞膜的结合和寡聚体形成,促进毒素的成孔活性。在本研究中,GO注释的生物学过程中,C59-2培养上清处理组小鼠肠组织中的G蛋白偶联核苷酸受体活性及G蛋白偶联嘌呤核苷酸受体活性显著上调,提示毒素可能通过结合P2Y受体引起炎性反应,破坏肠道屏障,导致肠道损伤。而C型产气荚膜梭菌的主要致死性毒素即为Alpha及Beta1毒素,作者也利用Beta1毒素单克隆抗体检测证实了C59-2培养上清中含有大量的Beta1毒素。产气荚膜梭菌所引起的肠毒血症也是业界所关注的问题之一,弥散性血管内凝血(DIC)是脓毒症的常见并发症,由于伴随的血栓发炎和微血管通透性变化而严重影响患者的预后。P2X7受体通过ERK1/2信号通路介导脓毒症幼鼠大脑皮质中NLRP3/ Caspase1相关的细胞焦亡,与脓毒症相关性脑病相关。利用RNAi技术沉默卫星神经胶质细胞的P2X4受体(P2X家族),可以减轻人类免疫缺陷病毒(HIV)表面毒性颗粒gp120所引起的靶细胞Caspase1活化以及IL-1β、IL-18等炎性因子的释放。因此推测,针对P2X家族的靶点药物有望成为治疗Beta1毒素所致的相关疾病的治疗手段。
在新生儿坏死性小肠结肠炎(一种新生儿炎症性肠道疾病)的体内模型中发现,TNF-α通过丝裂原活化蛋白激酶1 (mitogen-activated protein kinase 1, MAPK1)/细胞外调节蛋白激酶2(extracellular regulated protein kinases2, ERK2)-MAPK3/ERK1途径诱导自噬,从而抑制细胞增殖并促进细胞凋亡,进而促进炎症性肠道疾病的发展。且肠道上皮细胞会由于细胞膜上的Toll 样受体(Toll-like receptors, TLR)等模式识别受体因肠道菌群的变化而激活,进而分泌β-防御素。本研究的KEGG通路富集分析结果与其相符,显示产气荚膜梭菌培养上清处理组小鼠肠组织中的TNF信号通路、IL-17信号通路、p53信号通路、FOXO信号通路、Toll样受体信号通路,NF,κB信号通路等炎性相关信号通路显著富集,且在这些通路中NF-κB抑制剂α(NF-kappa-B inhibitor alpha,Nfkbia)和趋化因子CXC配体2(C-X-C motif chemokine 2,Cxcl2)显著表达上调。目前,随着对TNF的深入研究,确定其为炎症反应的关键调节因子。TNF与被称为TNFR1和TNFR2的两种受体相互作用,能够在细胞和组织上差异表达并启动不同以及相互重叠的信号转导途径。这些信号级联导致一系列的细胞反应,包括细胞存活、分化、增殖、迁移和死亡。血管内皮细胞可通过发生许多促炎变化对TNF作出反应,导致白细胞黏附增加,经内皮迁移和血管渗漏促进血栓形成。并且,TNF在炎症中的核心作用已通过阻断其作用的药剂治疗一系列炎性疾病的能力得到证明,包括炎症性肠病和银屑病等。另外,IL-17家族能够与其对应的受体相互作用并激活下游信号通路,如NF-κB以诱导许多促炎介质的分泌,包括IL-6、TNF-α和IL-1β。而NF-κB激活和IL-1β的高表达是细胞焦亡的关键特征,提示人们在后续的关于产气荚膜梭菌毒素致病机理的研究中需要关注细胞焦亡在肠道损伤中的作用。
细胞焦亡在炎性机制相关的宿主抗感染过程中是一把“双刃剑”:一方面,细胞焦亡可激活细胞内在的死亡机制,释放炎性因子,清除病原体,防止感染;另一方面,过度的IL-1β和IL-18释放则可导致炎症的失控及机体病理状态的发生。IL-1β在炎性疾病中作用也受到广泛关注,其病理性的产生可引起许多表现不同的炎症疾病,甚至可激发致机体休克的细胞因子风暴; 近年的大量的研究表明,IL-1β信号传导似乎在介导肠道炎症中发挥着主导作用,肠道生态失调可以通过IL-1β依赖性方式诱导骨髓炎,阻断IL-1β的产生可改善艰难梭菌和鼠伤寒沙门菌引起的肠炎;产生的IL-1β和IL-18还可以作用于细胞上的IL-1家族受体,进而激活更强的免疫调控以及适应性免疫应答。鉴于这两种细胞因子都是重要的免疫调节剂,如果不加以控制,它们在不同类型细胞中的高水平表达可能会对机体造成灾难性的后果。目前,多项研究认为,抑制细胞焦亡产生的终产物(成熟的IL-1β和IL-18)的过度表达对一些临床疾病具有治疗潜力。例如,Glyburide是一种通过抑制胰腺β细胞中ATP敏感的K通道治疗Ⅱ型糖尿病的药物,还可以通过特异性抑制NLRP3的成熟而抑制IL-1β的产生。Parthenolide是一种天然的植物倍半萜内酯,已被广泛用作治疗各种炎症性疾病,且副作用极小,可以通过影响NLRP3、NLRP1和NLRC4等炎性小体的组装而抑制Caspase1的活化。细胞焦亡的诱发因素之一,是细胞内K水平的降低,因此调节K水平也是治疗干预的目标。该过程受P2X7的控制,目前已开发出P2X7的小分子抑制剂(AZD9056)并在人体中进行了测试,经治疗后的类风湿关节炎患者的炎性症状有明显的临床改善。因此,在产气荚膜梭菌引起的慢性肠炎等疾病中是否可以NLRP3炎性小体为靶点进行治疗,阻止过度的细胞因子释放,缓解随之而来的组织破坏有待进一步的研究。
4 结 论
本研究制备C型产气荚膜梭菌分泌的外毒素,感染BALB/c小鼠,通过分析小鼠肠道组织转录组测序数据,并利用q-PCR 进行了验证,结果表明,C型产气荚膜梭菌外泌毒素侵入机体时,通过激活TNF等关键炎性信号通路以及NLRP3炎性小体信号通路造成肠道发生炎性损伤甚至坏死,进而引起动物的死亡。本研究结果将为产气荚膜梭菌病的致病机理研究提供理论基础,同时为寻找该病的治疗靶点提供新的思路。
