纤维亚麻LuNAC10基因克隆及表达分析
2022-10-28贾也纯吴广文袁红梅卜明琪贺泽霖倪洪涛
贾也纯,吴广文,袁红梅,卜明琪,贺泽霖,倪洪涛
(1.黑龙江大学农学院,哈尔滨 150080;2.黑龙江省农业科学院经济作物研究所,哈尔滨 150086)
转录因子(Transcriptiong factor,TF)是可特异性结合顺式作用元件,通过激活或抑制基因转录,调控生物胁迫响应及生长发育、激素调节等多种生命活动的特异蛋白。其中NAC(NAM,ATAF1/2和CUC2)是植物转录因子中规模最大一类,按蛋白结构分为6组:ANAC034、TIP、ONAC4、SNAC、SND和NAM/CUC3,主要参与植物生长发育、防御反应和激素调节等,尤其在植物细胞次生壁合成中发挥关键调控作用[1-3]。目前,根据植物转录因子数据库(http://planttfdb.gao-lab.org/)数据统计,已从166个物种中鉴定得到19 997个植物NAC基因,在拟南芥(Arabidopsis thaliana)、棉花(Gossypium hirsutum)和毛果杨(Populus trichocarpa)中分别鉴定得到138、306、289个NAC家族成员,在亚麻(Linum usitatissimumL.)中鉴定得到191个NAC家族成员。
近年来,研究发现多个NAC基因在植物细胞次生壁形成中发挥重要调控作用。在拟南芥中,NAC转录因子VND1-7(VASCULAR-RELATED NAC-DOMAIN)和NST1-3(NAC SECONDARY WALL THICKENING PROMOTING FACTOR)以及SND1-5(SECONDARY WALL-ASSOCIATED NAC DOMAIN)同次生壁合成相关。在拟南芥中,SND1/NST3及其同源蛋白NST1、NST2、VND6、VND7是调控纤维细胞次生壁合成的一级主开关,直接调控参与次生壁加厚的下游转录因子,如SND2、SND3、MYB103、MYB85、MYB52、MYB54、MYB69、MYB42、MYB43、MYB20和KNAT7等[4]。AtSND2、AtSND3在调控网络中位于第二层次,调控次生细胞壁纤维素、半纤维素和木质素等不同组分生物合成[4-6]。Steven等以SND2过表达转基因拟南芥为材料与野生型进行差异表达谱分析发现,CesA8、Myb103及启动次生壁形成信号转导相关基因上调表达[7]。过表达SND2、SND3基因对次生壁增厚影响显著;SND2、SND3基因抑制表达则显著减少纤维细胞次生壁增厚[8]。
纤维亚麻为一年生草本韧皮纤维作物。纤维细胞发育经分化起始、伸长、次生细胞壁增厚和脱水成熟等4个阶段[9-10]。次生细胞壁是植物细胞停止生长后,在初生细胞壁内侧继续积累的细胞壁层。次生细胞壁增厚期是纤维强度形成关键时期,次生细胞壁厚度决定亚麻纤维强度,因此,深入开展次生壁合成调控机制研究对纤维作物品质改良具有科学意义[11]。目前,针对次生壁合成调控机制研究主要集中在拟南芥、毛果杨、棉花等模式植物中,在亚麻中研究较少,分子机理尚不清楚。前期通过亚麻转录组分析筛选到1个NAC10基因(Lus10013967),该基因是拟南芥SND3同源基因,在快速生长期该基因表达量为苗期8.05倍,其表达模式与次生壁纤维素合酶LuCesA8A基因相似,推测该基因可能在亚麻纤维发育及次生壁合成调控中发挥重要作用。
本研究进一步以高纤亚麻品种“Diana”为材料,从亚麻基因组中克隆得到LuNAC10基因,并作生物信息学分析。利用荧光定量PCR分析该基因在亚麻不同发育时期以及不同组织部位表达模式,研究结果将为亚麻纤维细胞次生壁合成调控机理研究提供理论依据。
1 材料与方法
1.1 材料与试剂
本研究选用高纤亚麻品种“Diana”,种植于黑龙江省农业科学院国家现代农业示范区,常规田间管理。分别在快速生长后期(最终株高的80%)分别取茎上部、中部、下部各三分之一、根、叶等5个部位并在苗期(4对真叶展开)、枞型期(最终株高的10%)、快速生长早期(最终株高的30%)、快速生长期(最终株高的50%)、现蕾期(50%植株可见花蕾)、花期(50%植株花开放)、绿熟期(蒴果未成熟、茎秆呈绿色)以及工艺成熟期(1/3蒴果成熟呈黄褐色,茎杆变成黄色)取茎中部三分之一。采样后迅速于液氮冷冻,保存于-80℃,提取RNA用于基因荧光定量表达分析及纤维素含量分析。
RNA提取试剂盒(购自天根生化科技有限公司);反转录试剂盒(购自天根生化科技有限公司);PCR聚合酶(购自翌圣生物科技股份有限公司);pMD18-T载体(购自康为世纪生物科技有限公司);植物纤维素含量ELISA检测试剂盒(购自齐一生物科技上海有限公司);引物合成和基因测序交由上海生工生物工程技术服务有限公司完成。
1.2 方法
1.2.1LuNAC10基因扩增
提取样品总RNA,提取过程参照试剂盒说明书。提取1μg RNA,在20μL试剂反应体系下,作cDNA反转录合成。并根据亚麻LuNAC10基因(Lus10013967)CDS全长序列,通过Primer Premier 5.0软件设计基因特异性引物,引物序列为LuNAC10F:5′ATGACGACGTGGTGCAATA ATG 3′,LuNAC10R:5′TCACTTCAGTTCCTTTGAT GATCCT 3′。以cDNA为 模 板,作RT-PCR基 因扩增。扩增体系为cDNA模板1μL、KOD FX Neo(1 U·μL-1)1μL,2×PCR Buffer for KOD FX Neo 25μL、dNTP(2 mmol·L-1)10μL、2μL 5′及2μL 3′primer(10μmol·L-1),最终补水至50μL。扩增程序:于98℃高温5 min预变性;之后98℃变性10 s,60℃退火30 s,68℃延伸1 min 30 s,扩增30个循环,最后68℃延伸5 min。切胶回收将PCR扩增产物纯化后,连接至pMD18-T载体作测序分析。
1.2.2 序列分析方法
利用ProtParam在线分析工具(http://web.expasy.org/protparam/)分析蛋白分子质量和等电点;采用NetPhos 3.1在线软件(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白磷酸化位点;通过PSORT在线软件(http://psort.hgc.jp/form.html)分析蛋白亚细胞定位;采用TMHMM Server v.2.0分析工具(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白质跨膜结构域;通过ProtScale在线软件(http://web.expasy.org/protscale/)分析氨基酸序列疏水性/亲水性;利用GOR4(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_gor4.html)预测蛋白二级结构;通过Smart在线软件(http://smart.embl-heidelberg.de/)分析蛋白质保守结构域。利用ClustalW(1.83)及Genedoc软件,比对同源相似基因序列,利用MEGA 5.0软件构建进化树。
1.2.3 荧光定量表达分析
选取亚麻LuEF1A和LuGAPDH作为内参基因,作基因荧光定量表达分析,LuNAC10、LuCESA3A、LuCESA4、LuCESA8A及内参基因荧光定量引物序列如表1所示,将反转录产物稀释至同一浓度,利用SYBR PremixEx TaqTM(TaKaRa)试剂盒作PCR扩增。12μL反应体系,其中包含:上、下游引物(10μmol·L-1)各0.25μL,2×SYBR Green Realtime PCR Master mix 6μL,cDNA 1μL,ddH2O 4.5μL。各基因分别重复3次,扩增程序为:预变性94℃30 s,变性94℃12 s,退火56℃45 s,延伸72℃45 s,共40个扩增循环,使用2-ΔΔCt法比较和确定各基因相对表达量。
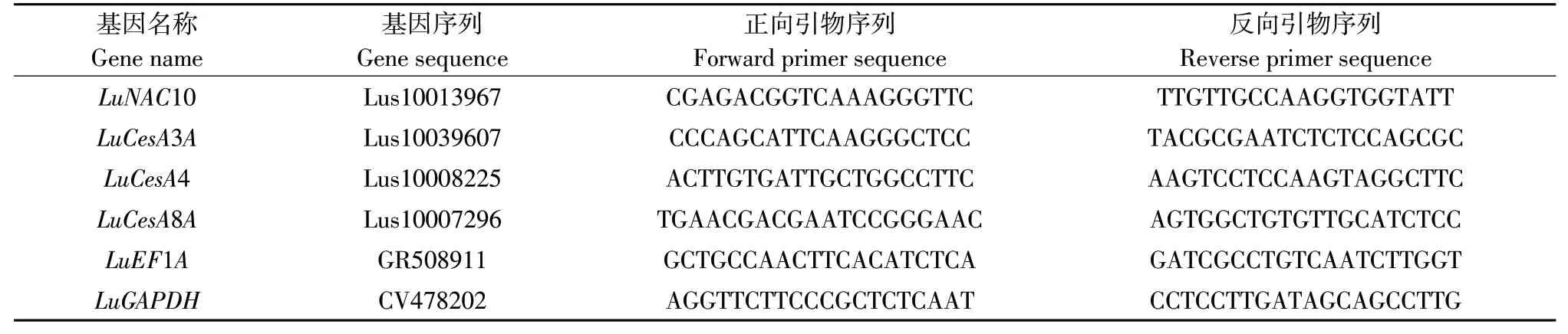
表1 Real-time PCR引物序列Table 1 Real-time PCR primer sequences
1.2.4 纤维素含量测定
将不同组织部位及不同发育时期试验材料置于烘箱中于80℃高温烘干,研磨呈粉末经40目筛过滤。利用植物纤维素含量检测ELISA试剂盒(齐一,上海),采用蒽酮法测定纤维素含量,具体操作步骤参照说明书。
1.2.5 相关性分析
利用SPSS 16.0软件计算不同变量间Pearson相关系数,分析相关性。P<0.05为显著相关,P<0.01为极显著相关。
2 结果与分析
2.1 亚麻LuNAC10基因扩增
以高纤亚麻品种“Diana”的cDNA为模板扩增Lu-NAC10基因,扩增后利用1%琼脂糖凝胶作电泳检测,结果见图1,可见一条特异性条带。之后切胶回收纯化PCR扩增产物,将提取物克隆至pMD18-T载体,测序分析,经测序该基因长度为978 bp,编码325个氨基酸,核苷酸及氨基酸序列见图2。
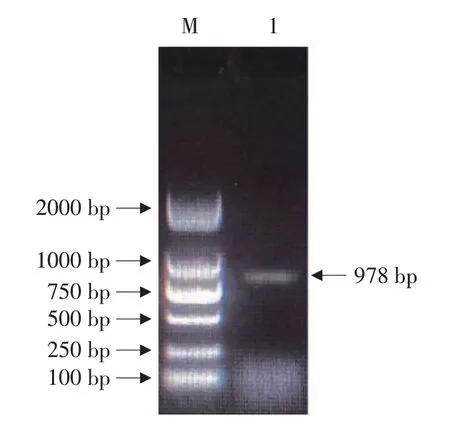
图1 LuNAC10基因克隆电泳结果Fig.1 Electrophoresis results of LuNAC10 gene clone

图2 LuNAC10基因全长核苷酸序列及编码氨基酸序列Fig.2 Full length nucleotide sequence and coding amino acid sequence of LuNAC10 gene
2.2 亚麻LuNAC10基因序列分析
LuNAC10蛋白编码325个氨基酸,其中甘氨酸(Gly)含量最高,为12.3%,其次为丝氨酸(Ser),占比9.2%。蛋白分子质量为35.53 ku,蛋白理论等电点为6.85,负电荷残基(Asp+Glu)数为38个,正电荷残基(Arg+Lys)数为36个,不稳定系数为38.10,属于稳定蛋白。脂肪族氨基酸指数为56.31,蛋白亲水性为-0.787,为亲水蛋白。该蛋白无跨膜结构。通过NetPhos 2.0预测LuNAC10氨基酸序列磷酸化位点发现,该蛋白有19个Ser、12个Thr和4个Tyr可能为蛋白激酶磷酸化位点(见图3)。
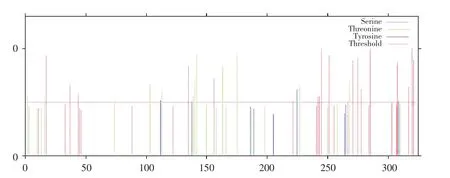
图3 LuNAC10蛋白氨基酸序列磷酸化位点预测Fig.3 Prediction of phosphorylation sites of LuNAC10 amino acid sequence
在线软件PSORT分析该蛋白亚细胞定位情况,预测该蛋白位于细胞核内。SOPMA分析软件预测该蛋白二级结构,该蛋白由α-螺旋(7.69%)、不规则盘绕(30.15%)、延伸链(62.15%)组成(见图4)。SMART分析LuNAC10蛋白结构域,发现其含有1个DNA保守结合域NAM及2个低复杂结构域(见图5)。
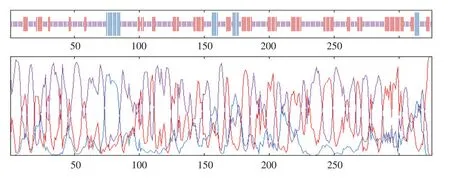
图4 LuNAC10蛋白二级结构预测Fig.4 Prediction of secondary structure of LuNAC10 protein

图5 LuNAC10蛋白保守结构域分析Fig.5 Analysis of the conserved domain of LuNAC10 protein
2.3 LuNAC10基因多重序列比对及系统进化分析
亚麻LuNAC10与克莱门柚(Citrus clementina)、棉花(Gossypium raimondii)、葡萄(Vitis vinifera)、木薯(Manihot esculentaCrantz)、毛果杨(Populus trichocarpa)、桃(Prunus persica)、可可树(Theobroma cacao)及拟南芥(Arabidopsis thaliana)NAC10作蛋白多重序列比对(见图6),不同物种蛋白序列在氨基酸60~258之间高度保守,N端、C端差异较大,说明NAC10基因在进化过程中具有一定保守性。将亚麻LuNAC10与101个拟南芥NAC蛋白作进化分析(见图7),该蛋白与拟南芥SND2、3、4、5聚到一个分支,与SND3蛋白进化关系最近,蛋白相似性为83.4%。

图6 NAC10蛋白氨基酸序列多序列分析Fig.6 Multi-sequence analysis of amino acid sequence of NAC10 protein
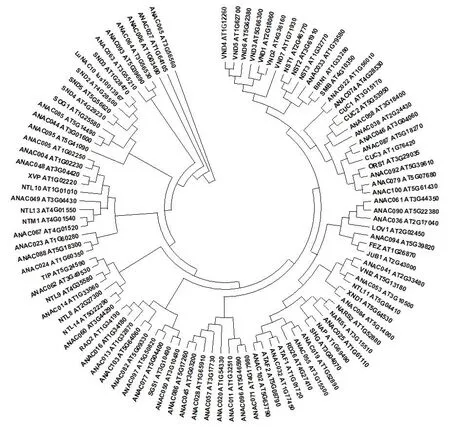
图7 亚麻LuNAC10与拟南芥NAC蛋白分子进化关系Fig.7 Molecular evolution relationship of LuNAC10 and NAC protein in Arabidopsis thaliana
2.4 LuNAC10基因表达分析
利用qRT-PCR技术分析亚麻不同组织部位和发育阶段LuNAC10基因表达量,以苗期(S1)为对照样本计算基因表达量,根据Log2Foldchange值作图(见图8)。结果表明,在快速生长后期不同组织部位,该基因表达量由高到低依次为茎下部>根>茎中部>茎上部>叶,在茎下部表达量最高,叶片中表达量最低。不同发育阶段,LuNAC10基因在苗期表达量较低,随发育进程推进,基因表达量逐渐升高,至快速生长期表达量达到最高,其表达量为苗期8.85倍。进入现蕾期、花期、绿熟期基因表达量逐渐下降,至工艺成熟期基因表达量降至最低。同时,对参与初生壁纤维素合成的LuCesA3A及参与次生壁纤维素合成的LuCesA4、LuCesA8A基因分析基因表达量(见图8),结果表明,LuCesA4、Lu-CesA8A基因表达趋势与LuNAC10基因相近。

图8 亚麻不同发育时期、不同组织部位中基因相对表达量Fig.8 Relative expression level of genes in different developmental stages and different tissues of flax
进一步利用SPSS 16.0软件分析LuNAC10与LuCesA3A、LuCesA4、LuCesA8A基因表达量相关性(见表2)。LuNAC10与LuCesA3A基因表达量相关系数为0.401,未达到显著水平(P>0.05);LuNAC10与LuCesA4、LuCesA8A基因表达量呈极显著正相关(P<0.01),相关系数分别为0.989和0.987。

表2 基因表达量相关性分析Table 2 Correlation analysis of the genes expression level
2.5 基因表达量与纤维素含量相关性分析
不同组织部位及不同发育时期茎中部亚麻纤维素含量见图9。
由图9可知,在快速生长后期不同组织部位,茎下部纤维素含量最高,为490.81 mg·g-1,叶部纤维素含量最低,为96.99 mg·g-1。在茎部不同部位,纤维素含量茎下部>茎中部>茎上部。不同发育时期茎中部,苗期纤维素含量最低为305.09 mg·g-1,随发育时期推进,纤维素含量逐渐升高,至花期、绿熟期纤维素含量达到最高,为555.04~556.98 mg·g-1,进入工艺成熟期纤维含量下降至481.91 mg·g-1。利用SPSS 16.0软件分析LuNAC10基因表达量与纤维素含量相关性,相关系数为0.759,相关性达到极显著水平(P<0.01)。

图9 亚麻不同发育时期、不同组织部位纤维素含量Fig.9 Fiber contents in different developmental stages and different tissues of flax
3 讨论
次生细胞壁合成是一个复杂生物学过程,NAC类转录因子在合成过程中发挥重要调控作用。李媛等发现毛白杨PtrNAC128过表达转基因株系中,植株木质部细胞层层数增加,次生木质部增厚,同时PtrNAC128基因过表达显著提高木质素和纤维素合成途径关键酶基因及部分次生壁相关NAC、MYB转录因子表达[12]。在白桦中,BpNAC012对白桦次生壁形成至关重要,BpNAC012表达抑制后,茎纤维中次生壁沉积显著降低,而过表达Bp-NAC012诱导茎表皮中次生壁异位沉积[13]。在桉树中过量表达拟南芥AtSND2增加桉树纤维细胞次生壁厚度[7]。在玉米中,Zm NAC87是拟南芥SND3同源基因,该基因在坚秆自交系和非坚秆自交系间差异表达,推测该基因与玉米茎秆强度有关,调控玉米茎节间次生细胞壁发育[14]。本研究从亚麻中克隆得到LuNAC10基因,LuNAC10蛋白与拟南芥SND2、3、4、5聚到一个分支,与SND3蛋白进化关系最近,蛋白相似性为83.4%,根据同源性分析推测,LuNAC10基因可能在亚麻纤维细胞次生壁合成中发挥调控作用。
在拟南芥中,SND3基因在纤维和木质部中优势表达[4,15]。苜蓿MTR_8g102240基因是拟南芥SND3基因同源基因,该基因在不同发育时期差异表达,在现蕾期表达量较高,在盛花期表达量较低[16]。杉木ClNAC1、ClNAC6基因与拟南芥SND2/3基因具有较高同源性,在木质化茎中相对表达量较高,且主要在木质化茎木质部中优势表达[17]。本研究中LuNAC10基因在亚麻木质化程度较高的茎下部表达量最高,根部次之,叶部表达量最低。茎中部LuNAC10基因随发育进程推进表达量逐渐升高,至快速生长期表达量达到最高,进入生殖生长期表达量逐渐下降,与以上结果一致。亚麻LuNAC10基因表达量与纤维素含量呈极显著正相关(P<0.01),相关系数为0.759,推测该基因可能同时参与调控纤维素合成过程。
研究发现,拟南芥中,AtCesA1蛋白与AtCesA3、AtCesA6蛋白共同组成纤维素合酶复合体,同初生细胞壁合成相关,AtCesA4蛋白与AtCesA7、AtCesA8蛋白则参与次生细胞壁合成[18]。于莹等发现亚麻中LuCesA8基因与次生壁细胞生长、次生壁加厚沉积密切相关[19]。本研究对前期亚麻转录组数据作LuCesA8A基因共表达网络分析,发现与LuCesA8A基因共表达的转录因子NAC10、NAC12、NST1、SND2、MYB46、MYB103在拟南芥中均曾被报道与次生壁合成调控相关[20]。在拟南芥中,At-MYB46直接结合纤维素合酶AtCesA4、AtCesA7、At-CesA8基因启动子并激活其表达[21]。过表达棉花Gh-SND2基因拟南芥植株与野生型相比,AtCesA4基因在转基因株系花序茎和主根中均显著上调表达[22]。棉花GhFSN2基因与拟南芥NST1-3基因在进化上处于同一分支,双荧光素酶报告基因分析结果表明,GhFSN2激活GhCesA4-3和GhCesA7-1基因启动子活性[22]。本研究中,亚麻LuNAC10基因与次生壁纤维素合酶LuCesA4、LuCesA8A基因共表达,相关性达极显著水平(P<0.01)。LuNAC10蛋白是否直接调控LuCesA4、LuCesA8A基因表达,LuNAC10与共表达基因MYB46、SND2、NST1等转录因子调控关系,有待进一步深入研究。
