一株雏鹅星状病毒分离鉴定及其致病性分析
2022-10-28刘春朋欧溢泉郑钊武钟雅静马婷婷王宝东魏文康
刘春朋,王 萱,欧溢泉,郑钊武,钟雅静,马婷婷,王宝东,付 晶,魏文康
(1.仲恺农业工程学院动物科技学院,广州 510225;2.广东省农业科学院农业生物基因研究中心,广州 510640;3.辽宁省农业发展服务中心,沈阳 110032)
近年来,鹅养殖数量快速增加,雏鹅痛风与星状病毒相关性研究报道日益增多。星状病毒属星状病毒科,是一种非包膜RNA病毒,依据其基因型可划分为两类,分别是哺乳动物星状病毒属和禽星状病毒属[1-2],哺乳动物星状病毒属主要感染人、牛和羊等,腹泻是其主要症状之一;禽星状病毒属包括3个种,分别为禽类1~3型星状病毒(AAstV1~AAstV3),其中,AAstV1含有火鸡1型星状病毒;AAstV2含有禽1型肾炎病毒和禽2型肾炎病毒;AAstV3含有火鸡2型星状病毒和鸭1型星状病毒。部分报道的禽星状病毒株仍未见分类。Donato等依据现有分类原则和标准,将未经分类的禽星状病毒分为4个种,分别命名为AAstV4~AAstV7。其中,AAstV4包含鸡星状病毒等;AAstV5包含鹤肾炎病毒等;AAstV6包含斑鸠鹤星状病毒等;AAstV7包含野鹤星状病毒等[3]。鸭星状病毒于1965年在英国被首次报道,是禽星状病毒属中最早被发现的病毒,随后有科学家通过电子显微镜技术鉴定出一株鸭星状病毒[4]。2009年,我国某发病鸭厂首次分离得到鸭星状病毒[5]。2017年2月,山东、安徽和辽宁等地均爆发鹅星状病毒传染病,主要感染对象为2周龄以内雏鹅。临床解剖发现,大部分病鹅内脏器官表面及关节腔内附着大量尿酸盐沉积,伴随肾脏肿大发白以及脾脏肿大等病理症状,发病率高达90%,死亡率达50%,对养鹅业造成巨大冲击[6-7]。孙敏华认为鹅星状病毒是引起雏鹅痛风病主要致病病原,自制疫苗免疫存在免疫无效或低效防治情况[8]。为进一步了解不同地区星状病毒毒株之间遗传关系,本研究对广东清远金羽丰国家保种鹅场引发雏鹅痛风病原进行分离、鉴定及致病性分析,为雏鹅痛风病防治提供参考。
1 材料与方法
1.1 临床样本和实验动物来源
临床样品痛风雏鹅由广东清远金羽丰国家保种鹅场提供,雏鹅解剖后可见脾脏肿大,肾脏肿大且发白,肝脏表面有尿酸盐沉积。采集尿酸盐沉积明显的心脏、肝脏、肾脏和脾脏组织,一部分固定于福尔马林溶液中用于组织病理学观察,一部分于-80℃超低温冰箱保存,用于PCR鉴定。10日龄健康狮头鹅鹅胚和1日龄健康雏鹅均由广东省清远金羽丰鹅业有限公司提供。
1.2 主要试剂耗材
Viral RNA Kit试剂盒(购自美国OMEGA试剂有限公司),PrimeScript RT Master Mix(购自宝日医生物技术有限公司),DNA Marker(购自天根生化科技有限公司),2×TaqPCR StarMix(购自北京康润诚业生物科技有限公司),核酸染料、无酶离心管、50×TAE溶液(购自白鲨生物科技-上海桥星贸易有限公司)。
1.3 主要仪器
生化培养箱、低温高速离心机和PCR仪(购自杭州博日生物科技有限公司),电泳仪和组织打磨器(购自德国IKA-WEREGMBH&Co.KG公司),紫外凝胶成像系统(购自上海天能生命科学有限公司),-80℃超低温冰箱(购自赛默飞世尔科技公司)。
1.4 病料采集及处理
等量选取病料肝脏、肾脏和脾脏,合计2 g,加无菌PBS溶液研磨制成20%匀浆,匀浆经5 000 r·min-1离心10 min后将其置于-80℃超低温冰箱冷冻20 min,随后立即解冻,反复冻融3次,最后将上清液置于-80℃超低温冰箱保存待用。
固定于福尔马林溶液中的内脏器官(心脏、肝脏、肾脏和脾脏),经脱水、透明、包埋、切片等处理后,采用苏木素伊红染色法(HE)对其染色,显微镜下观察组织病理变化情况。
1.5 痛风雏鹅中病原确定
1.5.1 引物设计与合成
针对我国鹅群常见病毒性传染病,检测痛风雏鹅中可能存在的常见病原鹅星状病毒(GAstV)、鹅呼肠孤病毒(GRV)、鹅腺病毒(EDS),根据文献报道设计相关特异性引物[9-11](见表1),送上海生工生物工程技术服务有限公司合成。

表1 引物序列Table 1 Primers sequences
1.5.2 病毒核酸提取
参考文献[12]方法提取病料中病毒核酸,利用TaKaRa反转录试剂盒制备cDNA,于-20℃冰箱保存。
1.5.3 常见病原PCR扩增和序列分析
参照文献[13]方法,对痛风雏鹅中可能存在常见病原进行PCR扩增,将星状病毒PCR阳性产物进行双向测序。测序结果上传至GenBank,通过BLAST功能进行序列同源性比对。
1.6 痛风雏鹅病原分离鉴定
将1.4制备获得的匀浆经0.22μm滤器过滤,并进行梯度稀释,稀释液终末浓度为匀浆浓度的100、10-1、10-2和10-3,该稀释液作为攻毒的病毒原液。病毒原液通过绒毛尿囊腔途径接种于10日龄鹅胚(每个浓度接种6个鹅胚),每个鹅胚接种0.2 mL,将接种后鹅胚放置于37℃孵化箱培养。每日观察鹅胚生理状态,记录接种24 h内死胚数量。接种96 h后,无菌条件下收集鹅胚,观察胚体是否发生病变,将胚体参考1.4中方法制备上清液,接种到新鹅胚中,观察鹅胚病理变化、活力及死亡情况。检测鹅胚中病原并对其进行序列分析。
1.7 动物回归试验
将24只2日龄体重相近、健康雏鹅随机分为对照组和攻毒组,1.6中10-2组尿囊液和10-1组胚液按照2∶1混合作为攻毒原液。对照组肌肉注射2 mL生理盐水;攻毒1组肌肉注射0.5 mL攻毒原液+1.5 mL生理盐水;攻毒2组肌肉注射1.0 mL攻毒原液+1.0 mL生理盐水;攻毒3组肌肉注射1.5 mL攻毒原液+0.5 mL生理盐水,分组前检测雏鹅健康性,确保未携带星状病毒。于雏鹅4日龄时进行攻毒,攻毒后第2、4、6天采集雏鹅泄殖腔拭子,检测排毒情况。每日观察雏鹅生理状态并称重。发现死亡雏鹅立即剖检,观察其内脏器官病理变化,采集尿酸盐沉积严重的肝脏、肾脏和脾脏,一部分固定于福尔马林溶液中用于组织病理学观察,一部分保存于-80℃超低温冰箱用于星状病毒PCR鉴定。
2 结果与分析
2.1 痛风雏鹅中病原确定
2.1.1 痛风雏鹅剖检
临床剖检时发现痛风雏鹅心脏表面有尿酸盐沉积,肝脏表面有明显尿酸盐沉积,肾脏发白肿大呈现明显的“花斑肾”示病症状、脾脏肿大且有少量出血斑(见图1)。
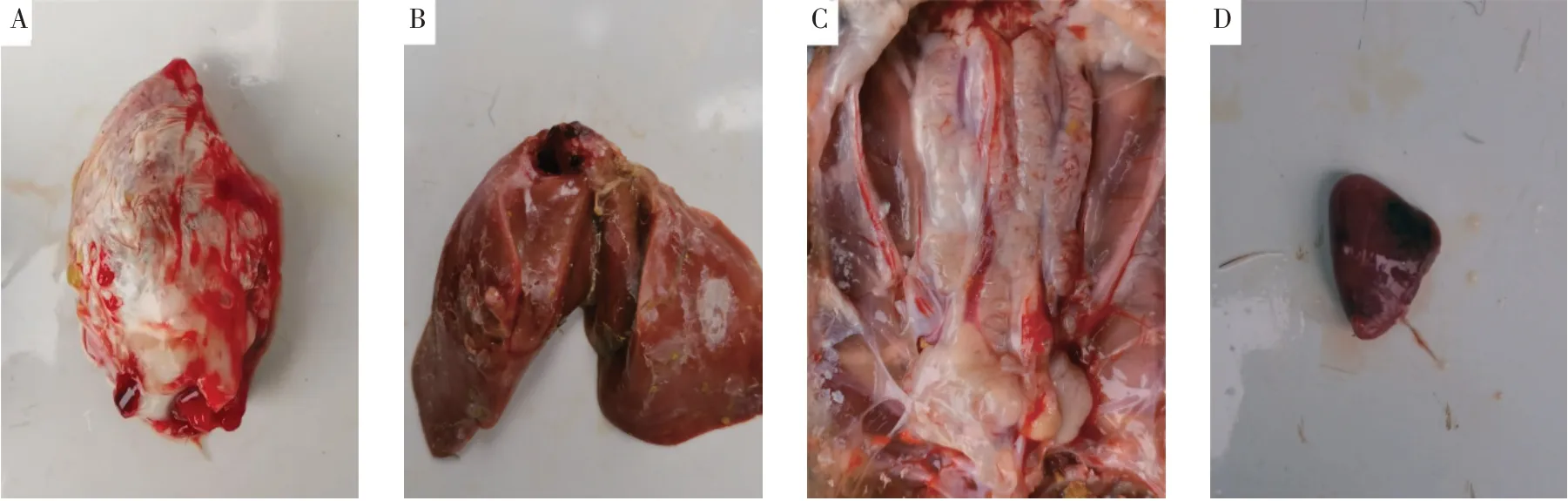
图1 痛风雏鹅剖检Fig.1 Clinical autopsy in gout goslings
2.1.2 痛风雏鹅组织病理学观察
对采集的痛风雏鹅内脏器官HE染色后进行组织病理学观察。发现尿酸盐沉积明显的器官如肾脏、脾脏、心脏和肝脏均发生不同程度病变损伤,如图2所示。肾脏切片观察可见肾间质增生,肾小球界限不明显,肾小管中有炎性细胞(见图A1、A2);肝脏组织中肝索结构不清,血管周围有炎症反应灶,且伴有大量胞浆中带红染颗粒的异嗜性粒细胞浸润(见图B1、B2);脾脏组织有少量尿酸盐结节(HE染色为粉红色),在脾脏实质细胞间有大量红染颗粒的异嗜性粒细胞浸润(见图C1、C2);心脏组织中心肌纤维排列紊乱,肿胀,可见少量炎性细胞(见图D1、D2)。由此可见雏鹅痛风病原可危害肾脏、肝脏、脾脏等主要代谢、解毒和免疫器官,与前人研究结果相同[14]。
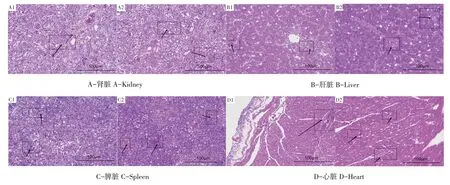
图2 痛风雏鹅组织病理学观察Fig.2 Pathological observation in gout goslings tissues
2.1.3 痛风雏鹅常见病原检查结果
如图3所示,在痛风雏鹅中仅扩增出与星状病毒GAstV预期长度一致条带,其余病毒均未扩增出预期条带。将星状病毒PCR阳性产物送至上海生工生物工程有限公司测序,将测序结果在GenBank上通过BLAST进行序列同源性比对,结果显示PCR扩增的星状病毒基因序列片段长度为492 bp,与Gen-Bank中报道鹅源性GAstV基因序列(MT150877.1)同源性高达99.80%。

图3 痛风雏鹅病原鉴定Fig.3 Pathogen identification in gout goslings
2.2 痛风雏鹅病原分离鉴定
2.2.1 鹅胚剖检结果
将2.1.3中检测出星状病毒阳性样本加入PBS溶液制成20%浓度匀浆经离心收集上清液作为病毒原液,以绒毛尿囊腔途径接种鹅胚,连续传至第2代后,鹅胚未发生死亡,但出现明显病理变化,如图4所示,胚体表面和脏器均出现明显出血点,肾脏肿大、水肿,绒毛膜尿囊膜增厚等现象。
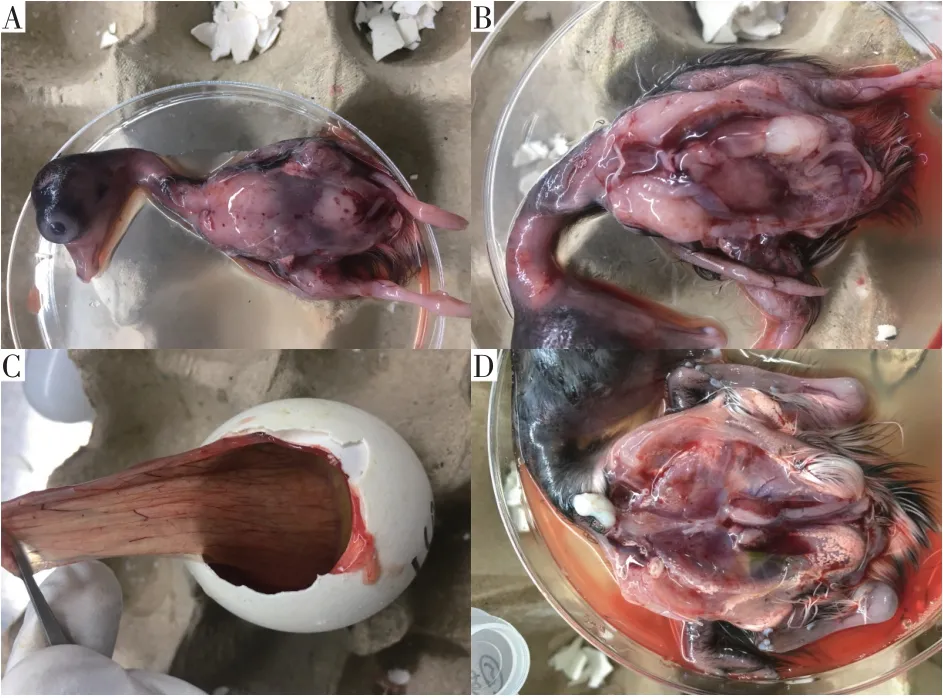
图4 攻毒鹅胚病理变化Fig.4 Pathological changes of virus inoculation goose embryo
2.2.2 鹅胚病原检测
将病毒接种两代后鹅胚全部处死(去除胚头)加无菌PBS溶液制成浓度为20%匀浆。对得到的匀浆液进行星状病毒(每组随机取2个鹅胚)定性检测。如图5所示,10-1和10-2组鹅胚尿囊液和胚液均检测到星状病毒,且胚液病毒含量高于尿囊液。因此,选取10-2组尿囊液和10-1组胚液混合液作为动物回归试验的攻毒原液。
将图5中星状病毒PCR扩增阳性产物送至上海生工生物工程有限公司测序。测序结果在GenBank上通过BLAST进行序列同源性比对,结果显示,各组鹅胚中星状病毒基因序列片段长度为462 bp,与GenBank中报道鹅源性GAstV基因序列(MT150877.1)同源性高达99.34%。初步证实该病毒分离株为星状病毒,命名为GDTF。

图5 攻毒鹅胚星状病毒随机检测结果Fig.5 Random test PCR results of virus inoculation goose embryo for GAstV gene
2.2.3 鹅胚病原序列分析
如图6所示,本试验分离得到的鹅源性星状病毒序列(GDTF)与Zhang等报道我国中部地区引起痛风症状的鹅星状病毒毒株(MW592379)聚成一个分支,说明二者遗传距离最近,与其他病毒遗传距离较远[15]。由此可见,导致该场雏鹅痛风的星状病毒是鹅源性星状病毒。

图6 GDTF与其他有关雏鹅痛风毒株系统进化树Fig.6 Phylogenetic tree of GDTF and other related gosling gout strains
2.3 动物回归试验
2.3.1 雏鹅健康性检测结果
攻毒前,对雏鹅进行鹅星状病毒定性检测,确保雏鹅无星状病毒污染。如图7所示,各组雏鹅泄殖腔拭子样品中未见鹅星状病扩增条带出现,即雏鹅均未携带鹅星状病毒。
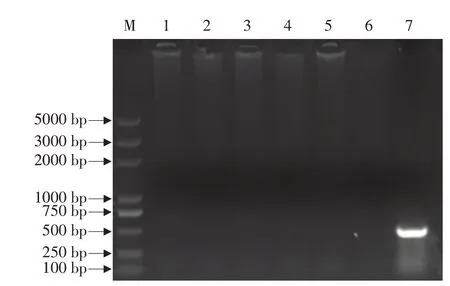
图7 健康雏鹅星状病毒PCR检测Fig.7 Astrovirus PCR detection in healthy goslings
2.3.2 鹅星状病毒攻毒雏鹅结果
试验期间,对照组雏鹅并未出现死亡或发病迹象,因此肌肉注射2 mL溶液对雏鹅健康无明显影响;攻毒1组在攻毒第8天出现示病症状,表现为关节肿大、消瘦、食欲不振、羽毛黯淡无光、精神萎靡、排出灰白色粪便等,如图8所示;攻毒2组在攻毒第5天,出现发病死亡雏鹅;攻毒3组雏鹅在试验期间未出现死亡或示病症状;攻毒组与对照组雏鹅日增重均差异不显著。上述结果说明鹅星状病毒对雏鹅有致病性。18只攻毒雏鹅中有2只死亡(攻毒2组),死亡率11.11%。
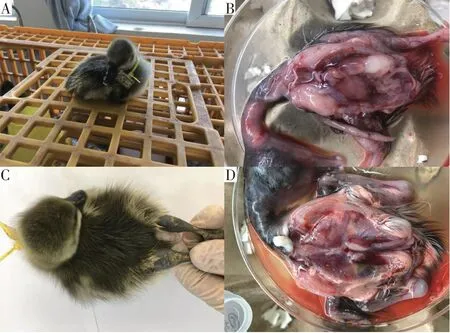
图8 发病雏鹅示病症状Fig.8 Symptoms of diseased goslings
2.3.3 鹅星状病毒攻毒雏鹅解剖结果
剖检2.3.2中死亡雏鹅发现,内脏器官有广泛尿酸盐浸润(心脏、肝脏、脾脏),肾脏肿大呈明显“花斑肾”,肠道、肌肉等非实质性组织出现尿酸盐沉积(见图9)。未死亡雏鹅虽无示病症状,但肾肿大,呈“花斑肾”变化。如图10所示,攻毒雏鹅心脏被沉积的尿酸盐包裹(见图10A),肝脏表面也有尿酸盐沉积(见图10B),胆囊表面有少量尿酸盐附着(见图10C),肾脏肿大(见图10D),脾脏肿大有白色坏死点(见图10E),肌胃被尿酸盐大面积附着(见图10F)。在攻毒组中随机抽取4只雏鹅采样,参照1.5.3中方法进行鹅星状病毒定性检测,检测结果见图11。
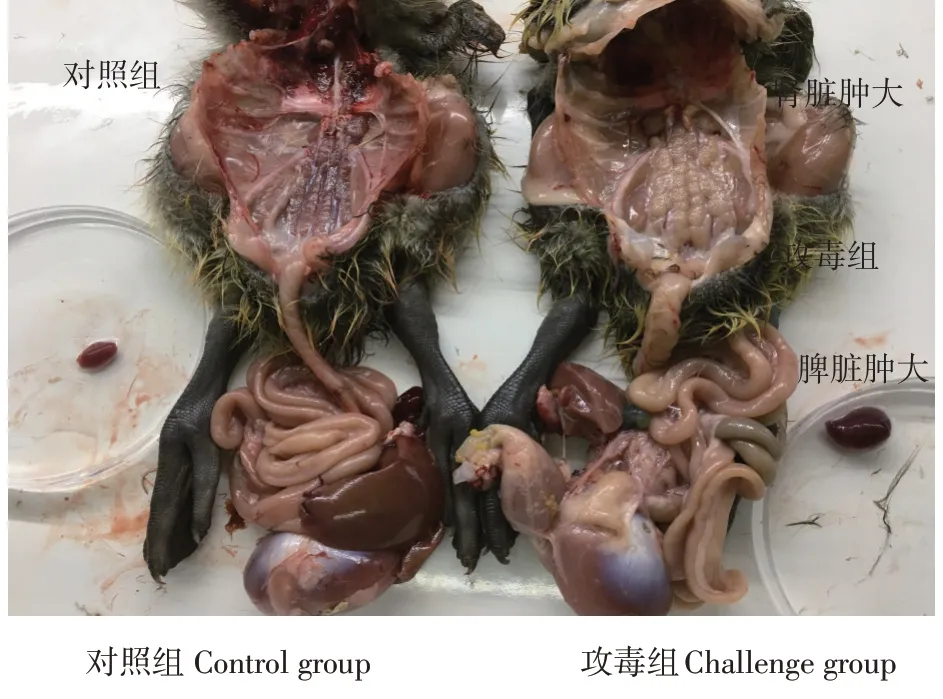
图9 鹅星状病毒攻毒雏鹅解剖结果Fig.9 Anatomical results of gosling infected with goose astrovirus
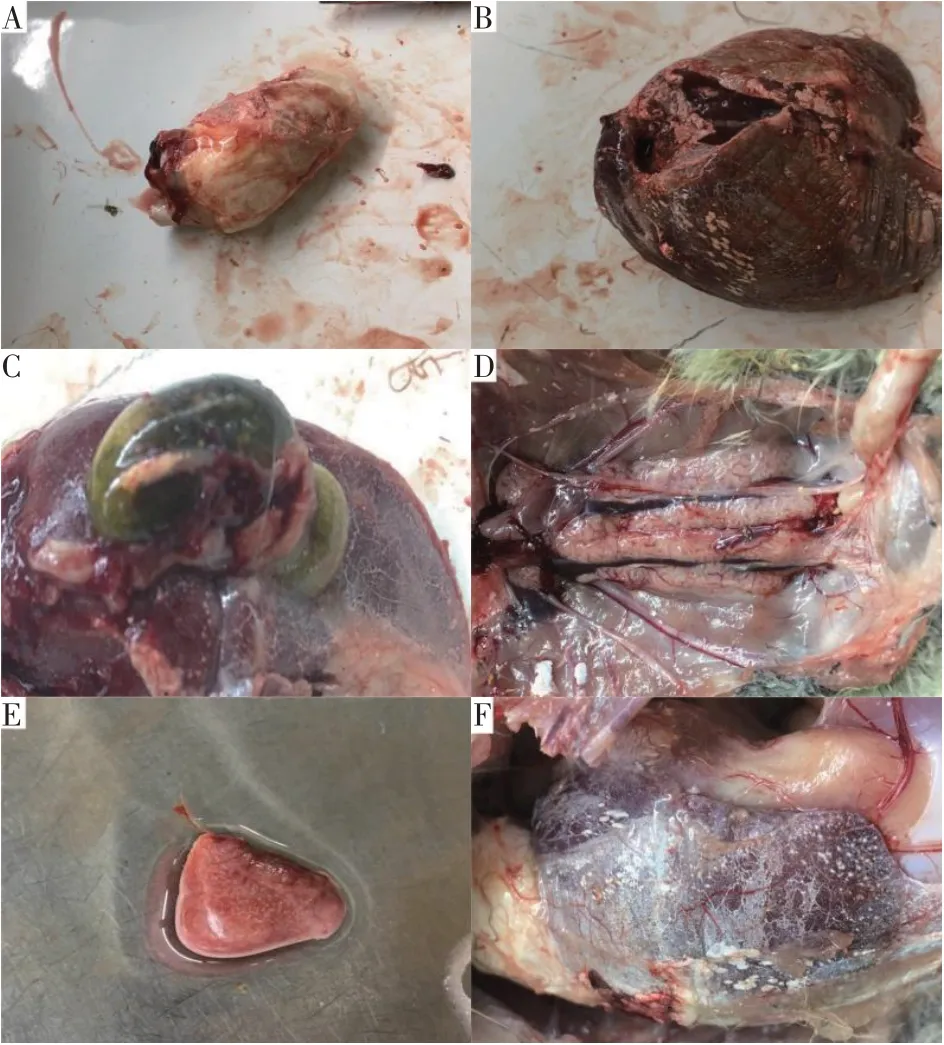
图10 攻毒雏鹅各脏器病变Fig.10 Diseases of various organs in virus inoculation goslings

图11 攻毒组雏鹅星状病毒检测结果Fig.11 Results of goslings in the virus inoculation group(GAstV)
将本次检测出星状病毒PCR阳性产物送至上海生工生物工程有限公司测序,测序结果显示本次攻毒病死雏鹅星状病毒基因序列片段长度为462 bp,与报道鹅GAstV基因序列(MT150877.1)同源性高达98.91%,与鹅场采集病料中鹅星状病毒基因序列也存在高度同源。
2.3.4 鹅星状病毒攻毒后雏鹅组织病理学观察
将2.3.3中病变严重脏器进行HE染色。从图12中可观察到雏鹅肾脏、脾脏及肝脏均出现病变,如淋巴细胞以及巨噬细胞等炎性细胞浸润,肾脏还可观察到多核巨噬细胞,与2.1.2从养殖场取得病料组织病理变化相似。
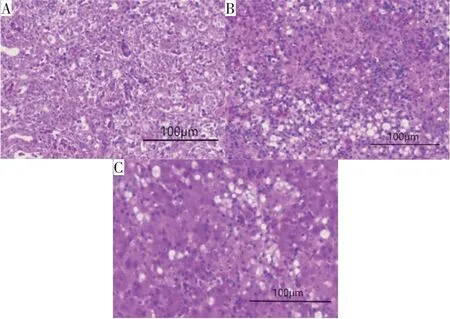
图12 雏鹅攻毒后肾脏、肝脏和脾脏组织病理学变化Fig.12 Histopathological changes in kidney,spleen and liver of experimentally infected goslings
3 讨论
王安平等研究结果表明,病毒感染是导致雏鹅痛风最主要因素[16]。本试验采集具有典型痛风症状雏鹅病料,从中分离鉴定得到1株鹅星状病毒,命名为GDTF。系统进化树分析表明,该病毒分离株与Zhang等[15]报道我国中部地区流行鹅星状病毒毒株(MW592379)遗传距离较近。因此,我国中部和南部地区发生、流行的雏鹅痛风可能是由同一型星状病毒感染引起,且该星状病毒已大范围传播。
雏鹅痛风对鹅养殖业危害较大,4~16日龄雏鹅是主要感染对象,日龄越小,发病率和死亡率越高。该病以关节肿胀,心脏、肝脏和肾脏等实质性器官出现尿酸盐沉积为典型症状[17-18]。本研究攻毒雏鹅剖检时也可见内脏器官有大量尿酸盐沉积。目前,普遍认为肾脏是鹅星状病毒的主要靶器官[19],推测可能是因肾脏排泄功能障碍,导致全身性尿酸盐沉积。从收集的病料和攻毒雏鹅的病理切片观察发现,肾脏、肝脏、脾脏、心脏等器官均发生不同程度炎症反应。说明鹅星状病毒对雏鹅具有广泛组织嗜性,引起器官炎症反应,导致雏鹅死亡[19]。
付新亮等指出,鹅星状病毒接种鹅胚后导致鹅胚100%死亡,接种后雏鹅死亡率达23%[20]。本研究将分离病毒株接种鹅胚后并未死亡,但出现明显病理变化。将分离病毒株接种于雏鹅,雏鹅死亡率为11.11%,说明该病毒分离株可通过鹅胚传染至雏鹅,且具有较强致病性。本研究鹅胚与雏鹅死亡率与其他文献报道有所区别,可能因病毒剂量、攻毒方法、雏鹅品种以及健康情况等因素存在一定差异。
星状病毒在我国分布地域广泛且宿主范围广[21-22],近年来,雏鹅痛风发病率持续升高,给我国肉鹅养殖业造成巨大经济损失[23-24]。当前,生产中常用“肾肿解毒”类药物促进尿酸排出,短暂缓解症状,但对发病中后期,尤其是当全群发病、出现死亡病例时,药物治疗效果较差[23]。目前关于雏鹅痛风致病机理尚不明确,缺乏有效商品化疫苗,雏鹅痛风防控存在难度。加强雏鹅饲养管理、做好生物安全工作,仍是防控鹅痛风重要措施。鹅星状病毒致病机制研究和疫苗开发也是鹅病防控研究工作重点。
4 结论
本研究成功分离得到一株广东地区鹅星状病毒,该病毒株接种鹅胚和雏鹅后症状与自然感染鹅痛风症状相同,是导致雏鹅痛风重要病因之一。为进一步研究鹅星状病毒致病性和致病机制并开展广东地区鹅痛风防控研究奠定基础。
