转GmESR1基因大豆鉴定及主要农艺性状调查
2022-10-28武小霞杨思琪蒋金胜张佳惠王港庆于明珠
武小霞,张 博,杨思琪,廖 艺,蒋金胜,张佳惠,王港庆,于明珠,赵 莹
(东北农业大学农学院,哈尔滨 150030)
大豆是重要油料作物,也是国家粮食安全体系中重要物种[1]。为提高大豆产量,改善大豆品质,转基因技术尤为重要,且转基因技术在农业中应用越来越广泛。伴随转基因技术快速发展,其对生态环境所产生的影响需高度重视。为确保生态环境以及人类安全与健康,转基因研发单位应作好转基因作物生物安全评价[2]。
环境安全评价作为转基因生物安全评价一部分,是转基因产品商业化应用前必需步骤。刘琦等通过连续三年监测转基因大豆,发现转基因大豆向野生近缘种产生基因飘逸概率较小[3]。吴奇等调查发现,与亲本大豆相比,转抗草甘膦基因大豆对非靶标节肢动物群落多样性的影响与对照大豆无显著差异[4]。刘佳等通过调查转基因大豆根际土壤微生物发现,转基因大豆显著提高真菌数量,降低根际土壤细菌和放线菌数量[5]。张卓等研究发现在转基因大豆田中仅个别杂草相对多度和田间频率低于对照外,其他杂草无显著差异[6]。近年来,也有研究表明,转基因作物对基因漂移以及生存竞争能力的影响较小,不具有杂草化潜在风险[7-8]。
研究表明转基因大豆自生苗产生率、种子落粒性、繁育系数、自然延续能力、单株产量和结实率[9-11]等与常规或受体大豆差异不显著,转基因大豆在野外生存竞争能力与亲本大豆相比较弱,生存竞争能力无法超过非转基因大豆,外源基因的存在并未增强转基因大豆生存竞争力[12]。
ESR1基因是植物再生基因,植物再生主要依赖植物细胞全能性,细胞如何发挥全能性是人们长期关注的问题。Banno等通过对拟南芥cDNA文库的功能性筛选获得新cDNA,即ESR1(ENHANCER OF SHOOT REGENERATION1)基因,功能研究表明,存在外源细胞分裂素情况下,ESR1过量表达提高根外植体再生效率[13]。后续研究发现ESR1不仅在分生组织中心区的表达影响外周区器官发育,且ESR1基因缺失导致分生组织生长膨大,过量表达又导致分生组织生长停滞而无法后续分化,表明ESR1可能通过促进分生组织生长分化以促进芽再生[14]。拟南芥ESR1基因超表达导致根外植体在无细胞分裂素的培养基中产生不定芽,且添加过量细胞分裂素培养基条件下培养,可提高不定芽增生率,促进植株生长发育[15]。
本研究采用抗草胺膦鉴定、PCR扩增检测、qRT-PCR等方法对前期研究获得的T7代转GmESR1基因大豆分析其遗传稳定性。并对T7代转基因植株主要农艺性状作安全性评价,探究转基因大豆在生长环境安全性上与受体大豆之间差异性。
1 材料与方法
1.1 供试植物材料
转GmESR1基因大豆株系4-17、4-18、4-21和4-24,对照大豆DN50,转基因大豆以Bar基因作为筛选标记。供试材料均由东北农业大学大豆生物学教育部重点实验室大豆遗传改良团队保存。
1.2 方法
1.2.1 转GmESR1基因大豆抗草铵膦鉴定
分别种植转基因植株与对照植株DN50,长出三出复叶后,记号笔标记待测叶片,配制130 mg·L-1草铵膦溶液,将草铵膦溶液涂抹于转基因大豆叶片,以涂抹DN50叶片作为对照。5 d后观察叶片情况,3次重复,每次重复涂抹15株大豆叶片。
1.2.2 植物DNA提取
转基因大豆和对照大豆长出三出复叶后,选取长势良好新鲜嫩叶,利用天根公司植物基因组DNA提取试剂盒提取植物DNA,后续用于PCR检测。
1.2.3 转GmESR1基因大豆PCR检测
提取大豆叶片DNA后,利用Bar基因特异性引物在PCR仪上扩增。模板为大豆叶片DNA,阳性对照为pEarleyGate101-ESR1质粒,阴性对照为受体材料DN50。以ddH2O为空白对照。反应体系如下:Bar基因PCR扩增条件:94℃预变性5 min;35个循环;94℃变性,30 min,58℃退火30 s,72℃延伸30 s;72℃终延伸10 min;4℃终止反应。反应结束后,1%琼脂糖凝胶电泳检测PCR产物。所有引物列于表1。
表1 实时定量PCR引物序列Table 1 Primer sequences used in real time RT-PCR
1.2.4 转GmESR1基因大豆qRT-PCR检测
利用TRIzol试剂(Invitrogen)分别提取转基因大豆和DN50根、茎、叶总RNA。使用HiScript®II Q RT SuperMix for qPCR进行反转录。采用ChamQ Universal SYBR qPCR Master Mix(Vazyme)试剂盒进行定量PCR。反应混合液含有2×ChamQ Universal SYBR qRCR 10μL,上下游引物0.5μmol·L-1,cDNA模板1μL(相当于100 ng RNA),总体积为20μL。采用罗氏荧光定量PCR仪作实时定量反应,实时定量反应程序:95℃5 min;95℃10 s,62℃30 s,72℃30 s,40个 循环;溶解 曲线,95℃5 s,65℃1 min,97℃30 s;4℃冷却。采用2-△△CT方法计算CT值,比较GmESR1基因在转基因株系及DN50中表达差异。共3次独立生物学重复,3次技术重复。
1.2.5 生育期及产量性状调查
将转GmESR1基因大豆4-17、4-18、4-21、4-24及受体大豆DN50种植于东北农业大学转基因基地,采用随机区组设计,小区4周设立保护行,两端种植对照大豆DN50,种植行距60 cm,株距8 cm,行长4 m,每行种植50株。
在大豆出苗到成熟期间,调查其生育期。大豆成熟后,调查T7代4个转GmESR1基因株系(4-17、4-18、4-21、4-24)和对照东农50产量性状,分别随机选取20棵单株,调查株高、主茎节数、分枝数、单株荚数、单株粒重、百粒重等产量性状。
1.2.6 花粉萌发活力
1.2.6.1 花粉采集
采取足量正在散粉的转基因大豆株系以及对照大豆小花,放入未完全密封容器中,半小时内带回实验室。将收集的小花分为10组,每组不少于6朵,用于花粉萌发试验。
1.2.6.2 花粉形态观察
选取转基因植物和其对应的非转基因对照植株各3株,作为3个生物学重复,观察收集花粉形态。在洁净载玻片上均匀平铺一薄层液体花粉萌发培养基,将收集的花粉均匀散布在培养基上,盖上盖玻片并吸除多余培养基,立即用显微镜观察转基因植物及其对照花粉粒,并测量其直径。每株植物统计30个花粉粒直径,3株共统计90个花粉粒直径。
1.2.6.3 初始花粉萌发
选取转基因植物和对应非转基因对照花粉各1管(或小花各1组),分别均匀散布(或涂抹)到3个花粉萌发培养基上,置于铺有一层湿润滤纸的培养皿中培养,温度(28±2)℃,湿度70%~85%,2 h后置于显微镜下观察花粉萌发情况。
1.2.6.4 不同处理后花粉萌发
转基因植物或对应非转基因对照的剩余9管花粉分别放入25、30、35℃人工气候箱中,每种温度处理条件下均放置不同时间(1、3、6 h)后,在1.2.6.3所述培养条件下开展花粉萌发试验,每管花粉培养3皿,培养后置于显微镜下观察每个培养皿中花粉萌发情况。
1.2.7 土壤微生物检测
1.2.7.1 土壤悬液制备
称取各样品新鲜土样5 g,加入装有45 mL无菌水三角瓶中,在220 r·min-1空气振荡器中震荡10 min,得到10-1土壤悬液。利用倍比稀释法,吸取1 mL土壤悬液加入装有9 mL水的离心管中,得到10-2土壤悬液。依次类推将土壤悬液稀释至10-5。稀释时,被稀释土壤悬液应充分混匀。
1.2.7.2 土壤悬液接种及培养
采用平板计数法调查根际土壤细菌、真菌和放线菌数量,按不同稀释度接种至不同培养基上。细菌所用稀释度为10-5土壤悬液,接种至牛肉膏蛋白胨培养基;真菌所用稀释度为10-3土壤悬液,接种至马丁培养基;放线菌所用稀释度为10-4土壤悬液,接种至高氏培养基。每种菌液各取200μL土壤悬液均匀涂抹在相应培养基上,于28℃培养箱中倒置培养1~2 d,观察并统计菌落数量,共3次重复。
1.2.8 统计分析
利用SPSS 16.0(SPSS Inc,Chicago,IL,USA)软件作统计分析。单因素方差分析比较不同株系(CK、OE-1和OE-2)在同一处理条件下差异显著性(P<0.05,one-way ANOVA)。
2 结果与分析
2.1 转基因植株抗草铵膦鉴定
转GmESR1基因大豆外源插入基因中含有标记基因Bar基因,对草铵膦具有一定抗性。在室内种植T7代转基因株系植株及对照DN50,每一株系种植15棵,在植物长出三出复叶后,涂抹浓度为130 mg·L-1草铵膦,5 d后观察结果。结果表明(见
2.2 转基因植株PCR扩增检测
提取转基因大豆和对照大豆DNA后,以大豆DNA为模板,利用Bar基因特异性引物作PCR扩增。结果表明(见图2),4个转基因株系(4-17、4-18、4-21、4-24)均扩增出与阳性对照一致条带(366 bp),证明目的基因已成功插入基因组中。

图1 转GmESR1基因大豆抗草铵膦鉴定Fig.1 Identification of glufosinate resistance in GmESR1 transgenic soybean
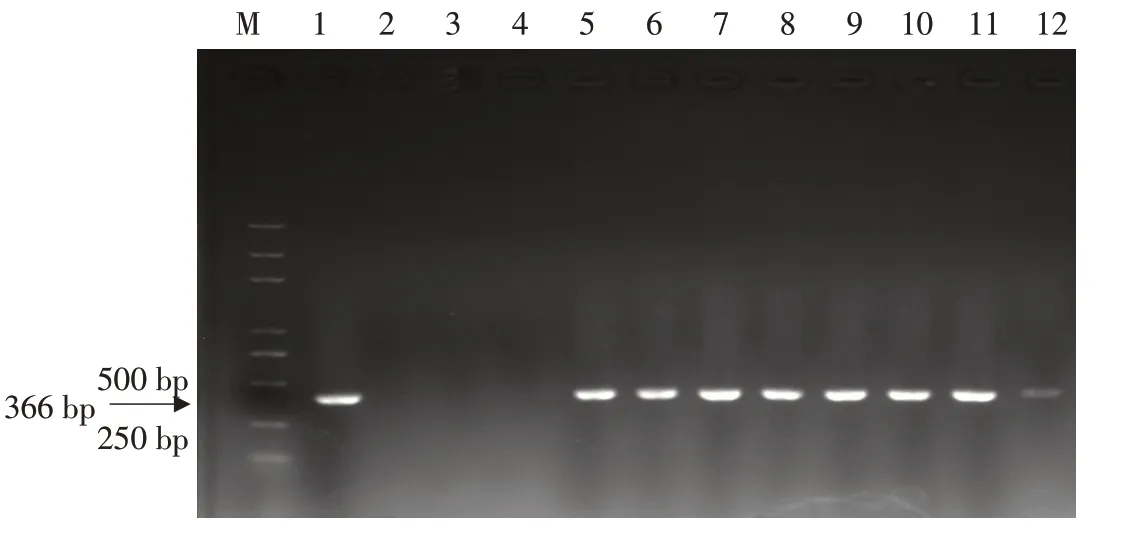
图2 转GmESR1基因大豆Bar基因PCR检测Fig.2 PCR detection of Bar gene in GmESR1 transgenic soybean
2.3 转基因植株qRT-PCR检测
qRT-PCR结果表明(见图3),GmESR1基因在不同组织器官中均表达,且在转基因大豆根、茎、叶、花、幼胚中表达量与对照相比均有不同程度增加。
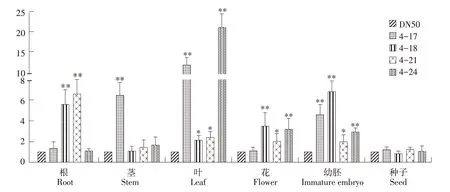
图3 转GmESR1基因大豆基因表达量分析Fig.3 Gene expression analysis of GmESR1 transgenic soybean
其中GmESR1基因在转基因株系4-18、4-21根中表达量显著高于对照;在转基因株系4-17茎中表达量显著高于对照;在转基因株系4-18、4-21、4-24的花中表达量显著高于对照;且GmESR1基因在4个转基因株系叶和幼胚中表达量均显著高于对照。但转基因大豆与对照大豆种子中表达量无显著差异。
2.4 转基因植株生育期以及产量性状调查
通过调查转基因材料产量性状发现,转GmESR1基因大豆在生育期上与对照大豆DN50一致,并未发生改变(见图4)。同时,转基因株系4-17、4-21在分枝数,单株荚数上与对照相比显著增加,其他株系与对照无明显差异。说明GmESR1基因可能促进植物生长发育,影响分枝数和单株荚数(见表2)。
图4 转GmESR1基因大豆生育期调查Fig.4 Investigation on growth period of GmESR1 transgenic soybean
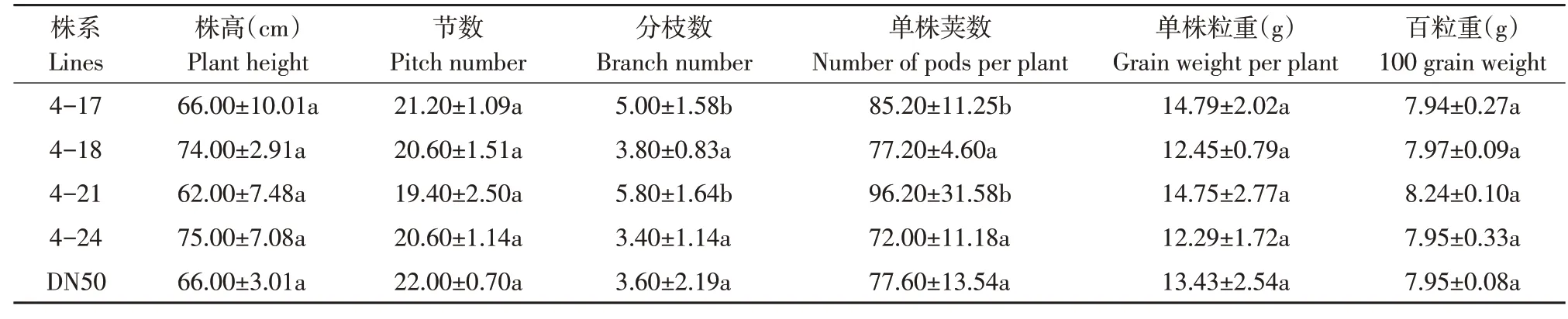
表2 转GmESR1基因大豆产量性状测定Table 2 Determination of yield traits in transgenic GmESR1 soybean
2.5 花粉萌发活力
通过测量花粉粒直径及观察花粉萌发情况,发现4个转基因株系花粉粒大小与对照DN50相比,无显著差异,其中对照大豆DN50花粉粒直径为(23.23±0.17)μm,4个转基因大豆株系花粉粒直径分别为23.09±0.29、23.07±0.3、22.94±0.21、23.32±0.18μm。在不同处理条件下,4个转基因株系花粉萌发率与对照相比,均不存在显著差异,且花粉刚离体时,萌发率最高。在相同温度条件下,随离体时间增加,其花粉活力逐渐下降;在相同离体时间条件下,随温度逐渐升高,花粉活力也逐渐下降,且在35℃,6 h条件下,花粉几乎丧失活性(见表3)。
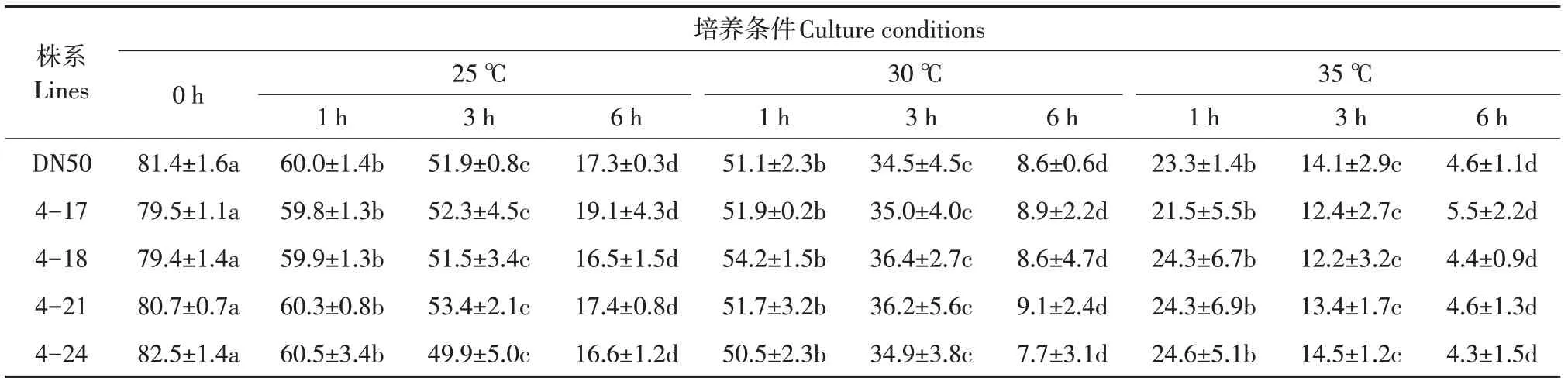
表3 转GmESR1基因大豆在不同培养条件下花粉萌发情况Table 3 Pollen germination of GmESR1 transgenic soybean under different culture conditions (%)
2.6 土壤微生物检测
土壤微生物是土壤生态系统中重要组成,为了解GmESR1基因过量表达对大豆根系土壤微生物的影响,对田间种植的4个转基因株系及对照DN50植株根系土壤微生物(细菌、真菌、放线菌)进行培养并调查菌落数目,共计3次重复,每次重复每个株系取5株,培养情况见图5。由表4可知,转基因株系在细菌、真菌菌落数量上均无显著差异;转基因株系4-18放线菌菌落数量显著高于对照。证明GmESR1基因过量表达可能对大豆根系土壤中放线菌有影响,而对细菌和真菌无影响。
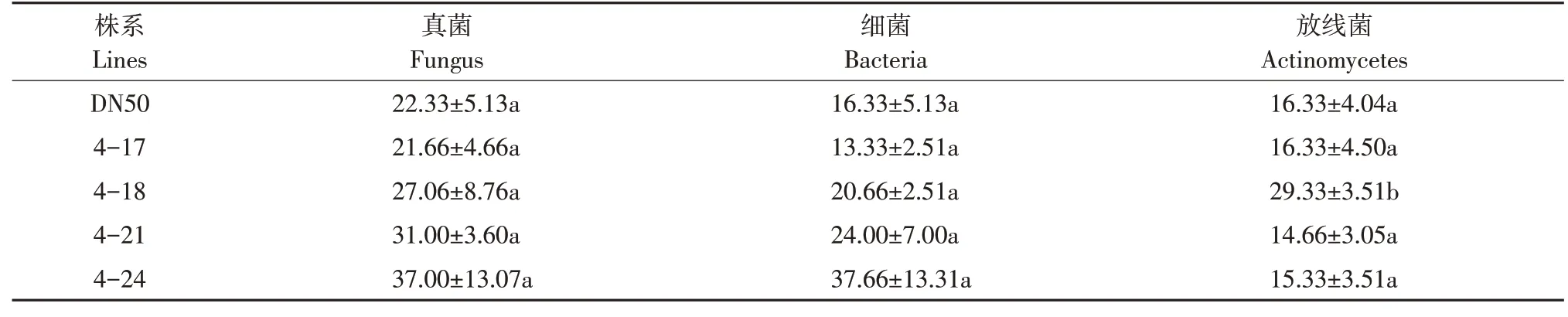
表4 转GmESR1基因大豆根系土壤微生物数量调查Table 4 Investigation on the quantity of soil microbes in the root system of GmESR1 transgenic soybean
图5 转GmESR1基因大豆土壤微生物检测Fig.5 Soil microbial detection of GmESR1 transgenic soybean
3 讨 论
对于转基因作物来说,外源基因能否在后代中稳定遗传和表达是转基因作物持续研发以及应用推广的前提。主要检测手段包括:Bar试纸条检测、PCR扩增检测、实时荧光定量PCR、Southern杂交、酶联免疫反应等。通过对T7代4个转基因株系的抗草铵膦鉴定、PCR扩增检测、实时荧光定量PCR等方式证明目的基因可在本世代稳定遗传、正常表达,可用于转基因作物安全性研究。
转基因作物环境安全性是指转基因作物种植是否对环境生态系统具有潜在风险。目前国内外学者提出的环境安全性问题主要包括转基因作物是否产生基因漂移,是否改变作物其他性状,是否对生物遗传多样性和群落结构产生影响,对靶标生物是否产生影响,转基因作物是否产生“杂草化”和转基因作物是否影响土壤生态系统等。
土壤微生物是土壤生态系统重要组成,由细菌、真菌、放线菌等组成。而转基因作物大面积种植势必引起转基因成分或其分泌物转移至土壤,可能造成土壤微生物数量、群落结构和多样性等发生变化,影响生态环境[16]。国内外关于转基因作物对土壤微生物的影响较多,但受基因、气候、土壤类型等多因素影响导致结果产生分歧。刘佳等指出在转基因大豆生长至花期时,抗草甘膦转基因大豆促进土壤中真菌繁殖,但细菌和放线菌繁殖能力明显减弱[17]。浦传亮等采用PCRDGGE技术,研究转胱硫醚-γ-合酶基因高蛋氨酸大豆根际土壤细菌群落结构,发现转基因大豆对细菌群落多样性有降低作用,但这一作用随大豆生长时间增加而逐渐减弱[18]。也有研究发现转基因大豆与受体大豆对根际土壤微生物差异不显著,转基因特性对土壤微生物数量及构成的影响相比种植环境、季节等对其影响小[19-20]。本文中T7代转基因大豆对土壤中细菌和真菌数量均无显著影响,但T7代4-18株系放线菌数量显著高于对照。转基因作物主要通过植株根系产生的分泌物对土壤环境产生影响,导致土壤微生物生存环境发生变化,影响土壤微生物种群结构及多样性[21-23]。因此需从多方面评价转基因大豆对土壤微生物的影响。
转基因育种目的在于改变目标性状,目标性状改变同时,其他性状也易发生变化。为确定转GmESR1基因大豆在改变目的性状同时对其他性状的影响,需测定田间种植的转基因大豆重要性状。高秀清等调查抗草甘膦转基因大豆农艺性状,发现转基因大豆在主要生育期、主茎节数、单株荚数和百粒重等农艺性状上差异不显著[24]。樊超等通过调查发现转基因大豆产量性状与对照无显著差异[25]。王志坤等研究表明转基因大豆增加其株高、主茎节数、分枝数、百粒重等农艺性状[26-28]。因此目的基因过量表达在改造目标性状同时,也可能对其他农艺性状造成不同程度影响。本研究调查T7代4个转基因株系及对照大豆农艺性状发现,转基因株系4-17、4-21在分枝数、单株荚数上与对照相比显著增加。由于ESR1基因属于AP2/EREBP家族,该家族在植物发育和胁迫应答等方面发挥广泛作用。以往研究中,ESR1基因在茎尖分生组织中具有重要作用,能够促进中心细胞发育和分生组织细胞分化[14]。因此本试验推测ESR1基因具有促进植物生长发育,提高大豆产量的潜力。
花粉传播能力是检测转基因大豆外源基因逃逸风险的重要指标,相比于同心圆法,可提高工作效率,降低工作成本[29]。虽然大豆属于自花授粉作物,其外源基因逃逸风险较小,但不同大豆品种间仍存在基因交流现象。Kim等发现转基因花粉的运动和杂交率与距离呈负相关,在温室条件下,转基因作物介导的花粉流动风险较低[30]。本研究在种植区域50 m范围未发现基因漂移现象,且转GmESR1基因大豆花粉粒直径和花粉离体后萌发率与受体大豆无显著差异,表明转基因大豆株系花粉传播能力与对照大豆相比无显著差异。参照已有基因漂移研究结果,在转基因大豆种植区域外设置隔离区可有效规避转基因大豆外源基因逃逸的风险。
综上所述,T7代4个转GmESR1基因大豆株系中外源基因均可稳定表达,且未因外源基因引入而产生不良农艺性状。该研究结果将为后续的转GmESR1基因大豆安全性评价奠定基础。
4 结 论
本试验分析T7代4个转基因株系遗传稳定性,结果表明GmESR1基因在本世代稳定表达;4个转基因株系花粉离体后花粉萌发率、花粉粒大小与对照相比无显著差异,因此转基因材料花粉传播能力与本试验中非转基因对照相比亦无显著差异;调查其重要性状,其生育期与对照一致,个别转GmESR1基因大豆株系在分枝数和单株荚数等方面与转化受体存在显著差异;转GmESR1基因大豆株系对土壤放线菌可能产生影响,对其他微生物无显著影响。
