健康体检发现冠状动脉钙化积分高危后心脏性猝死二例
2022-10-27刘洋沈振海姚伟峰胡晓恒陆昀沈史伟
刘洋 沈振海 姚伟峰 胡晓恒 陆昀 沈史伟
214086 无锡,江苏省人民医院集团 江苏省太湖疗养院放射科(刘洋、胡晓恒),心内科(沈振海、陆昀);214002 无锡,南京医科大学附属无锡第二医院内分泌科(姚伟峰、沈史伟)
1 病例资料
病例1:患者男性,48岁,2020年8月健康体检。主诉:无。既往史:高血压4年余,未服药治疗。个人史:戒烟1年,偶饮酒,低脂饮食,喜好运动。家族史:无特殊。体格检查:体温37℃,脉搏72次/min,呼吸13次/min,血压139/93 mmHg;体质指数22.8 kg/m2;两肺呼吸音低,未闻及干湿性啰音;心率72次/min,心律齐,心音低钝,心尖部闻及Ⅱ级收缩期杂音。心电图示V1~V4导联异常Q波伴ST段抬高,V5~V6导联T波倒置,室性期前收缩。腹部B超示脂肪肝。胸部低剂量CT(low-dose computed tomography,LDCT)纵隔窗示冠状动脉及右侧肺门区见斑点及弧形钙化,诊断右下肺及左肺少许炎症后遗灶。实验室检查:三酰甘油(TG)0.75 mmol/L,总胆固醇(TC)4.35 mmol/L,高密度脂蛋白胆固醇(HDL-C)1.42 mmol/L,低密度脂蛋白胆固醇(LDL-C)2.54 mmol/L。谷丙转氨酶(ALT)21.0 U/L,谷草转氨酶(AST)22.0 U/L,谷氨酰转肽酶(γ-GT)22.0 U/L,乳酸脱氢酶(LDH)193.0 U/L,磷酸肌酸激酶(CK)151.0 U/L。空腹血糖(FBG)5.37 mmol/L,肌酐(Cr)69.8 μmol/L,血尿酸(SUA)378.0 μmol/L。体检结论及建议:(1)心电图异常报告:V1~V4导联异常Q波,伴ST-T改变,室性期前收缩。建议立即住院心内科进一步诊治;(2)高血压:建议规律服用降压药。突发状况:患者体检后1~2 d,无胸闷、心慌等不适症状;于第3天午餐时饮高度白酒约400 g后,突然由坐位直接倒向地面,呼之不应,急送当地医院抢救,但监护仪显示心跳、呼吸均已停止,虽施予心肺复苏术,但生命未能挽回。既往体检:2016年4月:血压偏高(150/81 mmHg),LDL-C 4.11 mmol/L,心电图示T波改变(V5~V6T波低平),超声心动图示室间隔正常上限,二、三尖瓣轻度反流,LDCT诊断冠状动脉钙化(coronary artery calcification,CAC)。2018年6月:心电图示T波改变,室性期前收缩。回顾分析近3次LDCT时冠状动脉钙化积分(coronary artery calcification score,CACS)状况,采用128排256层Philips Brilliance iCT工作站钙化积分后处理软件(HeatBeat-CS)系统,显示2016年、2018年和2020年总CACS(T-CACS)分别为51.39、299.86和503.13分,见表1、图1~3。
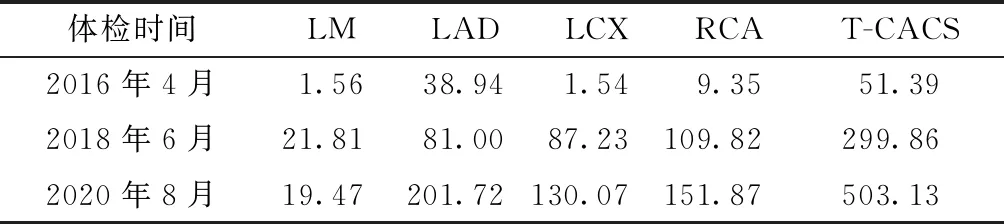
表1 病例1近3次健康体检胸部LDCT的CACS
病例2:患者男性,47岁,2019年5月健康体检。主诉与现病史:平时无不适症状。既往史:2型糖尿病(T2DM)病史5年余,血压偏高4年,均未服药治疗。个人史:吸烟,偶尔饮酒,饮食清淡,经常运动。家族史:无特殊。体格检查:体温36.9℃,脉搏78次/min,呼吸14次/min,血压126/85 mmHg;体质指数23.5 kg/m2;腰围90 cm。两肺呼吸粗糙,未闻及啰音;心率78次/min,律齐,心尖部未闻及明显心脏杂音。心电图正常。B超示肝脂肪浸润,甲状腺局部回声欠均匀。胸部LDCT纵隔窗示主动脉及部分冠状动脉局限性钙化,诊断肺内未见明显异常。实验室检查:TG 0.83 mmol/L,TC 4.92 mmol/L,HDL-C 1.50 mmol/L,LDL-C 3.04 mmol/L。ALT 12.0 U/L,AST 11.0 U/L,γ-GT 35.0 U/L,LDH 138.0 U/L。FBG 8.23 mmol/L,糖化血红蛋白(HbA1C)7.0%。Cr 73.38 μmol/L,SUA 294.0 μmol/L。体检结论及建议:(1)糖尿病:建议合理使用降糖药物,定期内分泌专科随访;(2)血压偏高史:建议复测血压,心内科随诊;平时宜低盐低脂饮食,戒烟戒酒。突发状况:患者体检后1~6 d,正常上班,无头晕、胸闷、心慌等不适症状;于第7天上午,在工作中突感全身疲乏无力伴大汗淋漓,休息约7~8 min后症状自行缓解,神志清醒,无胸闷、胸痛和饥饿感,未就医;于第9天加班时感觉乏力,中午返回家中休息,约下午2点半左右被家人发现其躺在床上没有呼吸,呼之不应,急送附近医院抢救,但已死亡。既往体检:2017年5月:血压135/91 mmHg,FBG 8.06 mmol/L,LDCT纵隔窗示主动脉及部分冠状动脉局限性钙化。2018年12月:血压136/94 mmHg,LDL-C 3.5 mmol/L,FBG 9.04 mmol/L,HbA1C 7.1%,超声心动图示轻度主动脉瓣关闭不全。回顾分析近3次LDCT时T-CACS,显示2017年、2018年和2019年分别为218.08、433.81和487.55分,见表2、图4~6。

A:左冠状动脉主干;B:左前降支;C:左回旋支;D:右冠状动脉;1:2016年,冠状动脉各主要分支均可见少量钙化斑块(箭头所示),T-CACS=51.39;2:2018年,冠状动脉各主要分支钙化斑块进一步增加(箭头所示),T-CACS=299.86;3:2020年,冠状动脉各主要分支钙化程度及范围明显增加(箭头所示),T-CACS=503.13图1~3 病例1的胸部LDCT纵隔窗示冠状动脉钙化
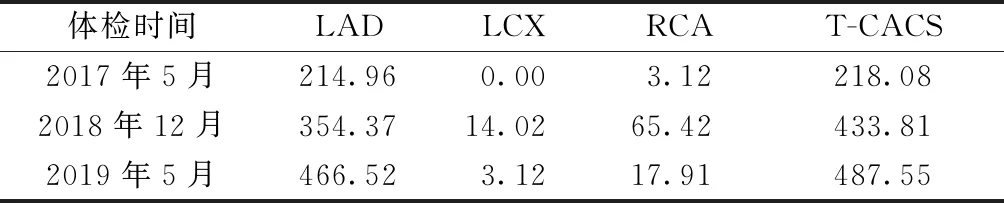
表2 病例2近3次健康体检胸部LDCT的CACS
2 讨论
《中国心血管健康与疾病报告2021》指出,我国心血管病患病率处于持续上升阶段,现患病人数3.3亿,其中冠心病1 139万例,其发病率城市高于农村,死亡率农村高于城市,已成为城乡居民致死、致残的最主要原因之一[1-2]。就心脏性猝死(sudden cardiac death,SCD)而言,估算中国每年发生50万例,男性高于女性[1]。可见,对冠心病的早期预防、早期发现和早期治疗已成为我国心血管病防控工作中的重中之重。
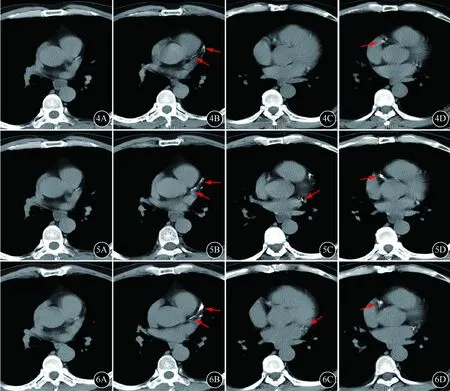
A:左冠状动脉主干;B:左前降支;C:左回旋支;D:右冠状动脉;4:2017年,LAD和RCA可见少量斑点及细条状钙化(箭头所示),T-CACS=218.08;5:2018年,LAD和RCA钙化进一步增加,LCX可见少量钙化(箭头所示),T-CACS=433.81;6:2019年,LAD见多发管条状钙化,程度及范围较前增加(箭头所示),T-CACS=487.55图4~6 病例2胸部LDCT纵隔窗示冠状动脉钙化
CAC既往被认为是一种退行性病变,随着年龄增长不断进展。然而,现在认为CAC的发生发展是一个活跃的致病过程,是冠状动脉粥样硬化的一个高度特异性特征[3]。CAC面积与斑块体积之间显著相关,而与管腔面积没有关联[4]。但是,CAC与冠状动脉狭窄间有直接关系,随着CAC斑块的增大、增多,势必造成冠状动脉管腔进一步狭窄(≥50%为冠心病)。CACS是对CAC进行量化分析的一种评估方法,其值越高表明动脉粥样硬化越严重。冠状动脉内超声研究证实了CACS与斑块的位置和范围直接相关[5]。CACS与冠状动脉狭窄程度呈正相关,钙化斑块数量与全因死亡相关,数量增加死亡风险增加;并且,CACS是心血管事件的独立预测因子,可以判定冠心病发生、进展及严重程度,作为预测无症状高危人群冠心病事件的风险因素[6-7]。2010年,CACS开始成为美国心脏协会评估冠心病风险的关键指标之一[8-9]。如今,与心电门控相比,非门控胸部CT平扫所得CACS预测心血管事件的结局具有高度的一致性[6, 10]。因此,胸部LDCT平扫用于CAC评估和进行冠状动脉风险分层切实可行。
CACS的获得是在LDCT检查之后,在薄层重建纵隔窗利用CT工作站的钙化积分后处理软件直接测定。Agatston法是最为常用的钙化定量分析法,分别记录各冠状动脉主要血管积分分值,求和为总积分,主要包括左冠状动脉主干(left main coronary artery,LM)、左前降支(left anterior descending artery,LAD)、左回旋支(left circumflex artery,LCX)和右冠状动脉(right coronary artery,RCA)四大支(对角支纳入LAD,钝缘支纳入RCA)。该积分等级按0、1~100、101~400和>400分为极低危、低危、中危和高危[6, 11]。
本文两例患者的共同特点:中年男性;有吸烟史、糖尿病或高血压等慢病史,均未服药治疗;有SCD发作诱因和先兆表现;体检发现CAC 2~4年,事发时CACS均处于高危状态。
CAC病变在冠心病患者中普遍存在,常随年龄增长而增加,冠状动脉狭窄程度越高伴有钙化的概率也越大[12-13]。CACS增高则代表着动脉粥样硬化斑块的大量出现,在不稳定型冠心病患者中则预示着冠状动脉病变的严重程度[14]。然而,已有研究证实,通过采取积极的一级预防措施,可以降低CAC的发生发展,减少相关心血管病的发生[15]。本文两例患者年龄<50岁,其CAC病变发展如此之快,显然与他们合并多种动脉粥样硬化危险因素又未进行干预治疗有关。虽然他们每1~2年健康体检1次,曾接受过多次健康咨询和健康教育,如吸烟、高血压、高血糖和高脂血症是最为常见,又是可以控制或改变的动脉粥样硬化危险因素。但他们自以为年轻、无症状、惧怕药物不良反应、不愿就诊和服药等,结果错过了慢病治疗机会。究其主要原因是他们对健康知识的认知状况较差。一项包括18个社区市民参与的对心脏病发作症状知识的调查发现,北京市居民对常见心脏病发作症状的知识缺乏,<50岁的人对于心脏病发作症状的认知最差[16]。我国急性心肌梗死(acute myocardial infarction,AMI)患者的主要表现为胸痛或胸部不适(94%),其他常见的症状是大汗(67.2%)、乏力(31%)[17]。约1/4的ST段抬高型心肌梗死患者就诊时无典型胸痛症状[18]。该两例患者有过量饮酒、加班劳累及心电图异常Q波伴ST-T改变、发作性疲劳感伴大汗分别是SCD前的发作诱因及先兆表现;然而又是因为其自身健康素养较低而错过了可以避免或被抢救的时机。
健康体检是健康管理的关键环节,是指通过医学手段和方法对受检者进行身体检查,以了解其健康状况,早期发现疾病线索和健康隐患的诊疗行为[19]。本文报告的两例患者在体检后第3和第9天发生SCD,意味着他们健康管理的失败,教训惨痛。尽管主检医师、心电图医师等已经强烈建议患者(病例1)立即住院心内科进一步诊治,但若已经启动的重要异常结果通知随访流程和检后预警制度落实得再到位一点,以往检后干预和随访工作做得再细致有效一点,也许会避免悲剧的发生。由此可见,健康管理机构应将健康教育贯穿健康管理全过程,落到实处,要引导慢病及高危人群践行健康教育“知信行”,提高他们的健康素养和自我健康管理能力。另外,要加强健康体检中重要异常结果的管理,进一步完善和提高检后健康咨询和随访的有效性。
本文两例患者的CAC病变均以LAD为主,是否冠心病的SCD与LAD存在某些关联?Williams等[13]对CAC病变数目、部位与CACS的预测价值等研究发现,LM病变的死亡率显著高于其他冠状动脉。土耳其伊斯帕尔塔市2010—2019年的尸检回顾性分析报告显示,冠心病是SCD的主要病因(65.6%),在SCD的冠心病患者中,92.9%为LAD病变[20]。男性发生冠心病的年龄<55岁、女性<60岁被定义为早发冠心病,其与遗传相关[21]。该类人群发生的SCD事件大多是由动脉粥样硬化斑块破裂或糜烂而引起的突发血管内血栓形成所致[21]。我国40岁及以上T2DM患者中,半数以上处于冠心病发病风险高危水平[22]。Heinsen等[23]在研究CACS与心血管危险因素的关系时发现,无症状T2DM人群中高危冠状动脉斑块的患病率较高。而后者与急性冠状动脉综合征风险增加相关。因此,笔者推测本文两例患者发生SCD,极有可能是由冠状动脉粥样斑块破裂导致血栓形成引起AMI,继而心电不稳定,产生心肌损伤电流,最终造成心律失常引发心室颤动。最近的病理和影像学研究表明,具有致密钙化的病变更可能是稳定斑块(纤维钙化斑块),而微小、点状或碎片状钙化与早期斑块或不稳定病变(斑块破裂或侵蚀)相关[24]。然而有较多的研究认为,他汀类药物可以增加斑块薄纤维帽的厚度来稳定斑块[25];有证据显示,瑞舒伐他汀使LDL-C降低至1.8 mmol/L以下可能使斑块消退[26]。研究证实,血LDL-C水平越低,心血管疾病发病危险越低[27]。鉴此,我们对于以LM和(或)LAD为主要病变的冠心病患者应及早重视AMI和SCD的预防,积极控制动脉粥样硬化危险因素,应用药物稳定斑块,注重避免各类诱发因素。
近年来,CACS已被证实是一种可广泛应用的、一致性好且可重复性高的检测手段。国际多项指南和专家共识均建议采用CACS对无症状患者的临床干预过程进行风险评估。美国心血管计算机断层扫描学会/胸部放射学学会的指南[3]指出,要在所有胸部CT平扫中纳入CACS的评估和报告,并作为Ⅰ类证据推荐。要求40岁以上者进行LDCT肺癌筛查时应评估CAC,要在常规报告中描述是否有CAC。推荐对有钙化,超过该年龄组切点,先行冠状动脉CT检查,如阳性则行冠状动脉造影;如有钙化,但在该年龄组切点以下,则临床定期观察治疗危险因素并每年复查LDCT。其实,我国学者张剑等早在2011年就研究认为,CACS对冠心病的早期诊断具有一定帮助。然而,本文两例患者在事发前2~4年就被发现存在CAC,但是仅病例1的影像诊断报告CAC 1次。试想一下,若当下医学影像科、心内科和健康管理医学科医生都能普遍认识CAC,推广应用CACS对冠状动脉风险进行分层评估和报告,将对我国冠心病防控的关口前移具有重大临床意义。
本文两例患者未能做尸体解剖,缺乏SCD病理诊断,是本报告的不足之处。我们呼吁对于40岁以上人群,在LDCT筛查肺癌的同时应进行CACS评估,实施单次LDCT平扫完成肺癌和冠心病危险分层筛查,既不增加辐射剂量,又能提高成本效益。
利益冲突:无
