霉菌和酵母菌快速测试技术与国家标准方法在食品检测中的应用比对
2022-10-27李慧芳陈炎欢陈仲婷
张 绒,李慧芳,陈炎欢,陈仲婷
(无限极(中国)有限公司,广东江门 529100)
霉菌和酵母菌在自然界广泛存在,受霉菌污染的食品对人体造成的危害不容小觑,轻则中毒、重则致癌、致畸、致突变。酵母菌作为一种发酵菌,可将食物中的糖发酵,易致使食品腐败变质,对人体造成不同程度的伤害。因此,霉菌和酵母菌检测项目常被作为食品加工企业评价食品安全的重要指标。
食品中霉菌和酵母菌计数检验主要依据《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》(GB 4789.15—2016)[1],但该方法的检测周期长,从样品准备到出具报告至少需要6 d,而快速测试片检测过程仅需3 d。霉菌和酵母菌快速测试片(以下简称快速测试片法)是一种预先制备好的一次性培养基制品,含有微生物生长所需的营养物质及显色剂,具有操作简便、便于运输、成本低等优点[2]。但由于快速测试片还不是我国食品微生物检验的国家标准方法,所以现阶段无法在检测机构和食品企业中大规模应用。
本研究将日常工作中的两款原料进行人工污染并作为试验样品,分别添加白色念珠菌、黑曲霉两个标准菌株,采用霉菌和酵母菌快速测试片法和GB 4789.15—2016对两种试验样品进行测定,通过开展快速测试片法的重复性试验、差异比较试验,确认快速测试片法是否与国标方法存在显著差异,为快速测试片法作为原料日常监控霉菌和酵母菌的检测方法提供参考依据。
1 材料与方法
1.1 材料
1.1.1 样品
酪蛋白磷酸肽(广州市锐力发展有限公司);碳酸钙(广东大地食用化工有限公司)。
1.1.2 培养基及菌种
3M PetrifilmTM霉菌和酵母菌检验快速测试片(3M公司);孟加拉红培养基(广东环凯微生物科技有限公司);白色念珠菌(ATCC 10231)、黑曲霉(ATCC 16404),均来源于广东省微生物菌种保藏中心(国家专利菌种保藏平台)。
1.1.3 设备
超净工作台;生物安全柜;霉菌培养箱;恒温水浴箱。
1.2 试验方法
1.2.1 菌株适用性试验
样品制备:按照GB 4789.15—2016方法,在25 g样品中加入225 mL稀释液,充分溶解,混合均匀。
试验菌株制备:将试验菌株白色念珠菌(ATCC 10231)、黑曲霉(ATCC 16404)复苏后,制成一定浓度的菌悬液。
供试液制备:将一定浓度的试验菌株白色念珠菌(ATCC 10231)、黑曲霉(ATCC 16404)制成的菌悬液加入样品中,使每1 mL样液中含菌量为10~150 CFU。
国家标准GB 4789.15—2016测试方法:按上述方法进行样品制备后,吸取1 mL待测样液于平皿内,倾注孟加拉红琼脂,置于(28±1)℃培养5 d,观察结果。
菌株适用性试验方法:为确认样品中的微生物能被充分检出,先选择最低稀释级的样液进行计数方法适用性试验。加菌液的体积不超过供试液体积的1%,依照GB 4789.15—2016方法开展检测,培养后观察结果,验证样品对试验菌株是否有生长抑制性。
1.2.2 试验样品重复性试验
将一定浓度的试验菌悬液加入通过菌株适用性试验的样品中,制成终浓度为10~150 CFU·mL-1的加标样品。
快速测试片法:按产品使用操作说明,取1 mL待测样品置于快速测试片中,置于(28±1)℃培养48 h后,观察结果。
重复性分析方法:用快速测试片法对加标样品进行霉菌和酵母的检测,每个样品由同一操作者使用同一设备在短时间内进行两次独立的单次试验,参照《食品和动物饲料微生物学30 ℃菌落计数方法》(SN/T 1800—2006)[3]中重复性要求进行快速测试片法试验结果分析,两次独立的单次试验结果对数的绝对差值不应大于重复性限0.25(即r≤0.25)。
1.2.3 试验样品显著性差异比较试验
将试验菌株白色念珠菌(ATCC 10231)、黑曲霉(ATCC 16404)制成高中低5种浓度的菌悬液,加入待测样品中采用快速测试片法和国家标准法同时进行检测[4]。通过Minitab 15对试验数据进行t检验统计分析,若t检验统计量的概率P<0.05,认为快速测试片法和国家标准法有显著差异;P>0.05,则认为快速测试片法和国家标准法无显著差异。
2 结果与分析
2.1 菌株适用性试验结果
由表1、表2可知,对添加白色念珠菌(ATCC 10231)、黑曲霉(ATCC 16404)的两种样品按照GB 4789.15—2016开展检测后,结果表明霉菌和酵母菌在试验样品中生长良好,回收PR值在0.5~2.0,两种样品酪蛋白磷酸肽、碳酸钙对所测试菌株无生长抑制性。

表1 酪蛋白磷酸肽菌株适用性试验结果

表2 碳酸钙菌株适用性试验结果
2.2 试验样品重复性试验结果
由表3、表4可知,用快速测试片法进行霉菌和酵母菌测试,参照《食品和动物饲料微生物学30 ℃菌落计数方法》(SN/T 1800—2006)中重复性要求进行数据分析。结果表明,酪蛋白磷酸肽和碳酸钙样品采用快速测试片法的两次测试结果r值均<0.25,重复性结果可接受。

表3 酪蛋白磷酸肽重复性测试结果

表4 碳酸钙重复性测试结果
2.3 试验样品显著性差异比较试验结果
由表5、表6可知,用快速测试片和国家标准法分别对添加菌液的样品进行霉菌和酵母计数检测,t检验分析后表明,酪蛋白磷酸肽中,霉菌t=1.55,P=0.132(P>0.05),酵母菌t=0.03,P=0.974(P>0.05);碳酸钙中,霉菌t=0.14,P=0.888(P>0.05),酵母菌t=-0.01,P=0.989(P>0.05)。结果表明,酪蛋白磷酸肽和碳酸钙两组样品采用国家标准法和快速法测试的霉菌和酵母菌检测结果均无显著差异(P>0.05)。

表5 酪蛋白磷酸肽显著性差异比较测试结果
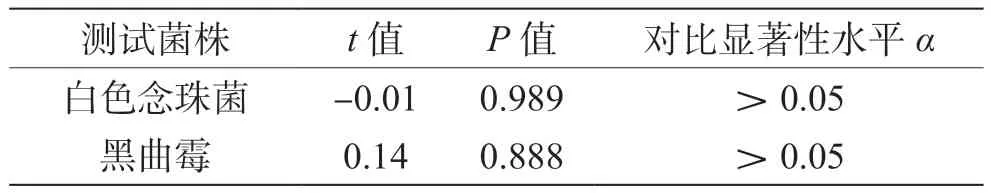
表6 碳酸钙显著性差异比较测试结果
3 结论与探讨
通过Minitab 15对霉菌和酵母菌快速测试片法与《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》(GB 4789.15—2016)方法的试验数据进行t检验统计分析,结果显示快速测试片法与国标方法相比无显著性差异(P>0.05)。霉菌和酵母菌快速测试片易于操作,无需其他辅助器具即可快速检测样品,能有效缩短检测周期,达到快速评估的目的,同时该方法也得到美国分析化学家协会(Association of Official Analytical Chemists,AOAC)的认可。
重复性试验结果参照《食品和动物饲料微生物学30 ℃菌落计数方法》(SN/T 1800—2006)中重复性要求对快速测试片法检测霉菌和酵母的试验结果进行分析,试验结果在要求范围。但由于重复性限的范围(r≤0.25)较宽,对数据的要求不严格,在实际检测过程中,建议根据情况采取等效的、更严格的控制方法和标准进行仲裁判定,确保风险得到有效控制[5]。
本试验所用酵母和霉菌测试片,其培养基含有作为载体的冷水可溶性凝胶和对霉菌和酵母敏感的指示剂(5-溴-4-氯-3-吲哚基-磷酸盐),与酵母、霉菌在培养生长过程中发生特异性显色反应,通过生长特征和颜色变化来判定霉菌和酵母的种类和数量[6]。其中酵母菌为蓝绿色,较小菌落,笔者在其他物料的检测过程中发现其中的小型颗粒比较容易在检测过程中被染色,对结果判读造成干扰,建议对于需要用快速测试片法进行检测的机构或企业,在使用前应针对每一种物料进行适用性验证,以确保检测结果的准确性。
