西瓜噬酸菌磷酸盐特异性转运系统pstS 基因功能分析
2022-10-27蔡馥宇费诺亚杨玉文叶云峰赵廷昌
蔡馥宇,费诺亚,2,乔 培,关 巍,杨玉文,叶云峰,赵廷昌
(1.植物病虫害生物学国家重点实验室·中国农业科学院植物保护研究所 北京 100193;2.沈阳农业大学沈阳 110866;3.广西壮族自治区农业科学院园艺研究所 南宁 530007)
瓜类细菌性果斑病(bacterial fruit blotch,BFB)是葫芦科作物上的检疫性种传病害,于20 世纪90年代在我国首次被发现和报道,破坏性强,往往给瓜类生产造成严重损失。BFB 的病原为西瓜噬酸菌(),是一种革兰氏阴性细菌。已知III 型分泌系统(type III secretion system,T3SS)在西瓜噬酸菌的致病过程中起关键作用。近年来的研究也表明,西瓜噬酸菌的鞭毛、生物膜、群体感应和趋化性等也能在一定程度上影响西瓜噬酸菌的致病能力。
革兰氏阴性菌中存在多种转运系统来完成对物质的吸收和利用,比如从外界摄取亚铁离子的Feo 转运系统、负责胞内脂蛋白转运的Lol 系统、转运大分子营养物的TonB 复合物等。磷酸盐的吸收和利用主要由磷酸盐特异性转运系统(phosphate specific transport,Pst)和 磷 酸 盐 转 运 系 统(phosphate inorganic transport,Pit)完成。Pst 属于磷酸盐调节子(Pho regulon),一般由PstS、PstC、PstB、PstA 和PhoU 5 个蛋白组成。磷酸盐调节子的主要功能是控制磷(Pi)稳态,但有研究发现该系统在病原菌的致病过程中也发挥着作用。在迟缓爱德华氏菌()中,Pst 的突变会影响其在寄主上的毒力,并且T3SS 的跨膜蛋白和其他毒力相关蛋白的分泌也会受到影响。然而,目前Pst 通过何种机制影响细菌的致病性尚未明确。PstS 是Pst 中的Pi 结合蛋白,负责结合周质空间中的Pi。铜绿假单胞菌()中基因缺失后,细菌一直处于Pi 饥饿状态,且生物膜形成能力显著降低,而在致金色假单胞菌()147-2 菌株中Pst 负调节生物膜的形成。假单胞菌(sp.)wj1 中PstS 蛋白在大肠杆菌中过量表达后,使得重组大肠杆菌的无机磷酸盐吸收率显著提高,表明PstS 蛋白具有结合Pi 的能力,但在菌浓度不变的情况下,周质空间的Pi 浓度增加会抑制PstS 蛋白对Pi 的结合。
为明确在西瓜噬酸菌中的功能,笔者构建了西瓜噬酸菌基因的缺失突变菌株和互补菌株,通过对致病性、生物膜形成能力等致病相关表型及转录调控能力的测定,初步分析在西瓜噬酸菌致病过程中发挥的作用,为解析西瓜噬酸菌的致病调控网络提供分子依据。同时通过测定在大肠杆菌中表达西瓜噬酸菌的PstS 蛋白时该蛋白与Pi 的结合能力,初步分析是否在西瓜噬酸菌对磷酸盐吸收的Pi 结合环节发挥作用。
1 材料与方法
1.1 材料
1.1.1 供试菌株、质粒及引物 试验所用菌株和质粒见表1,引物序列见表2。

表1 试验所用菌株和质粒

表2 试验所用引物
1.1.2 培养基及培养条件(1)金氏B(King’s B,KB)培养基:胰蛋白胨15 g,KHPO1.5 g,MgSO·7 HO 1.5 g,丙三醇15 mL,pH=7.0,加入ddHO 定容至1 L;(2)溶菌肉汤(lysogeny broth,LB)培养基:胰蛋白胨10 g,NaCl 10 g,酵母粉5 g,pH=7.0,加入ddHO 定容至1 L;(3)0.3%半固体培养基:细菌专用运动性蛋白胨0.3 g,酵母提取物0.3 g,琼脂粉0.3 g,pH=0.7,加入ddHO 定容至1 L;(4)M9 蔗糖培养:NaHPO·12HO 75.6 g,KHPO15 g,NHCl 5 g,NaCl 2.5 g,20% CHNaO10 mL,1 mol·LMgSO1 mL,蔗糖100 g,pH=7.0,加入ddHO 定容至1 L。配置固体培养基(除0.3%半固体培养基外)则在以上配方基础上再添加1.5%的琼脂。以上培养基于121 ℃高压灭菌(蔗糖培养基110 ℃高压灭菌)20 min。试验所用抗生素终质量浓度分别为:氨苄青霉素(Ampicillin,Amp)100 μg·mL;卡那霉素(Kanamycin,Km)50 μg·mL;氯霉素(Chloraphenical,Cm)25 μg·mL。试验中,西瓜噬酸菌及其衍生菌株于KB 培养基28 ℃培养;大肠杆菌及其衍生菌株于LB 培养基37 ℃培养。
1.1.3 试剂及仪器 试验主要试剂有:KOD 高保真酶(Toyobo)、凝胶回收试剂盒(Axygen)、DNA Marker(北京博迈德基因技术有限公司)、蛋白预制胶(北京全式金生物技术有限公司)等,分别购自国药集团试剂有限公司和西格玛公司。试验所用引物均由北京六合华大基因科技有限公司合成。本试验所用仪器有:基础电泳仪和小垂直板电泳槽(BIO-RAD),低温离心机(Eppendorf)、PCR 仪(BIO-RAD)、智能人工气候培养箱(宁波江南仪器厂)、分光光度计(Nano VuePlus)等。
1.2 试验方法
1.2.1 西瓜噬酸菌PstS 蛋白结构域预测分析 根据NCBI 数据库的氨基酸序列()使用SMART 网站在线预测PstS 蛋白结构域。
1.2.2 突变菌株Δ及互补菌株Δcomp 的构建和筛选 试验于2020 年6 月在中国农业科学院植物保护研究所进行。利用Primer 5.0 软件设计克隆Aac5 菌株基因的上下游片段引物L-F/R、R-F/R(表2),使用DNAMAN 5.2.2 将Aac5的基因序列与KEGG 数据库中AAC00-1 菌株的基因进行比对,相似性为100%。通过overlapping PCR 技术融合基因上下游片段,将融合片段连接到自杀性质粒pk18中构建重组质粒pk18-。利用同源重组双交换原理,筛选突变菌株,三亲杂交将重组质粒pk18-导入野生型Aac5 菌株中。在含有抗生素加10%蔗糖的M9 平板上筛选得到突变株。使用西瓜噬酸菌特异性引物WFB1/WFB2 以及目的基因的特异性引物-F/R 进行基因的PCR 扩增和测序验证。
根据的基因序列设计互补引物C-F/R(表2)扩增互补片段并回收,扩增片段与pBBR1MCS-2 质粒连接后导入突变菌株中,并进行基因的PCR 扩增和测序验证。
1.2.3 致病能力测定 试验于2020 年7-8 月在中国农业科学院植物保护研究所进行。将野生型菌株Aac5、突变菌株Δ和互补菌株Δcomp培养至对数期,离心收集菌体,使用无菌水重悬2次,将菌液浓度调至3×10CFU·mL。使用喷雾接种的方法将调好的菌悬液均匀喷雾至西瓜(3 周育龄)叶片正反面,每个处理接种幼苗3 盆(每盆5~6株),以无菌水喷雾为阴性对照。笔者所用西瓜品种为中蔬瑞宏,购自中国农业科学院蔬菜花卉研究所。随后将西瓜幼苗置于人工气候培养箱培养,培养条件为28 ℃16 h 光照与16 ℃8 h 黑暗交替进行,相对湿度90%。接种8 d 后开始调查发病情况,计算病情指数,试验设置3 次重复。病情指数按照病情严重度分为5 级,标准如下:0 级,叶片无明显发病症状;1 级,叶片小于25%的面积坏死病变;3级,叶片25%~50%的面积坏死病变;5 级,叶片50%~75%的面积坏死病变;7 级,整株幼苗死亡。
病情指数=100×Σ(各级病叶数×各级代表值)/(调查病叶数×最高级代表值)。
1.2.4 烟草过敏性反应测定 试验于2020 年7 月在中国农业科学院植物保护研究所进行。将野生型菌株Aac5、突变菌株Δ和互补菌株Δ-comp 培养至对数期,离心收集菌体,将菌液浓度调至3×10CFU·mL。用1 mL 一次性无菌注射器将菌液注射至幼嫩三生烟草()叶片背面两条叶脉间的叶肉处,每个处理接种3 盆(每盆1 株)置于人工气候培养箱中28 ℃培养,24 h后观察是否发生过敏性坏死反应,以无菌水注射为阴性对照。试验所用三生烟种子由笔者实验室保存,试验设置3 次重复。
1.2.5 运动能力测定 试验于2020 年10 月在中国农业科学院植物保护研究所进行。将野生型菌株Aac5、突变菌株Δ和互补菌株Δcomp 培养至对数期,离心收集菌体,将菌液浓度调至3×10CFU·mL。每种菌液各吸取5 μL 轻点于0.3%半固体培养基上,待菌液晾干后28 ℃正置培养2 d,观察各菌株菌落大小,测量晕圈直径。每处理9 个生物学重复,试验设置3 次重复。
1.2.6 生物膜形成能力测定 试验于2020 年11 月在中国农业科学院植物保护研究所进行。将野生型菌株Aac5、突变菌株Δ和互补菌株Δcomp培养至对数期,离心收集菌体,将菌液浓度调至3×10CFU·mL。各取1 mL 菌液加入24 孔聚苯乙烯板(COSTAR),28 ℃培养2 d,弃菌液,80 ℃固定30 min,无菌水清洗。加入1 mL 0.1%结晶紫室温静置染色30 min,弃废液。无菌水清洗3~5 次至清洗液透明,37 ℃烘干,拍照。加入1.2 mL 95%乙醇溶解染色的生物膜,测定每孔OD下洗脱液吸光值。每种菌株测定9 个样品,3 次重复。
1.2.7 体外生长能力测定 试验于2021 年1 月在中国农业科学院植物保护研究所进行。将野生型菌株Aac5、突变菌株Δ和互补菌株Δcomp培养至对数期,室温离心收集菌体,将菌液浓度调至3×10CFU·mL。每种菌液各吸取200 μL 加入到聚苯乙烯板(COSTAR)中,放入自动生长曲线仪(芬兰,Biosceen)中28 ℃震荡培养,每2 h 测定1 次OD值,试验持续进行72 h。每种菌株测定9 个样品,3 次重复。
1.2.8 基因表达量测定 试验于2020 年8 月在中国农业科学院植物保护研究所进行。通过TRIzol法提取野生型菌株Aac5 和突变菌株Δ的总RNA,将菌液浓度调节一致后使用试剂盒反转录成cDNA。试验选取为内参基因,通过qPCR对III 型分泌系统(T3SS)基因(、、)、鞭毛相关基因()、群体感应基因()、趋化性基因()及磷酸盐特异性转运系统相关基因(、、、、)的表达量进行测定。采用相对定量(2)的方法分析结果。试验所用引物见表3。

表3 试验所用荧光定量PCR 引物
1.2.9 PstS 蛋白的原核表达 试验于2021 年3 月在中国农业科学院植物保护研究所进行。利用pET28a--F/R(表2)以西瓜噬酸菌Aac5 基因组DNA 为模板,用KOD Neo 高保真酶体系扩增基因片段。使用限制性内切酶H I/I对质粒pET28a 进行双酶切,构建原核表达载体pET28a-,将产物转化至大肠杆菌BL21(DE3)(TaKaRa)感受态细胞中。摇培至OD=0.6~0.8时,取6 mL 上述菌液加入终浓度为1 mmol·L的异丙基--D-硫代半乳糖苷(IPTG),37 ℃继续诱导4 h。取菌液1 mL,12 000 r·min,4 ℃离心10 min,弃上清液。加入100 μL 无菌水,混匀后加入等体积的蛋白上清液缓冲液。95 ℃变性10 min,12 000 r·min离心3 min。通过SDS-PAGE 凝胶电泳(12%分离胶,5%浓缩胶)检测重组蛋白是否表达。
1.2.10 PstS蛋白的Pi结合能力 试验于2021 年3月在中国农业科学院植物保护研究所进行。利用钼酸铵分光光度法检测溶液中磷酸盐含量。将含有pET28a-质粒和空载质粒的大肠杆菌用含有Km 的LB 液体培养基37 ℃培养,至菌液浓度为OD=0.6~0.8 时,加 入 终 浓 度 为1 mmol·L的IPTG,37 ℃继续诱导培养12 h。4 ℃,7500 r·min离心收集菌体,用0.2、0.5、1.0、2.0 mg·L的KHPO溶液调节菌体浓度至OD=0.5、1.0、1.5。室温反应6 h 后,4 ℃,7500 r·min离心,用0.45 μm 滤器过滤取上清5 mL 加入50 mL 具刻度磨口试管中。加入ddHO 稀释至25 mL 后再加入4 mL 50 g·L过硫酸钾溶液,盖上塞子,于120 ℃恒温干燥箱内消解30 min。冷却至室温后加入ddHO 稀释至50 mL。加入抗坏血酸溶液1 mL,混匀,继续反应30 s。加入钼酸盐溶液2 mL,混匀,静置15 min,用分光光度计检测其在710 nm 波长处的吸光值,制作标准曲线得出Pi 含量。比较空载与含有重组质粒的菌体对Pi 的吸收差异,Pi 的结合率=[(反应前溶液中的Pi 含量-反应后溶液中的Pi 含量)/反应后溶液中的Pi 含量]×100%,分析在大肠杆菌中表达的西瓜噬酸菌蛋白PstS 对Pi 的结合能力。
1.2.11 数据统计与分析 试验数据用EXCEL 2019 整理和计算,用SPSS 22 进行统计分析,使用单因素方差分析法进行不同菌株间的差异显著性分析,使用独立样本检验进行基因表达量的差异显著性分析,使用GraphPad Prism 7 制图。
2 结果与分析
2.1 西瓜噬酸菌PstS蛋白结构域
根据SMART 在线预测,PstS 蛋白(登录号:A1TQG0_ACIAC)含有一个位于44~254 氨基酸区域的PBP-like 结构域,推测其与Pi 的结合有关(图1)。

图1 PstS 的结构与分析
2.2 突变菌株及互补菌株的构建与验证
通过三亲本杂交的方法将质粒pK18-导入野生型菌株Aac5 中,经过同源重组双交换,得到缺失的突变株。用西瓜噬酸菌的特异性引物WFB1/WFB2 对获得的突变株进行PCR 电泳验证,结果显示能够扩增出360 bp 的正确条带(图2-A),确定其为西瓜噬酸菌;使用目的基因检测引物-F/R,进行PCR 验证,突变株无法扩增出目的片段(图2-B),证明成功敲除基因。使用同样的方法获得互补菌株并进行PCR 验证,结果显示能够扩增出正确的(535 bp)目的片段(图2-B),证明获得了正确的互补菌株Δcomp。
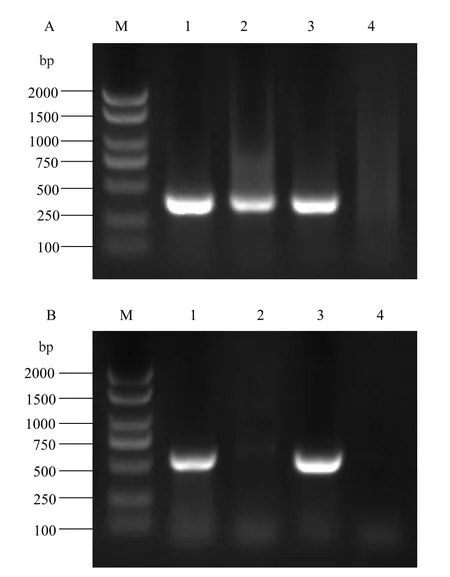
图2 ΔpstS 和ΔpstScomp 菌株的电泳验证
2.3 致病能力测定
喷雾接种8 d 后调查发病情况,接种西瓜叶片的发病症状和病情指数见图3-A 和图3-B,接种了野生型菌株Aac5 的西瓜叶片出现大小不同的病斑,病情指数为23.93;而接种突变菌株Δ的西瓜叶片发病症状较轻,病情指数为14.50,表明突变菌株的致病力下降;接种互补菌株Δcomp 的西瓜叶片病情指数为21.93,高于突变菌株并接近野生型菌株,说明互补菌株部分恢复致病力。与野生型菌株Aac5 和互补菌株Δcomp 相比,接种突变菌株Δ的西瓜病情指数显著降低,表明基因影响西瓜噬酸菌的致病能力。

图3 西瓜噬酸菌Aac5、ΔpstS 和ΔpstScomp 菌株致病能力检测
2.4 烟草过敏性坏死反应测定
注射野生型菌株、突变菌株和互补菌株菌悬液,无菌水为阴性对照(CK),24 h 后观察结果。由图4 可以看出,注射3 种菌悬液的烟草均产生过敏性坏死反应,表明基因的缺失不影响西瓜噬酸菌在非寄主烟草上的致敏性。

图4 烟草过敏性反应测定
2.5 运动能力测定
培养2 d 后对各菌株菌落进行测量、记录和拍照,发现Aac5、Δ和Δcomp 菌株的菌落晕圈直径分别为1.33、0.93 和1.16 cm,与野生型菌株Aac5 相比,突变菌株Δ所形成的晕圈直径最小,差异低于野生型菌株和互补菌株;互补菌株Δcomp 能够部分恢复运动能力(图5-A~B)。以上结果表明,基因的缺失导致西瓜噬酸菌运动能力降低。

图5 西瓜噬酸菌Aac5、ΔpstS 和ΔpstScomp 菌株运动能力检测
2.6 生物膜形成能力测定结果
在24 孔聚苯乙烯板内壁上观察Aac5、Δ和Δcomp 菌株的生物膜形成情况,使用95%乙醇溶解后,测量OD下的吸光值,分别为0.86、0.64和0.85。结果表明,与野生型菌株Aac5 相比,突变菌株Δ的吸光值显著低于野生型菌株和互补菌株;互补菌株Δcomp 的生物膜形成能力能够恢复至野生型菌株的水平(图6-A~B)。表明基因缺失导致西瓜噬酸菌生物膜的形成能力降低。

图6 西瓜噬酸菌Aac5、ΔpstS 和ΔpstScomp 菌株生物膜形成能力检测
2.7 体外生长能力测定结果
对野生型菌株Aac5、突变菌株Δ和互补菌株Δcomp 的体外生长能力测定后发现,与野生型菌株相比,突变菌株Δ的生长速度降低且达到对数期的时间较晚,互补菌株Δcomp 能够部分恢复体外生长能力(图7)。
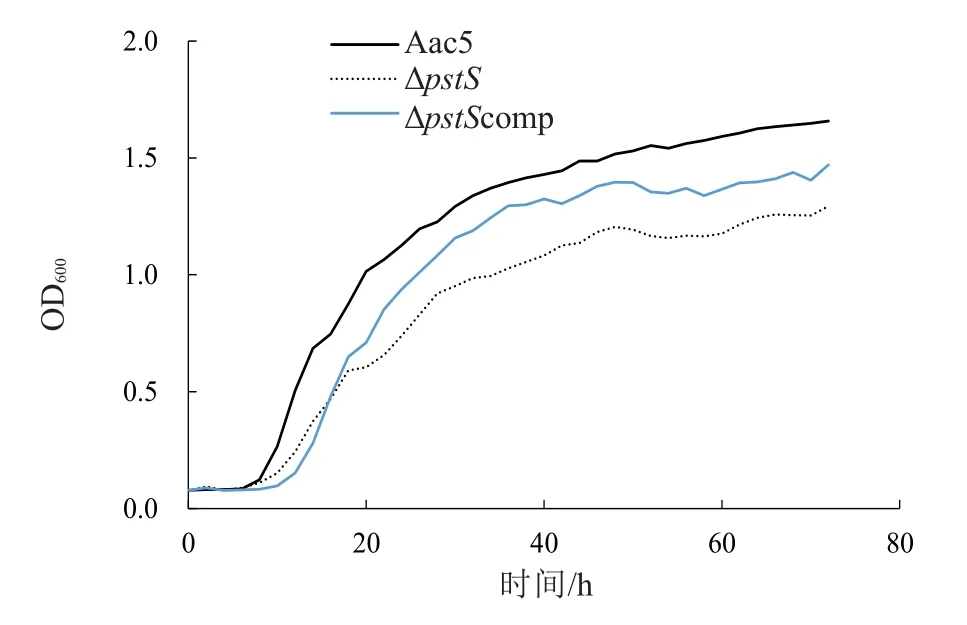
图7 西瓜噬酸菌Aac5、ΔpstS 和ΔpstScomp菌株体外生长能力检测
2.8 基因相对表达量测定
对野生型菌株和突变菌株中磷酸盐特异性转运系统相关基因的相对表达量检测后发现,与野生型菌株Aac5 相比,基因的缺失导致、、、和相对表达量显著上调(图8-A),表明基因负调控等基因的表达。利用qPCR 检测致病相关基因相对表达量后发现,与野生型菌株Aac5 相比,突变株Δ中,T3SS 关键调控基因相对表达量显著上调,相对表达量显著下调,相对表达量与野生型菌株差异不显著;鞭毛相关基因、毒力相关基因、趋化性相关基因和群体感应相关基因的相对表达量均显著上调(图8-B)。

图8 ΔpstS 菌株中相关基因相对表达量检测
2.9 PstS蛋白的原核表达结果
利用SDS-PAGE 凝胶电泳检测的结果显示,与含有pET28a 质粒的大肠杆菌相比,含有重组质粒pET28a-的大肠杆菌总蛋白中有一条区别于对照组的条带,且大小与PstS-6×His 融合蛋白大小(36.7 kDa)基本一致(图9),说明PstS 蛋白在大肠杆菌中被成功异源表达。
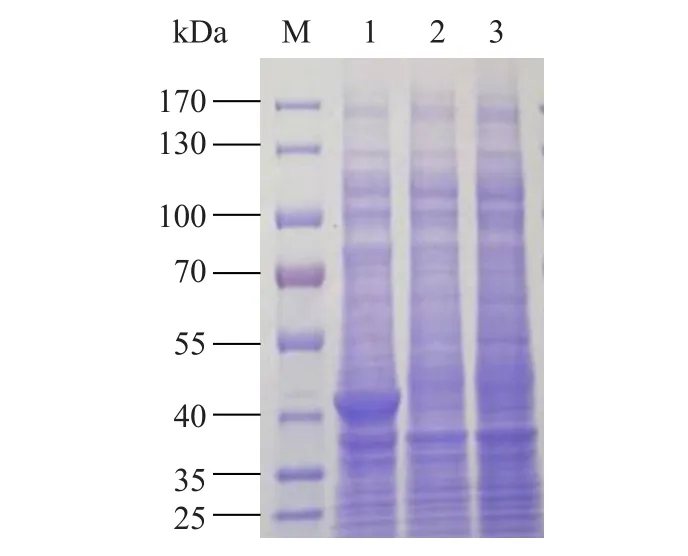
图9 PstS 蛋白的原核表达
2.10 PstS蛋白的Pi结合能力测定
在不同Pi 浓度和不同菌液浓度下测定菌株PstS 蛋白对Pi 的结合率。结果显示,在Pi 质量浓度为0.2 mg·L、菌液浓度为OD为0.5 时,PstS 蛋白与Pi 的结合率最高;在Pi 质量浓度为0.5 mg·L、菌液浓度为OD=1.5 时,PstS 蛋白与Pi的结合率最低(图10-B)。
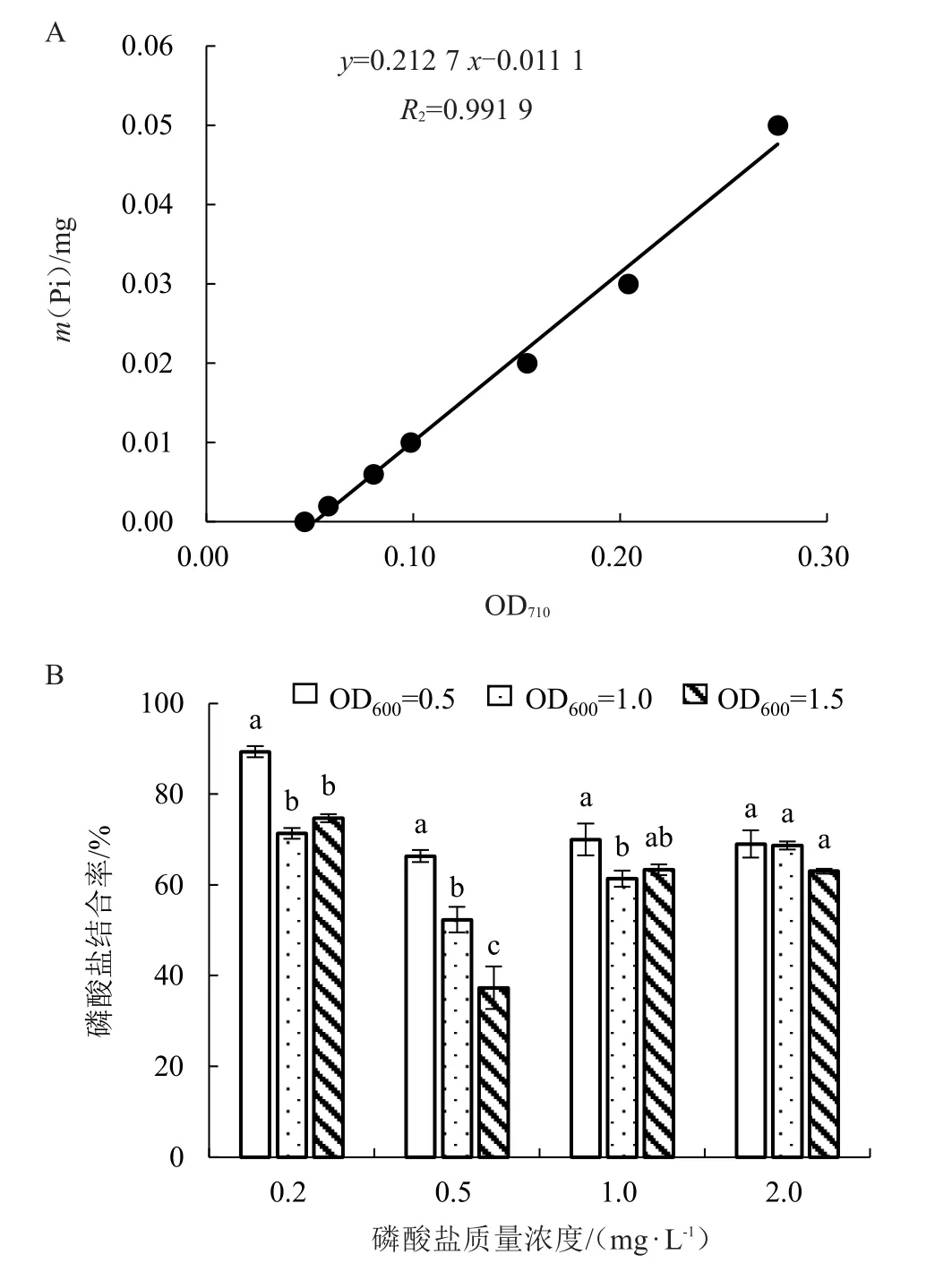
图10 PstS 蛋白的标准曲线和Pi 结合能力
3 讨论与结论
磷酸盐是细胞功能实现和生命维持所必需的营养物质,广泛存在于脂质、核酸、蛋白质和糖类中,对细胞的生物过程有着重要的作用。笔者通过对PstS 蛋白的原核异源表达研究,证实了西瓜噬酸菌中PstS 蛋白具有Pi 结合能力。这与Blus-Kadosh 等在铜绿假单胞菌中发现基因影响Pi 吸收的研究结果一致。目前对的研究多集中于其对磷酸盐的转运方面,而对其在病原菌致病过程中所起到作用的研究较少。笔者研究发现,西瓜噬酸菌基因缺失突变菌株Δ的致病能力较野生型菌株Aac5 降低。大多数革兰氏阴性菌的致病都依赖于T3SS,T3SS 的HrpG 和HrpX对于基因簇、III 型效应子和毒力基因的表达具有重要作用。或的缺失会导致西瓜噬酸菌失去对寄主的致病能力和引起非寄主烟草的过敏性坏死反应。笔者研究表明,通过荧光定量PCR 分析了基因缺失后西瓜噬酸菌中T3SS 基因、、表达量的变化情况,发现基因缺失后,西瓜噬酸菌中表达量显著上调,而表达量显著下调,表达量变化虽然不显著但也是下降的趋势。笔者推测,基因缺失后,西瓜噬酸菌T3SS 调控基因及T3SS 相关基因的表达受限是其致病能力降低的原因之一。
西瓜噬酸菌的鞭毛、群体感应和趋化性等都是影响西瓜噬酸菌的致病能力的重要因素。张爱萍等研究发现,的缺失会导致西瓜噬酸菌的运动能力显著降低。而在本研究中,与野生型菌株Aac5 相比,Δ菌株运动能力显著降低,且鞭毛相关基因在Δ中的表达量显著上升,这表明基因对运动能力的影响是独立于的。此外,毒力相关基因、群体感应相关基因和趋化性相关基因在Δ菌株中的表达量显著上升,说明基因可以调控多种致病相关基因在西瓜噬酸菌内的表达,进而影响西瓜噬酸菌的致病能力。
Pst 系统在细菌对Pi 的吸收和转运过程中具有重要作用,其能够维持细菌磷酸盐的稳态。从本研究中的荧光定量PCR 分析结果可知,基因缺失后,Pst 系统其他基因的表达量均显著上调,这可能是对基因缺失的一种弥补反应。杨雪等研究发现溶磷菌wj1 PstS 蛋白具有结合Pi 的能力,菌液浓度相同时Pi 溶液浓度的增加会抑制wj1 PstS 蛋白对Pi 的结合。诱导基因表达检测蛋白对Pi 的结合能力发现,试验设置的3 个菌液浓度在不同的Pi 浓度环境中PstS 蛋白都能与Pi 结合,这与杨雪等的研究结果一致。在低Pi 浓度时,PstS 与Pi 结合的能力最强,证实了Pst 系统在低Pi环境中对细菌磷酸盐转运的重要作用。
笔者的研究初步分析了基因缺失对西瓜噬酸菌的致病能力及生物学表型的影响,证实了西瓜噬酸菌的PstS 蛋白具有Pi 结合能力。但是对于Pst 系统中的其他基因功能以及他们之间的相互作用关系尚未明确。在后期的研究中,需要进一步探究在不同Pi 浓度下西瓜噬酸菌的生长能力、基因缺失后的Pi 结合能力和相关表型,从而进一步明确该基因在西瓜噬酸菌中的功能。
