化学计量与阿伏加德罗常数试题的解题策略
2022-10-26陈博
陈 博
(杭州第二中学钱江学校)
有关阿伏加德罗常数的计算与分析是历年来全国各地高考命题的热点也是重点,每年的题量和题型保持相对稳定,不但考查以基础知识为载体的一些相对简单的计算,还考查考生的知识综合应用能力和分析判断能力.本文例析相关试题,以期能提高解答此类试题的准确率.
1 有关氧化还原反应中转移电子数目的计算
例1设NA为阿伏加德罗常数的值.下列说法正确的是().
A.(2021年1月浙江卷)向100mL0.10mol·L-1FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NA
B.(2021年全国甲卷)3 mol的NO2与H2O 完全反应时转移的电子数为4NA
C.(2021年河北卷)电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA
D.(2021 年福建卷)电解熔融MgCl2制2.4g Mg,电路中通过的电子数为0.1NA
解析100mL0.10mol·L-1FeCl3溶液中铁离子的物质的量是0.01 mol,加入足量Cu粉充分反应,铁离子被还原为亚铁离子,则转移的电子数目为0.01NA,选项A 正确.NO2与H2O 反应的化学方程式为3NO2+H2O=2HNO3+NO,该反应消耗3个NO2分子转移的电子数为2 个,则有3 mol的NO2参与反应时,转移的电子数为2NA,选项B错误.电解饱和食盐水时电极总反应为
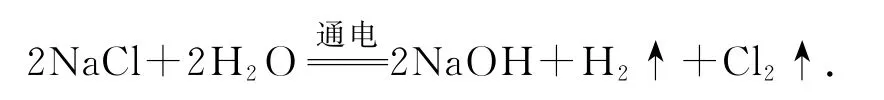
阴阳两极产生气体分别是氢气与氯气,且物质的量之比为1∶1,若气体的总质量为73g,则说明反应生成的氢气与氯气的物质的量各为1 mol,由关系式H2~2e-可知,转移的电子数为2NA,选项C 错误.电解熔融的MgCl2生成金属镁,镁由+2价降低到0价,因此1molMgCl2完全电解生成金属Mg,转移2 mol电子,则电解熔融MgCl2制2.4g Mg,电路中通过的电子数为0.2NA,选项D 错误.答案为A.
解题策略该类试题的命题角度多为特殊氧化还原反应中转移电子数目的计算,主要备考策略有:
1)注意是否发生歧化反应,如Cl2与NaOH 发生歧化反应,消耗1molCl2转移1mol电子.
2)注意变价元素,变价元素的单质参与反应时,反应物的量不同,所表现的化合价不同;如1 molFe与足量盐酸反应转移2mol电子,而与足量硝酸反应转移3mol电子,Fe过量,则生成Fe2+,要加以区别判断.另外要注意,氧化剂或还原剂不同,所表现的化合价不同,如Cu与Cl2反应生成CuCl2,而Cu与S反应生成Cu2S.
3)注意氧化还原的竞争及用量问题.如还原性I->Fe2+>Br-,向FeBr2溶液中通入Cl2,Cl2先与Fe2+反应再与Br-反应,向FeI2溶液中通入Cl2,Cl2先与I-反应再与Fe2+反应,Cl2的量不同,转移的电子数则不同.
2 有关电解质溶液中微粒数目的计算
例2设NA为阿伏加德罗常数的值.下列说法正确的是().
A.(2021年全国甲卷)1LpH=4 的0.1 mol·L-1K2Cr2O7溶液中离子数为0.1NA
B.(2021年湖南卷)0.1mol·L-1HClO4溶液中含有的H+数为0.1NA
C.(2021年广东卷)1L0.1mol·L-1的盐酸含有阴离子总数为2NA
D.(2021年河北卷)1L1mol·L-1溴化铵水溶液中与H+离子数之和大于NA
解析酸性K2Cr2O7溶液中存在以下平衡反应:含Cr元素微粒有,则1LpH=4的0.1mol·L-1K2Cr2O7溶液中离子数应小于0.1NA,选项A 错误.选项B 未给出0.1 mol·L-1HClO4溶液的具体体积,无法计算,错误.盐酸为氯化氢的水溶液,氯化氢会全部电离出阴离子Cl-,水会部分电离出阴离子OH-,水的质量及电离程度未知,故无法计算1L0.1 mol·L-1的盐酸含有阴离子总数,选项C错误.1L1mol·L-1溴化铵水溶液存在电荷守恒,即c()+c(H+)=c(Br-)+c(OH-),则物质的量也满足

因为n(Br-)=1L×1mol·L-1=1mol,所以该溶液中与H+离子数之和大于NA,选项D 正确.答案为D.
解题策略该类试题的命题角度主要是考查电解质在溶液中的存在形式,绝大多数需要利用公式cV=n进行解题,具体的表现形式如:弱酸溶液中所含的H+数目,弱碱溶液中所含的OH-数目;强酸弱碱盐溶液中所含的阳离子数,强碱弱酸盐溶液中所含弱酸根的离子数等.解题时要注意以下几点.
1)“三看”,如图1所示.

图1
2)所给条件是否与电解质的组成有关,如pH=3的H2SO3溶液中c(H+)=10-3mol·L-1,与电解质组成无关;0.05mol·L-1的Ba(OH)2溶液中c(OH-)=0.1mol·L-1,与电解质组成有关.
3)求溶液中所含H、O 原子数时,不要忽略溶剂水中的H、O 原子数目.
3 有关“特殊条件”或“隐含反应”分析判断
例3设NA为阿伏加德罗常数的值,下列说法正确的是().
A.0.1molCH4与过量Cl2光照下反应生成的HCl分子数为0.4NA
B.(2021年1月浙江卷)CH4和C2H4混合气体2.24L(标准状况)完全燃烧,则消耗O2分子数目为0.25NA
C.(2021年河北卷)1 mol碘蒸气和1 mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA
D.(2021年广东卷)11.2LNO 与11.2LO2混合后的分子数目为NA
解析0.1 molCH4与过量Cl2在光照条件下反应生成多种氯代甲烷的混合物,所以HCl分子数小于0.4NA,选项A 错误.CH4和C2H4混合气体2.24L(标准状况)的物质的量是0.1mol,由于1mol CH4和C2H4完全燃烧消耗氧气的物质的量分别是2mol、3mol,则0.1mol混合气体完全燃烧消耗氧气的分子数目应该介于0.2NA和0.3NA之间,选项B错误.碘蒸气与氢气发生的反应为I2+H2⇌2HI,反应为可逆反应,有一定的限度,所以充分反应,生成的碘化氢分子数小于2NA,选项C 正确.选项D 未提到具体的温度、压强(如标准状况),故无法计算11.2L NO 与11.2LO2混合后的分子数目,错误.答案为C.
解题策略该类试题是考生容易失分的,因反应过程“隐含”着特殊情况,稍不留神就会掉入命题人设计的陷阱.因此要识破隐含的可逆反应,记住反应条件、反应物浓度变化对反应的影响,突破陷阱.常涉及的命题范围有以下几点.
1)若反应为可逆反应,由于可逆反应不能进行到底,反应物不能完全转化,如工业合成氨的反应为

2)注意有些物质常温、常压下以聚合分子形式存在.如:2NO2⇌N2O4,2HF⇌(HF)2等含有特殊的转化关系.
3)注意特殊的反应条件,有些反应物的浓度不同,反应不同.如,铜与硝酸的反应、铜与浓硫酸的反应、二氧化锰与浓盐酸的反应等.
4)注意有些反应的反应物用量不同,反应不同.如二氧化碳与碱的反应,碳酸钠与盐酸的反应,石灰水与碳酸氢钠的反应等.
5)具有特殊结构物质的混合物(如一定量的乙炔与苯的混合物)耗氧量的计算等.
综上所述,有关阿伏加德罗常数的考查涉及的知识面广,可以横跨不同的模块知识,灵活性强,考查考生严密的分析计算能力,预计在今后的高考中仍是高频考点,因此在复习时要注意常见的设陷方式,才能使我们的备考针对性更强而且更为高效.
(完)
