鲤疱疹病毒3型ORF57基因工程亚单位疫苗制备及免疫保护研究
2022-10-26刘舒亚何汶璐黄双慧任永强黄小丽陈德芳欧阳萍
刘舒亚,何汶璐,陶 雨,黄双慧,任永强,耿 毅,黄小丽,陈德芳,欧阳萍,*
(1.四川农业大学 动物医学院,四川 成都 611130; 2.西南医科大学附属中医医院 中葡中医药国际合作中心,四川 泸州 646099; 3.四川农业大学 动物科技学院,四川 成都 611130)
锦鲤疱疹病毒(Koi herpesvirus,KHV),又名为鲤鱼疱疹病毒3型(Cyprinid herpesvirus 3,CyHV-3),是一种线性、双链DNA病毒,基因组大小约为295 kb,编码155个开放阅读框(open reading frame,ORF),是疱疹病毒目中已知的最大的疱疹病毒。1998年在以色列首次报道,该病于2001年在香港首次暴发,随后东南亚许多国家相继报道鲤鱼感染CyHV-3。自20世纪90年代末出现以来,这种具有高度传染性和高死亡率的疾病对世界范围内的锦鲤及普通鲤鱼养殖业都造成了严重的经济损失。
现这种疾病在世界上广泛分布,该病常发生于春秋两季,所有年龄段的鲤鱼、锦鲤和鲤鱼变种都是受感染的物种。临床症状表现为背鳍折叠、食欲不振、呼吸困难、体表黏液增多,患病鱼眼球凹陷,皮肤出血疱疹样变,鳃苍白或坏死等。病毒在鳃、肠、肝、脑和肾组织中复制,死亡率高达80%~100%。由于其发病范围广,死亡率高,已被列入世界动物疫病名录。有学者认为,病毒首先通过鳃感染,鳃坏死细胞携带大量病毒传播到水环境中,然后再感染其他个体。然而通过生物发光成像分析,CyHV-3可能通过皮肤进入鱼体,鲤鱼皮肤的损伤区和伤口愈合区很容易发生病毒入侵。目前对其只能通过疫苗、生物安全措施或育种来预防和控制CyHV-3感染,暂无有效的治疗药物。
目前通过基因工程制作亚单位疫苗,将目的基因插入合适的载体中,构建重组表达质粒,已显示出最好的中等效力。然而CyHV-3的结构和功能尚处于探索阶段,由于目前市场上无高效、安全、防治CyHV-3的疫苗,基因工程亚单位疫苗因其具备安全性高、稳定性好、产量高等特点,所以成为CyHV-3新型疫苗开发的一个重要方向。CyHV-3的155个开放读码框中只有少数被研究,例如,ORF25、ORF26、ORF27、ORF65、ORF148和ORF149编码的膜糖蛋白,ORF16编码的G蛋白偶联受体,ORF134编码病毒IL-10,ORF12编码肿瘤坏死因子受体同源性,ORF57、ORF81、ORF83可编码囊膜蛋白,ORF72和ORF92编码衣壳蛋白。这些开放阅读框编码的蛋白有很大的潜力被应用于亚单位疫苗的研发。
与其他疱疹病毒类似,CyHV-3的成熟病毒粒子由DNA核心、衣壳、被膜和囊膜组成。在最近的一项研究中,通过基于抗CyHV-3抗体的亲和性,从鲤鱼组织中鉴定出78种宿主蛋白和5种潜在的免疫原性病毒蛋白。在结构蛋白中,由于囊膜蛋白参与宿主-病毒的相互作用,如在病毒感染和组装过程中与细胞受体的黏附和与宿主细胞膜的融合,因此对疫苗的开发具有重要意义。
已有研究表明,CyHV-3 ORF57编码囊膜蛋白,具有被应用于亚单位疫苗研发的潜力。因此,本研究旨在检测ORF57的免疫原性,并检测其免疫后鲤鱼体内抗体的产生。将ORF57序列进行PCR扩增,将目的序列克隆到原核表达载体pET-32a(+),经大肠埃希菌原核表达系统获得重组蛋白ORF57。将其与免疫佐剂混合制备成亚单位疫苗对健康鲤鱼进行免疫接种,检测了ORF57亚单位疫苗对鲤鱼的免疫保护作用并对免疫后的鲤鱼体内抗体的产生进行了检测。为CyHV-3疫苗的开发及重组蛋白ORF57在免疫学中的应用提供了实验基础。
1 材料与方法
1.1 材料
1.1.1 病毒株、质粒及主要实验试剂
CyHV-3病毒株由四川农业大学鱼病研究中心分离鉴定并保存;健康鲤鱼IgM、pET-32a(+)空载蛋白、鲤鱼脑细胞系(CCB)由本实验室保存;克隆载体pMD19-T,表达载体PET-32a (+),购自宝生物工程(大连)公司;大肠埃希菌DH5α感受态细胞、大肠埃希菌BL21(DE3),购自天根生化科技有限公司;辣根过氧化物酶(HRP)标记的羊抗鼠Ig(二抗)、鼠抗His标签(一抗)Ni-NTA-Sefinose柱,购自生工生物工程(上海)股份有限公司。
1.1.2 实验动物
雄性健康新西兰大白兔,2 kg;购自成都达硕实验动物有限公司;健康鲤鱼,(50±5) g,购自宜宾翠屏区某鲤鱼养殖场。
1.2 方法
1.2.1 CyHV-3 ORF57序列的克隆
根据GenBank上CyHV-3全基因组序列(GenBank登录号为 DQ657948.1),Primer Premiers 5.0软件设计特异性引物,引物序列见表1。将CyHV-3病毒液接种于CCB细胞培养至细胞出现细胞病变,收集细胞沉淀,提取RNA,反转录成cDNA。以cDNA为模板,进行PCR扩增。PCR反应体系:2×PCR Master Mix12.5 μL,cDNA模板1 μL,上游引物1 μL,下游引物1 μL,ddHO 9.5 μL。反应条件:95 ℃预变性5 min;94 ℃变性50 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。

表1 CyHV-3 ORF57序列的特异性引物
PCR产物进行1%琼脂糖凝胶电泳,将含有目的基因的凝胶块回收。回收产物与pMD19-T连接,转至DH5α感受态细胞,筛选阳性克隆进行菌液PCR 和双酶切鉴定。酶切反应体系:HⅠ 0.5 μL,dⅢ 0.5 μL,重组质粒5 μL,10×Green Buffer 1 μL,ddHO 3 μL。反应条件:37 ℃,30 min。鉴定正确的重组克隆质粒命名为pMD19-T- CyHV-3-ORF57,阳性质粒送至生工生物工程(上海)股份有限公司测序验证。
1.2.2 CyHV-3 ORF57序列及蛋白质结构分析
使用ProtParam在线工具(https://www.expasy.org/tools)将CyHV-3 ORF57序列的核苷酸序列翻译成氨基酸序列;使用 ProtScale(https://web.expasy.org/protscale/)在线工具进行氨基酸序列亲/疏水性分析,TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)程序进行跨膜区预测,SignalP-5.0在线预测信号肽(http://www.cbs.dtu.dk/services/SignalP/),选用KinasePhos(http://kinasephos.mbc.nctu.edu.tw/)在线分析磷酸化位点,应用Psipred(http://bioinf.cs.ucl.ac.uk/psipred/)在线程序和PyMOL软件分别预测蛋白质的二级结构和三级结构。
1.2.3 重组表达质粒的构建和鉴定
将含重组质粒pMD19-T-CyHV-3-ORF57与表达质粒pET-32a(+)的菌株分别接种于含AMP的LB液体培养基培养。提取质粒并对表达质粒和重组克隆质粒进行酶切鉴定。1%琼脂糖凝胶电泳分离酶切鉴定产物,回收目的片段。目的片段与表达质粒pET-32a(+)于16 ℃连接过夜,连接反应体系:目的片段回收产物3.5 μL,胶回收表达质粒pET-32a 1 μL,T4 DNA Ligase 0.5 μL,10×T4 DNA Ligase Buffer 1 μL,ddHO 4 μL。连接产物转化至DH5α感受态细胞, 筛选阳性克隆进行菌液PCR和酶切鉴定。将鉴定正确的重组表达质粒命名为pET-32a(+)-CyHV-3-ORF57。
1.2.4 重组蛋白的表达、纯化和特异性检测
重组质粒pET-32a(+)-CyHV-3-ORF57转化入表达菌株BL21(DE3),将其接种于含AMP的LB液体培养基中培养,37 ℃下150 r·min培养至=0.6,加入1.0 mmol·LIPTG继续37 ℃培养4 h。然后将菌液于8 000×离心10 min,弃掉上清,所得的菌体沉淀PBS重悬洗涤3次后,加入3 mL PBS重悬。将重悬的菌体放置于-80 ℃和室温中反复冻融3次,用超声进行破碎。超声后的菌体于8 000×离心10 min,转移上清液到新的离心管中,并用3 mL 8 mol·L尿素溶解剩余的沉淀。最后将得到的蛋白上清液样品和沉淀样品进行10% SDS-PAGE,分析目的蛋白在菌体中的表达分布情况。
对以包涵体形式表达的重组ORF57采用Ni-NTA-Sefinose柱进行纯化,使用核酸蛋白分光光度计测定纯化后的蛋白浓度,梯度透析复性法获得复性重组ORF57蛋白,10% SDS-PAGE进行分析。重组蛋白于-80 ℃保存备用。
用10% SDS-PAGE分离纯化的蛋白质,SDS-PAGE胶剥离后放入装有转膜缓冲液的平皿中,充分浸泡5~10 min。在转移盒负极上从下至上依次置放3张滤纸-凝胶-PVDF膜-3张滤纸,恒流150 mA转移1 h。之后将PVDF膜放入装有3% BSA/TBST 的平皿中,37 ℃封闭1 h。封闭完成后,用TBST洗涤PVDF膜 3 次,每次洗涤10 min。按1∶1 000 稀释一抗(兔抗 His 标签抗体),将PVDF膜放入装有一抗的平皿中,37 ℃孵育1~2 h,弃掉一抗,用TBST洗涤PVDF 膜3次,每次洗涤10 min。按1∶5 000 稀释二抗(HRP)标记的山羊抗兔 IgG,将PVDF膜放入装有二抗的平皿中,37 ℃孵育1 h。结束后,用TBST 洗涤PVDF膜。最后按照二甲基联苯胺(DAB)显色液说明书进行显色反应。
1.2.5 重组蛋白ORF57亚单位疫苗的免疫保护性研究
纯化后的重组蛋白ORF57与佐剂(渔用商品佐剂MontanideISA 763 AVG)等体积充分混合后制备成亚单位疫苗,选择健康鲤鱼[CyHV-3的PCR结果为阴性,(50.0±5.0)g]分为4组,每组30尾;分别为重组蛋白ORF57亚单位疫苗组、pET-32a(+)空载蛋白组、等量佐剂组和等量PBS组(空白组),在实验室(25±1)℃驯化14 d后采用腹腔注射的方式对健康鲤鱼进行接种,每尾注射200 μL,免疫3次,每次间隔14 d。从4组实验鱼中随机选取10尾在免疫后第1、2、3、4、5、6周每尾静脉采血0.5 mL收集血清为后续试验备用。
为检测疫苗对感染鱼的免疫保护情况,免疫28 d后,对重组蛋白ORF57亚单位疫苗组、PBS和pET-32a(+)空载蛋白组剩余的20尾实验鱼进行攻毒试验,采用腹腔注射攻毒,攻毒剂量为10PFU·尾。攻毒后观察各组鱼的临床表现,同时记录攻毒21 d内各组鱼的死亡情况,计算存活率。
1.2.6 鲤鱼血清抗体消长规律检测
将实验室制备的健康鲤鱼IgM用无菌PBS调整终浓度到1.0 mg·mL,与弗氏佐剂等体积混合后对大白兔进行免疫。免疫方式为背部皮下多点注射,注射剂量为2 mL,免疫次数为3次,每次间隔7 d,一免使用完全佐剂,二、三免使用不完全佐剂。免疫结束后1周耳缘静脉采血,静置离心后得到血清,采用盐析法制备兔抗鲤鱼血清抗体。
取免疫后1~6周鱼尾静脉血清,用ELISA法检测重组蛋白ORF57特异性抗体。将重组蛋白ORF57作为抗原,用磷酸盐缓冲液(pH 9.6)稀释至50 μg·mL;健康鲤鱼的血清为阴性对照。各组待测血清加入96孔板中,在4 ℃下包被过夜。用PBST(PBS中0.1%吐温-20)洗涤3次,然后37 ℃下用3% BSA在PBST中封闭2 h。以兔抗鲤鱼IgM抗血清(1∶200,本实验室制备)和山羊抗兔IgG-HRP(1∶2 000)分别作为一抗和二抗。最后3,3′,5,5′-四甲基联苯胺(TMB)显色液进行显色,2 mol·L浓硫酸终止显色,用酶标仪测定450 nm波长下的吸光度值,进行抗体含量的检测。
2 结果与分析
2.1 CyHV-3 ORF57生物信息学分析
CyHV-3 ORF57序列在CyHV-3的基因组中序列范围为99 382~100 830,大小为1 449 bp。该序列编码的多肽由473个氨基酸残基组成,其中含量较多的氨基酸为丙氨酸(Ala 10.8%)和天冬氨酸(Asp 8.9%),含量较少的是色氨酸(Trp 1.5%),并且没有吡咯赖氨酸(Pyl)和硒半胱氨酸(Sec)(图1-A), 其中带负电荷的残基总数(Asp + Glu)为71,带正电荷的残基总数(Arg + Lys)为59。亲/疏水性预测结果表明(图1-B),ORF57的多肽链之中,主要有4个疏水区,分别在其氨基酸序列的75~90位、96~115位、132~144位和404~421位,疏水性最高值是2.200,最低值是-3.200,并且亲水区明显多于疏水区,说明ORF57蛋白应是亲水蛋白。TMHMM跨膜区预测结果显示,ORF57编码的多肽链中没有跨膜区域,所有区域都在膜外,是个膜外蛋白(图1-C),并且该多肽链并没有信号肽序列(图1-D)。

A,ORF57氨基酸序列的组成分析;B,ORF57氨基酸序列的亲/疏水性分析;C,TMHMM程序对ORF57氨基酸序列的跨膜区预测;D,信号肽预测。A, Composition analysis of ORF57 amino acid sequence; B, Affinity/hydrophobicity analysis of ORF57 amino acid sequence; C, Prediction of transmembrane region of ORF57 amino acid sequence by TMHMM; D, Prediction of signal peptide.图1 ORF57氨基酸序列的组成分析、亲/疏水性分析以及跨膜区和信号肽的预测Fig.1 ORF57 amino acid sequence composition analysis, affinity/hydrophobicity analysis and prediction of transmembrane domain and signal peptide
根据NetPhos 3.1在线分析结果显示,当阈值为0.5时,ORF57的氨基酸序列中一共有47个磷酸化位点,这些位点分别为丝氨酸、苏氨酸和酪氨酸(图2)。Psipred在线程序对CyHV-3 ORF57二级结构的预测结果表明,ORF57编码氨基酸中含有50.53%的α-螺旋、9.94%的-β折叠、4.65%的β-转角以及34.88%的无规则卷曲(图3-A)。

图2 CyHV-3ORF57氨基酸序列的磷酸化位点预测Fig.2 Prediction of phosphorylation site of CyHV-3ORF57 amino acid sequence
通过寻找与ORF57多肽链具有较高同源性的已知3D结构模型,构建了ORF57多肽链3D结构,主要包含α-螺旋和无规则卷曲(图3-B)。

h,α-螺旋;e,β-折叠;t,β-转角;c,无规则卷曲。h, α-helix; e, β-sheet; t, β-turn; c, Random coil.图3 CyHV-3 ORF57蛋白的二级结构(A)和三级结构(B)预测Fig.3 Secondary structure (A) and tertiary structure (B) of CyHV-3 ORF57 protein
2.2 CyHV-3 ORF57序列扩增、克隆及鉴定
由图4-A可知以cDNA为模板,PCR扩增出1 449 bp的目的片段;对重组质粒进行酶切鉴定,结果显示:单酶切可见一条大小约为5 000 bp的线性条带;双酶切可见两条线性条带,与载体和目的片段大小一致(图4-B)。结果表明,CyHV-3 ORF57序列已成功连接到pMD19-T载体上。

A图中:M,DNA Marker 10000;1,ORF57序列扩增产物大小为1 449 bp;2,阴性对照。B图中:M,DNA Marker 10000;1,pMD19-T-CyHV-3-ORF57双酶切鉴定;2,pMD19-T-CyHV-3-ORF57单酶切鉴定。In Fig. A: M, DNA Marker 10000; 1, ORF57 amplification product; 2, Negative control. In Fig. B, M, DNA Marker 10000; 1, pMD19-T-CyHV-3-ORF57 double digestion identification; 2, pMD19-T-CyHV-3-ORF57 single digestion identification.图4 CyHV-3 ORF57序列的PCR扩增和T载体重组克隆质粒鉴定Fig.4 The PCR amplication result of the CyHV-3 ORF57 sequence and identification of cloing plasmid
2.3 重组表达质粒的构建和鉴定
重组原核表达质粒酶切和测序结果说明,CyHV-3-ORF57序列已经成功连接到pET-32a(+)载体上。结果显示:单酶切可见一条大小约为6 000 bp的线性条带;双酶切可见两条大小分别约为2 692 bp和1 449 bp的线性条带,与载体和目的片段大小一致(图5)。
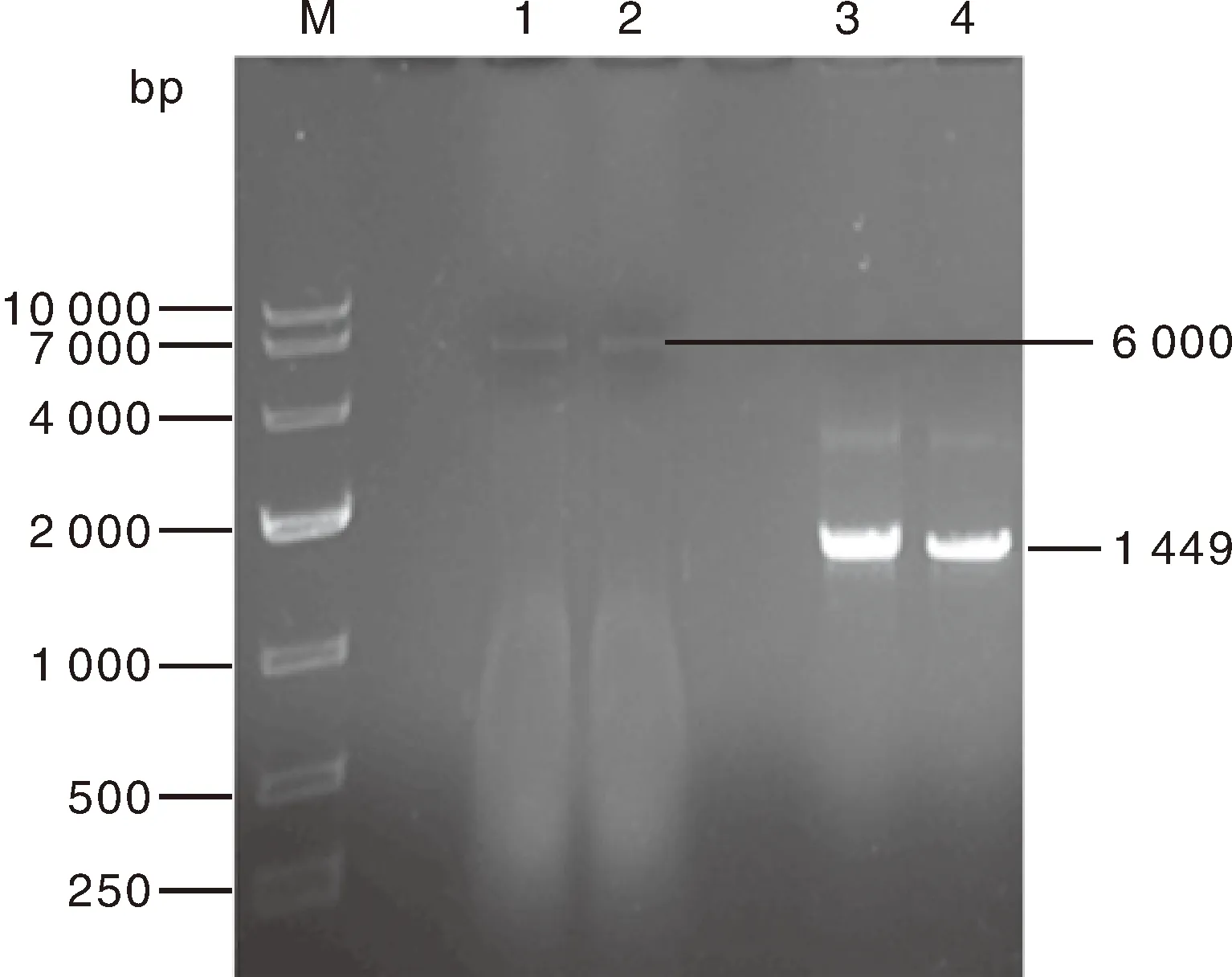
1、2,pET-32a(+);3、4,pMD19-T-CyHV-3-ORF57双酶切。1, 2, pET-32a (+); 3, 4, pMD19-T-CyHV-3-ORF57 double digestion.图5 CyHV-3-ORF57重组表达质粒的酶切鉴定Fig.5 Digestion identification of CyHV-3-ORF57 recombinant expression plasmid
2.4 重组蛋白ORF57的表达、纯化及鉴定
经SDS-PAGE鉴定得到大小约为75 ku的蛋白条带,符合预期的目的蛋白大小;结果表明,重组蛋白ORF57以包涵体形式存在(图6)。获得纯化的重组蛋白ORF57(图7-A)。纯化后的重组蛋白经Western blotting分析表明能与兔抗6×His抗血清和山羊抗兔IgG-HRP特异性结合(图7-B)。
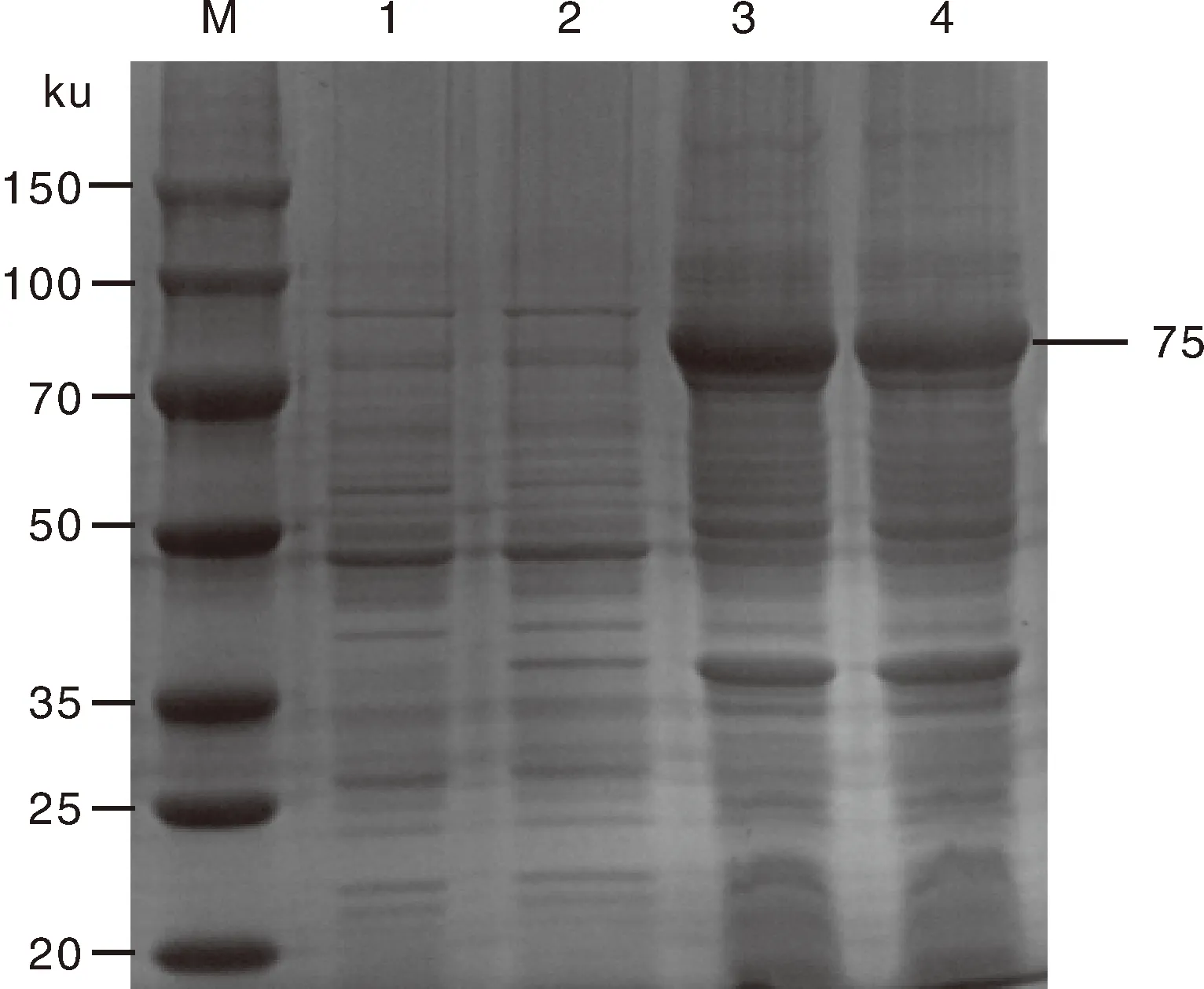
M,蛋白质Marker;1、2,IPTG诱导的BL21-pET32a菌液的上清;3、4,IPTG诱导的BL21-pET32a菌液的沉淀。M, Protein Marker; 1, 2, Induced supernatant of BL21-pET32a by IPTG; 3, 4, Induced precipitation of BL21-pET32a by IPTG.图6 重组蛋白ORF57的诱导表达Fig.6 Expression of recombinant protein ORF57

A图中:M,蛋白质Marker;1,纯化所得目的蛋白条带。B图中:M,蛋白质Marker;1,目的蛋白免疫印迹。In Fig. A: M, Protein Marker; 1, Purified protein. In Fig. B: M, Protein Marker; 1, Target protein.图7 重组蛋白ORF57的纯化和Western-blot验证Fig.7 Purification and Western-blot analysis of ORF57
2.5 亚单位疫苗对鲤鱼的免疫保护
采用Kaplan-Meier方法分析的存活数据表明,PBS组在攻毒第2天后出现大量死亡且最后存活率为10%,pET-32a(+)组的为15%,rpORF组为65%(图8)。数据分析结果表明,重组蛋白ORF57组鱼类存活率显著高于PBS组和pET-32a(+)组(<0.05),pET-32a(+)组与PBS组结果相似(图8)。
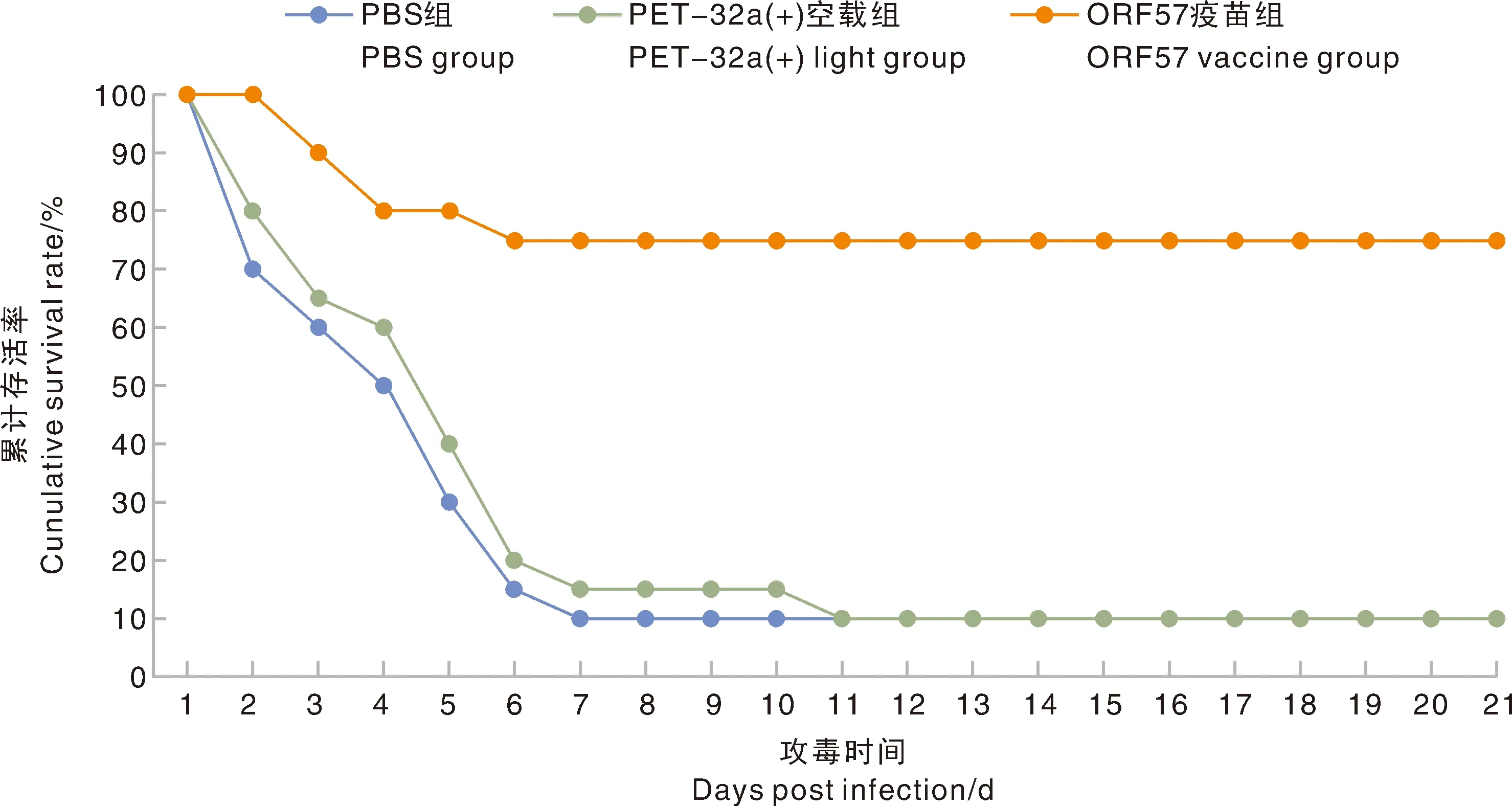
图8 攻毒后的累计存活率Fig.8 Cumulative survival rate after infection
2.6 血清抗体检测
血清抗体检测结果表明,在7~42 d,重组蛋白ORF57疫苗组的抗体水平显著高于PBS组、佐剂组和pET-32a(+)空载组(<0.05)。PBS组自始至终无明显变化,抗体水平最低。而佐剂组在7~14 d升高,21 d后开始下降,维持与PBS相同的水平。pET-32a(+)空载组抗体水平在7~14 d升高后下降,28~42 d与PBS组相似。不同的是,重组蛋白ORF57疫苗组的抗体水平显著升高。重组蛋白450 nm的吸光度保持在1.0左右,28 d达到峰值,35 d开始下降(图9)。

不同柱上没有相同小写字母表示差异显著(P<0.05)。The bars without the same lowercase letters indicated the significant difference(P<0.05).图9 ELISA法检测鲤鱼血清抗体水平Fig.9 The carp serum antibody levels detected by ELISA
3 讨论
随着水产养殖业的不断扩大和产量的不断增长,鱼类养殖密度不断增加,出现了许多水产病害,严重损害了水产养殖业的经济效益,尤其是病毒性病害。目前,疫苗已成为控制水产养殖中病毒感染的一种更有效、安全、绿色的干预手段。根据制备方法和生产方式的不同,可分为减毒疫苗、亚单位疫苗、灭活疫苗等传统疫苗和DNA疫苗等新型疫苗。
减毒疫苗又称为活疫苗,在防治过程中可能会因为继发性突变导致毒力的逆转,具有潜在的风险,并且在某些情况下,活疫苗可导致自身免疫力较差的个体出现严重并发症;灭活疫苗具有安全性好,无毒性或毒性较弱,易制备等优点,但其存在灭活制备时部分抗原受到破坏而导致免疫效果不理想,以及不具备交叉保护效果造成免疫失败的问题;而亚单位疫苗采用一定的方法只保留有效抗原成分,被保留下来的抗原成分具有稳定的免疫原性。目前在水生动物领域也已经报道了一些针对草鱼和鲤鱼的亚单位疫苗。作为最有前途的疫苗之一,亚单位疫苗和DNA疫苗等基因工程疫苗由于具有保护性免疫原的基础,有更安全、更独立于血清型的特点。因此,疫苗保护性的鉴定对于开发有效的基因工程疫苗至关重要。
CyHV-3因其高致病性及传染性,造成锦鲤和鲤鱼养殖业经济损失严重。CyHV-3 ORF57编码必需的毒力因子,是CyHV-3结构和功能特性研究最为深入的囊膜蛋白之一,研究表明,在ORF57序列缺失的情况下,病毒毒力降低,ORF57缺失病毒可作为减毒疫苗候选。一些学者发现ORF57在疱疹病毒中相对保守,包括鲤鱼疱疹病毒Ⅰ型(CyHV-1)、鲤鱼疱疹病毒Ⅱ型(CyHV-2)、鲤鱼疱疹病毒Ⅲ型(CyHV-3)和鳗鱼疱疹病毒Ⅰ型(AngHV-1)。在前3种疱疹病毒中,ORF57中的氨基酸序列相似性在67.5%~72.4%。在本研究中,利用生物信息学方法对ORF57序列的核苷酸序列和氨基酸序列进行分析,探讨其生物学功能。结果表明,ORF57编码的多肽链含有473个氨基酸残基,其中带负电荷的残基总数(Asp + Glu)为71,带正电荷的残基总数(Arg + Lys)为59。在跨膜区的预测中,结果显示,ORF57并没有跨膜区,其氨基酸残基都在外,证明其是膜外蛋白,位于外膜的蛋白很大一部分都具有良好的免疫原性。
选择ORF57作为抗原基因,设计特异性引物,PCR扩增ORF57序列。通过克隆、酶切和测序鉴定目的基因。将目的基因连接到pET-32a(+)表达载体上,用IPTG诱导ORF57的表达。表达产物经Ni-NTA柱亲和层析纯化,纯化后的蛋白经Western印迹检测。Western blot结果显示,重组蛋白ORF57与兔抗-6×His抗血清分别有特异性反应,并显示一条由ORF57序列、His-tag序列和部分表达质粒pET-32a(+)序列组成的预测带,这些结果表明,重组蛋白ORF57在体外得到了正确的表达,能够在鲤鱼体内提供保护,并具有抗原性,可作为疫苗开发的候选免疫原。
另外,血清抗体水平的测定是评价疫苗效果的直接方法。在本研究中,检测了PBS、佐剂、pET-32a(+)和ORF57治疗组的血清抗体水平。免疫7 d后鲤鱼血清抗体水平提高,免疫28 d后达到峰值,结果表明,重组蛋白ORF57可显著提高血清抗体水平,ORF57亚单位疫苗具有良好的免疫原性。此外商业佐剂在早期也有增强免疫的效果。通过计算存活率来评估亚单位疫苗对CyHV-3感染的有效性,鲤鱼免疫28 d后CyHV-3强毒攻毒具有75%的存活率,ORF57亚单位疫苗组鲤鱼的存活率显著高于PBS和pET-32a(+)组,证实重组蛋白ORF57亚单位疫苗对CyHV-3的感染具有免疫保护性。
综上所述,以ORF57和商品佐剂MontanideISA 763 AVG制成的亚单位疫苗注射免疫可提高鲤鱼的抗体水平和对CyHV-3的免疫保护率。ORF57作为候选抗原,可提高鲤鱼抗CyHV-3感染的抗体水平和存活率。本研究结果丰富了CyHV-3 ORF57的分子特征和系统发育信息,ORF57亚单位疫苗组鲤鱼的存活率显著高于对照组,表明ORF57有望作为亚单位疫苗使用。然而,要了解这种疫苗的实际临床应用效果,还需要进一步的实践。
