小柴胡汤对D-GalN/LPS诱导的虎龙杂交石斑鱼肝细胞损伤的保护作用
2022-10-25邹翠云陈小晶邬颖欣黄锦雄谭小红胡心月甘松永吴锦辉
邹翠云,陈小晶,邬颖欣,黄锦雄,谭小红,胡心月,甘松永,吴锦辉
1. 仲恺农业工程学院 动物科技学院/广东省水环境与水产品安全工程技术研究中心/广州市水产病害与水禽养殖重点实验室,广东 广州 510225
2. 广东省农业技术推广中心,广东 惠州 516081
目前,在集约化养殖条件下,养殖密度不断增大,致使水产动物疾病频繁发生。为了控制疾病,在水产养殖中会频繁使用抗生素和化学药物[1-2]。滥用化学药物常会导致鱼类肝脏疾病的发生,使其细胞肿胀,细胞质体积增加,内质网扩张、囊泡化,发生脂质过氧化从而导致细胞膜损伤[3]。还会使鱼类血清中总胆固醇 (TC)、谷丙转氨酶 (ALT)和谷草转氨酶 (AST) 显著升高,肝脏中总抗氧化能力 (T-AOC)、过氧化氢酶 (CAT) 和还原型谷胱甘肽 (GSH) 显著降低,肝脏和鳃中丙二醛 (MDA) 显著升高,引起鱼类氧化应激,损伤其抗氧化防御系统[4-5]。此外,水体中重金属及微量营养元素过量也会损坏鱼类肝细胞结构和酶活性,使肝脏组织发生病理性变化,给鱼类带来一系列不良影响,对渔业造成严重的危害[6-9]。
目前,有很多药物可以诱导建立动物肝损伤模型,但是一些重复性高、模拟性好的药物,毒性一般较大,建模结果多不稳定。用D-氨基半乳糖建模具有毒性小、使用方便等优点,但用于诱导动物肝损伤模型用量较大,且建立的模型不稳定[10]。D-氨基半乳糖联合脂多糖 (D-GalN/LPS) 诱导的肝损伤与临床病毒性肝炎非常相似,会引发大量的炎症反应,促进肝细胞的凋亡[11]。因此,这一模型被广泛应用于肝损伤病理生理学机制研究,评估保肝护肝药物的生物学活性。
鱼类饲料中添加不同浓度的复方中草药,可以显著增强免疫功能[12-13]。小柴胡汤是我国重要的复方中草药,由柴胡 (Bupleurum chinense)、黄芩(Scutellaria baicalensis)、甘草 (Glycyrrhiza uralensis)、人参 (Panax ginseng)、半夏 (Pinellia ternate)、生姜(Zingiber ofcinale) 和大枣 (Ziziphus jujube) 等 7味药组成,其中柴胡和黄芩是配伍中的君药,在小柴胡汤原方中,柴胡含量最高,占了将近2/3的量,其次为黄芩[14]。小柴胡汤因对慢性肝炎有疗效且可有效预防肝硬化患者向肝癌发展而引起了极大的关注[15]。此外,多项动物模型或细胞模型的研究表明,小柴胡汤及其成分对实验性肝损伤具有细胞保护效果,对慢性肝炎有抗炎作用,通过抑制肝星状细胞对实验性肝纤维化具有预防和治疗效果,可改善肝细胞中的脂质过氧化[16]。小柴胡汤有抗炎、抗病毒、抗菌、抗氧化及提高免疫功能等多种生物效应,因此作为保肝护肝的中草药在国内外广泛使用[17]。先前养殖实验研究表明,小柴胡汤对DGalN/LPS诱导的石斑鱼化学性肝损伤有明显的保护作用[18],但尚未有细胞水平机制的报道。本文主要在细胞水平上探讨了小柴胡汤对D-GalN/LPS引起的肝损伤和氧化损伤的保护作用,以为鱼类保肝药物研究提供新思路。
1 材料与方法
1.1 材料与试剂
虎龙杂交石斑鱼 (Epinephelus lanceolatus♂×E. fuscoguttatus♀) 健康个体由广东省海洋渔业试验中心提供,体质量约30~50 g,平均体长12~15 cm,室温下,在循环养殖系统中暂养15 d,再用于实验。MEM培养基 (HyClone)、PBS、链霉素/青霉素 (Streptomycin/Penicillin)、0.25%胰蛋白酶和0.5%台盼蓝购于SIGMA公司 (美国);新鲜胎牛血清 (FBS) 购于GIBCO公司 (美国);CCK-8购于碧云天生物技术研究所。
1.2 细胞处理
虎龙杂交石斑鱼原代肝细胞分离培养后进行传代,将细胞置于25 ℃、5% (体积分数)二氧化碳(CO2)的培养箱中,用含10% (体积分数) 血清和1% (体积分数) 双抗的MEM培养基培养。当细胞长到 80%~90% 时,加入 20 mmol·L—1的 D-氨基半乳糖 (D-GalN,上海源叶) 和 1 μg·mL—1的脂多糖(LPS,美国Sigma),或是不同质量浓度的小柴胡汤(0、100、200和 400 μg·mL—1) 孵育 24 h。实验分为5组:对照组 (肝细胞培养基中既不加小柴胡汤也不加D-GalN/LPS),模型组 (肝细胞培养基中只加入D-GalN/LPS孵育24 h),以及小柴胡汤前处理组(细胞培养基中先加入 100、200和 400 μg·mL—1小柴胡汤孵育24 h,再加入D-GalN/LPS孵育24 h,分别标为100-XD、200-XD、400-XD组)。实验结束后,收集细胞上清液和细胞沉淀,进行生化指标检测和总RNA提取。
1.3 样本检测
1.3.1 CCK-8法检测肝细胞的增殖
将细胞重悬后接种于96孔板,每孔加入100 μL培养基,细胞数量为5×104个,置于5% CO2、25 ℃的恒温培养箱培养48 h。用CCK-8试剂进行肝细胞增殖实验检测,按照试剂盒上的步骤进行。用酶标仪测定在450 nm处的吸光度 (A450),细胞增殖计算公式:细胞成活率 = 实验组A450/对照组A450×100%。
1.3.2 肝细胞形态
将 500 μL 细胞悬液 (约 2×104个细胞) 滴种在6孔板爬片上,约4 h细胞贴壁后,轻轻补加1.5 mL培养基,置于25 ℃、5% CO2培养箱中培养过夜,让细胞贴在爬片上良好生长。加小柴胡汤处理后进行固定,将细胞进行HE染色,用中性树脂封片,用倒置显微镜 (MshOt MS60) 观察细胞形态(200×),每组3个重复。
1.3.3 细胞炎症因子检测
加入不同浓度小柴胡汤和D-GalN/LPS处理后,收集细胞上清液。用南京建成的ELISA试剂盒进行INF-γ、COX-2和PGE2细胞因子的检测。检测方法按照试剂盒的步骤进行。
1.3.4 细胞内肝功能指标检测
将肝细胞与小柴胡汤 (100、200或 400 μg·mL—1)或D-GalN/LPS孵育24 h,收集细胞沉淀,进行低温超声波破碎仪处理,然后用4 ℃低温离心机12 000 r·min—1离心5 min。取上清液按试剂盒步骤检测细胞内AST、ALT和乳酸脱氢酶 (LDH) 活性。
1.3.5 流式细胞仪检测细胞凋亡
将肝细胞接种于培养瓶,然后加入不同质量浓度的小柴胡汤或D-GalN/LPS孵育24 h后。用VAPC/7AAD凋亡试剂盒 (MULTI SCIENCES,上海)检测肝细胞的凋亡率。细胞加入药物处理结束后,收集细胞沉淀,用预冷PBS离心洗 3次,弃上清。细胞在28 ℃下共染色15 min,置于冰上孵育15 min。细胞凋亡率采用流式细胞仪 (BD, FACSCalibur, NY, USA) 检测,数据通过CELLQUESTPRO软件 (BD) 进行分析。
1.3.6 总 RNA 的提取和基因的表达分析
肝细胞总RNA 提取采用TRIzol裂解法。RNA完整性采用1.5%变性琼脂糖凝胶电泳进行检测,RNA浓度和纯度采用核酸分析仪测定OD260/OD280的比值进行确定。合成cDNA后于—20 ℃保存备用。通过荧光定量PCR方法测定相对mRNA表达水平。内参引物及基因特异引物采用Primer 5.0软件设计,由上海杰瑞生物技术有限公司合成(表1)[19]。
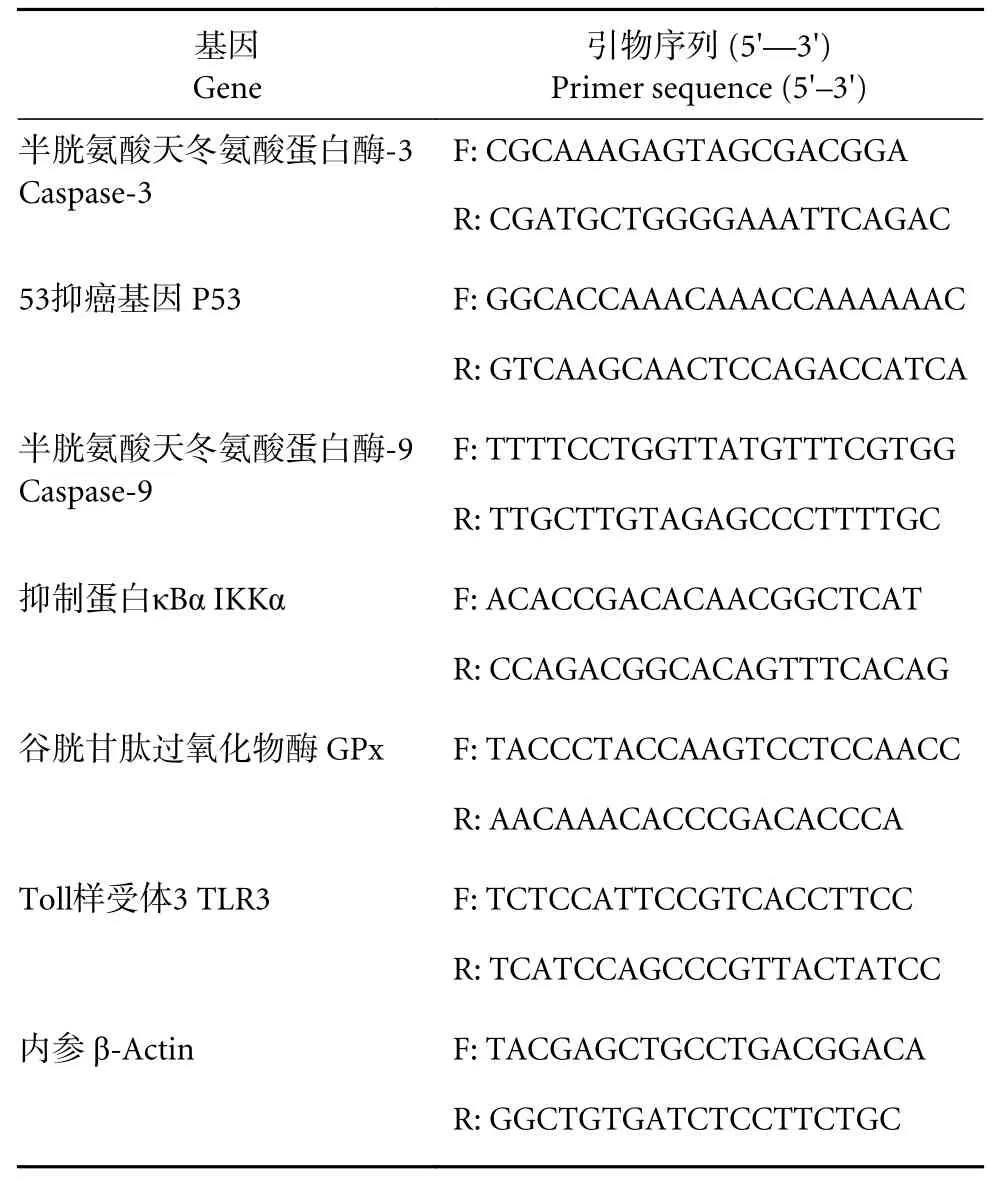
表1 本研究所用相关的引物序列Table 1 Primer sequence of related genes in this study
1.4 数据统计
2 结果
2.1 小柴胡汤对D-GalN/LPS诱导的肝细胞活力的影响
细胞增殖测定结果见图1。D-GalN/LPS损伤后,肝细胞成活率显著下降 (P<0.05),为(82.54±3.67)%;而小柴胡汤干预组的肝细胞成活率明显上升,100-XD、200-XD和400-XD前处理组肝细胞的成活率分别为 (91.35±2.02)%、(96.38±4.67)% 和(89.18±4.39)%,与模型组相比,肝细胞的成活率有不同程度的提高 (P<0.05)。
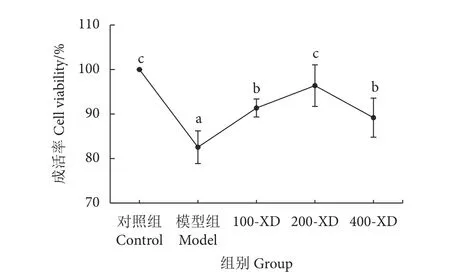
图1 小柴胡汤改善D-GalN/LPS诱导的虎龙杂交石斑鱼肝细胞损伤的成活率注:不同小写字母表示差异显著 (P<0.05);图 3、图 4、图 5-f、图 6 同此。Fig. 1 Hepatocyte viability of D-GalN/LPS-induced hepatocyte injury in hybrid grouper by Xiaochaihu DecoctionNote: Different small letters indicate significant difference (P<0.05); the same case in Fig. 3, Fig. 4, Fig. 5-f and Fig. 6.
2.2 小柴胡汤对肝细胞形态的保护作用
经小柴胡汤处理后,肝细胞HE染色结果见图2。对照组肝细胞形成致密的单层,细胞形态为长梭形,细胞核呈椭圆形,细胞排列整齐、界限清晰;模型组肝细胞有明显的损伤,细胞肿胀,边界模糊,排列不规则,部分细胞破裂;100-XD和200-XD组肝细胞生长态势好,细胞生长致密,排列规则,细胞核清晰可见;而400-XD前处理组肝细胞又呈现明显的损伤现象,细胞破裂,形态不规则,细胞间隙增大且疏松。
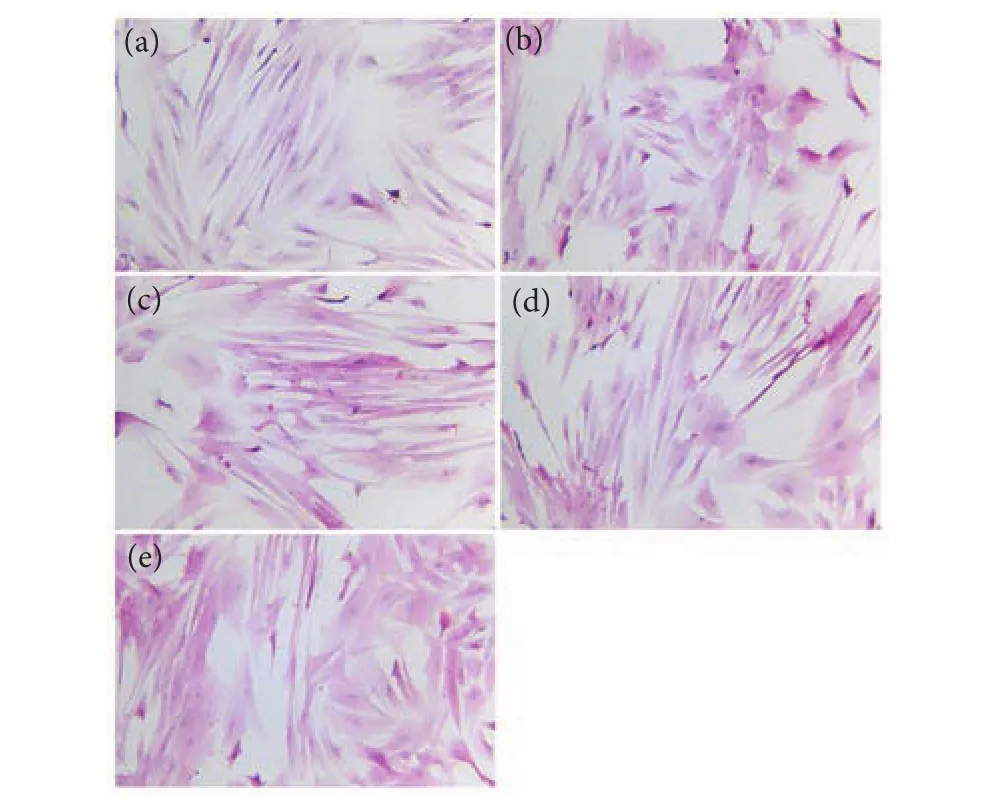
图2 小柴胡汤对D-GalN/LPS诱导的肝细胞形态的影响注:a. 对照组;b. 模型组;c. 100-XD;d. 200-XD;e. 400-XD;图5-a—5-e同此。Fig. 2 Effect of Xiaochaihu Decoction on morphology of D-GalN/LPS-treated hepatocytesNote: a. Control; b. Model; c. 100-XD; d. 200-XD; e. 400-XD; the same case in Fig. 5-a-5-e.
2.3 小柴胡汤对细胞上清液中INF-γ、COX-2和PGE2的影响
图3结果显示,D-GalN/LPS会导致肝细胞产生炎症。与对照组相比,模型组细胞培养上清液中干扰素-γ (INF-γ)、环氧合酶-2 (COX-2)和前列腺素E2 (PGE2) 质量浓度显著上升,分别为原来的1.7、1.6和1.5倍;与模型组相比,小柴胡汤前处理各浓度组对肝细胞均有保护作用,INF-γ、COX-2和PGE2质量浓度显著下降。
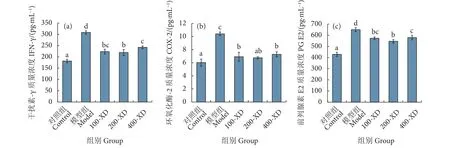
图3 小柴胡汤对D-GalN/LPS诱导的上清液中细胞因子的炎症反应Fig. 3 Effect of Xiaochaihu Decoction on D-GalN/LPS-induced inflammatory responses in hepatocytes
2.4 小柴胡汤对肝细胞中LDH、ALT和AST的影响
图4显示,与对照组相比,模型组细胞裂解后上清液中LDH、ALT和AST活性显著上升,分别为原来的2.0、1.9和1.8倍,表明建模成功。相对于D-GalN/LPS组,小柴胡汤前处理组明显抑制了LDH、ALT和AST活性升高,且呈剂量依赖性。
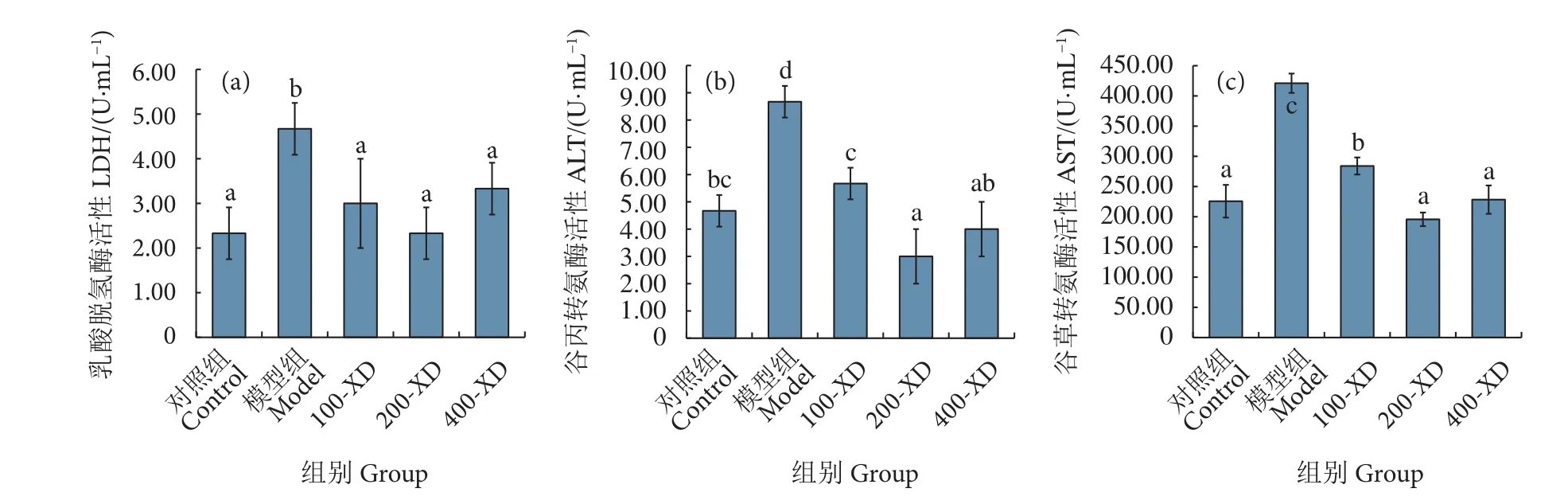
图4 小柴胡汤对D-GalN/LPS诱导的细胞内肝功能指标的影响Fig. 4 Effect of Xiaochaihu Decoction on D-GalN/LPS-induced liver function index in hepatocytes
2.5 小柴胡汤对肝细胞凋亡的影响
对细胞进行双染,然后用流式细胞仪检测原代肝细胞凋亡率 (图5)。结果显示,模型组中细胞凋亡率 (UR+LR:晚期凋亡及坏死细胞和早期凋亡细胞) 为 (24.10±0.96)%,显著高于对照组 [(4.37±0.35)%,P<0.05)]。然而,与模型组相比,100-XD、200-XD和400-XD前处理组的细胞凋亡率显著下降 (P<0.05),分别为 (16.60±0.23)%、(10.65±0.17)%和 (17.85±1.20)%。
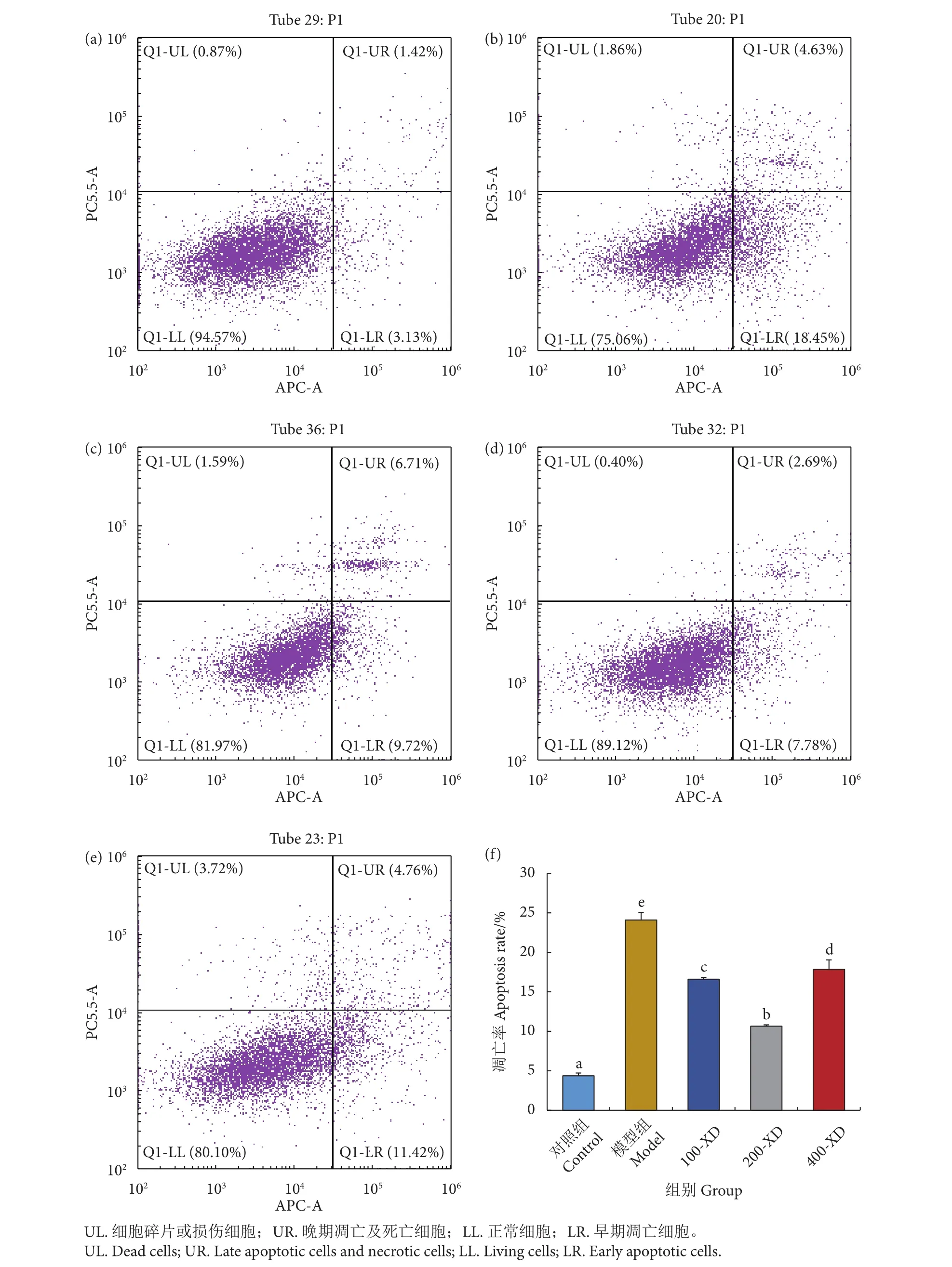
图5 小柴胡汤降低D-GalN/LPS诱导的细胞凋亡注:f. 细胞凋亡率 (UR+LR):将肝细胞进行 Annexin V-APC/7AAD 双染后,用流式细胞仪检测细胞凋亡率。Fig. 5 D-GalN/LPS-induced apoptosis reduced by Xiaochaihu DecoctionNote: f. Apoptotic cell ratio (Percentage of cells in quadrants UR and LR): The cells were double stained with Annexin V-APC/7AAD, and the apoptosis rate was determined using fow cytometry.
2.6 免疫和凋亡相关基因表达
小柴胡汤对虎龙杂交石斑鱼原代培养肝细胞免疫和凋亡相关基因表达的影响见图6。D-GalN/LPS处理使得模型组肝细胞抑制蛋白κBα (IKKα) mRNA的表达量显著升高,为对照组的2.6倍 (P<0.05);较低浓度小柴胡汤处理对IKKα的表达均有抑制作用,根据图6,与对照组相比,小柴胡汤浓度升高刺激了IKKα mRNA表达量上升;与模型组相比,100-XD和200-XD组IKKα的表达量显著降低(P<0.05),而400-XD组则无显著差异 (P>0.05)。小柴胡添加组中的Toll 样受体 3 (TLR3) mRNA表达量与模型组差异显著 (P<0.05)。谷胱甘肽过氧化物酶 (GPx) 在所有组中均无显著差异 (P>0.05)。与对照组相比,D-GalN/LPS处理使得模型组caspase-3、caspase-9和P53 mRNA的表达量显著上升,分别为原来的4.1、3.3和3.9倍 (P<0.05);不同浓度的小柴胡汤对caspase-3、caspase-9和P53的表达量有不同的作用,随小柴胡汤浓度的升高而上升,尽管100-XD和200-XD组间无显著差异,但与模型组相比,100-XD和200-XD组的表达量显著降低,而400-XD组则显著升高 (P<0.05)。
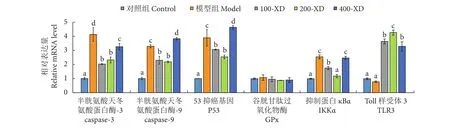
图6 小柴胡汤对D-GalN/LPS诱导的肝细胞免疫和凋亡相关基因的影响Fig. 6 Effect of Xiaochaihu Decoction on D-GalN/LPS-induced hepatocytes mRNA expression of immune and apoptosis genes
3 讨论
越来越多的证据表明,包括呋喃唑酮、氯霉素和链霉素等抗生素、孔雀石绿和磺胺类药物等化学药物,是导致水产动物肝脏疾病发生的一个重要因素[20-22]。鱼类的肝脏疾病已成为一个研究热点。近年来,小柴胡汤在临床上的应用越来越广泛,并被应用于多个新领域且取得一定进展[23-24]。然而,有关小柴胡汤对水产动物抗肝损伤方面的研究报道却很少。本文通过细胞实验探讨了小柴胡汤对虎龙杂交石斑鱼由D-GalN/LPS诱导的肝细胞损伤的保护作用,结果表明,通过小柴胡汤对石斑鱼肝细胞的预处理,可减轻D-GalN/LPS诱导的肝毒性,在生化和病理特征上也有显著改善。
小柴胡汤被成功用于治疗各种因素诱导的肝脏疾病。但其包括肝毒性等副作用,是限制其治疗肝损伤功效的主要因素。因此,采取安全有效的治疗措施减轻化学药物诱导的肝损伤非常有益。前期研究表明,适量的小柴胡汤对肝细胞没有毒性[18],但长期过量服用小柴胡汤或其他中草药制剂会增加肝损伤的风险[25]。研究表明,中草药未超剂量使用无毒副作用,但长期大剂量服用,则会对肝脏、肾脏和血液系统产生毒性[26-27]。因此应慎重选择剂量范围。本研究使用虎龙杂交石斑鱼原代肝细胞证明了小柴胡汤对D-GalN/LPS诱导的肝细胞毒性的保护作用。CCK-8 实验结果显示,随着小柴胡汤浓度的增加,经D-GalN/LPS 诱导损伤的肝细胞成活率升高,但继续提高小柴胡汤的浓度会对肝细胞产生毒性,导致细胞成活率显著下降,说明适量的小柴胡汤才对肝细胞具有保护作用。通过肝细胞形态分析,发现D-GalN/LPS诱导后,肝细胞出现明显的病理变化,包括细胞结构损伤、大量的空泡和细胞核消失等,而经小柴胡汤前处理,细胞损伤有明显改善。
D-GalN/LPS诱导的肝炎是人类和其他哺乳动物肝脏损伤的公认模型[28]。该模型已广泛应用于肝损伤病理生理的分子机制研究,评价保肝护肝药物的生物学活性[29]。D-GalN是一种肝脏特异性毒素,可选择性地消耗尿苷核苷酸,然后抑制肝细胞中的 mRNA 和蛋白质合成,使LPS的毒性作用增强,并在几小时内导致爆发性肝衰竭[11]。INF-γ可活化免疫细胞,具有抗病毒、抗肿瘤以及提高免疫功能等特性。COX-2的高表达也与炎性疾病的病理生理学有关[30]。在内毒素、脂多糖、炎性细胞因子等刺激下,会诱导炎症发生、细胞凋亡,导致免疫抑制、肿瘤发生等。PGE2是人体中最丰富的前列腺素亚型,属于前列腺素家族成员。当细胞膜受到刺激时,在环氧合酶 (COX) 及前列腺素H2合酶的联合作用下生成 PGE2,从而促进炎症发生。本研究中,对肝细胞培养上清液分析显示,小柴胡汤降低了D-GalN/LPS诱导的INF-γ、COX-2 和PGE2浓度,表明小柴胡汤显著抑制了D-GalN/LPS诱导的虎龙杂交石斑鱼肝细胞的炎症反应。同时D-GalN/LPS 会诱导细胞质膜渗透性变化,使肝酶从细胞中渗漏出来。本研究发现,经收集细胞沉淀后,D-GalN/LPS诱导导致肝细胞中LDH、ALT 和AST活性升高,表明肝细胞有损伤。经小柴胡汤前处理,则抑制了D-GalN/LPS 诱导的AST和ALT活性升高,恢复了肝细胞的功能。
综上所述,小柴胡汤对D-GalN/LPS 诱导的化学性肝细胞损伤有保护作用,可能与其促进抗氧化系统、抑制细胞外诱发的细胞凋亡有关。这些结果有助于更好地了解化学性肝损伤的调控机制,为鱼类保肝药物研究提供了新思路。
