鸡传染性法氏囊病病毒(IBDV)抗体间接ELISA检测方法的建立
2022-10-25黄小洁吴华伟杨承槐孔冬妮侯力丹
黄小洁,吴华伟,张 兵,杨承槐,孔冬妮,侯力丹,杨 飞,薛 麒*,刘 丹*
(1.中国兽医药品监察所,北京100081;2.中牧实业股份有限公司,农业部兽用生物制品与化药重点实验室,北京市兽用多肽疫苗设计与制备工程技术中心,北京100095)
鸡传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的鸡和火鸡的急性、高度接触性传染病[1],IBDV属双RNA病毒科双RNA病毒属。该病与禽网状内皮组织增生症、禽白血病、鸡传染性贫血病并称为危害鸡免疫系统的四大病毒性疾病[2]。该病主要感染3周龄以内的鸡,鸡群被感染后会造成中枢免疫器官法氏囊的损伤,从而引起免疫抑制,进而引起疫苗免疫失败或继发其他病毒性、细菌性疾病,严重的可以导致鸡群大量死亡,给养禽业带来巨大的经济损失[3]。自从IBDV发现至今,鸡传染性法氏囊病目前几乎遍及世界上所有养鸡国家和地区,已成为危害养鸡业的重要疾病之一。
目前防控IBDV最有效的方法就是疫苗免疫,但由于IBDV基因组易发生基因突变,不同毒株交叉感染还易发生基因组重配,造成疫苗免疫失败[4]。因此,在使用IBDV疫苗免疫后,对鸡群免疫后的保护性抗体水平进行评价,也是当前IBD防控工作中的重要课题。IBDV抗体的检测方法主要有中和试验、琼脂扩散试验(AGP)、间接免疫荧光试验(IFA)及酶联免疫吸附试验(ELISA)[5]。中和试验是评价鸡群抗体的金标准,但操作繁琐,耗时长,且需要用细胞培养,普通养殖场很难开展操作。琼脂扩散试验操作简单,但耗时较长,不符合快速检测的要求。IFA操作繁琐,需要用细胞培养,且观察需要用的荧光显微镜,既不方便也价格昂贵。而ELISA检测方法具有特异性好、操作简便、快速的优点,逐渐成为近年来研究的热点。
本研究选用大肠杆菌表达系统表达IBDV的VP2蛋白作为包被抗原[6],建立了检测IBDV抗体的间接ELISA方法,为IBDV流行病学调查和隐性感染监测提供有效的监测手段,为试剂盒的研制提供参考数据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 IBDV标准阳性血清及阴性血清、鸡减蛋综合征病毒(EDSV)阳性血清、鸡新城疫病毒(NDV)阳性血清、鸡传染性支气管炎病毒(IBV)阳性血清、鸡传染性喉气管炎病毒(ILTV)阳性血清、禽网状内皮组织增生症病毒(REV)阳性血清和马立克氏病火鸡疱疹病毒(HVT)阳性血清、鸡大肠杆菌阳性血清购自中国兽医药品监察所;禽流感病毒(AIV,H5、H9)阳性血清购自哈尔滨兽医研究所;375份临床血清采自SPF鸡;HRP标记的Donkey anti-chicken IgY购自康为世纪生物科技有限公司;TMB由Sigma公司提供;酶标板为Corning公司产品;IBD ELISA抗体检测试剂盒为IDEXX公司产品。
1.1.2 IBDV VP2蛋白的制备 参照文献[6],利用大肠杆菌表达系统进行VP2蛋白表达,纯化后的蛋白浓度为800 μg/mL,将纯化后的蛋白定量后作为ELISA包被用抗原。
1.2 方法
1.2.1 抗原包被浓度和待检血清稀释度的确定 用PBS将纯化后蛋白进行倍比稀释,取8、4、2、1、0.5 μg/mL 5个浓度,100 μL/孔包被酶标板,37 ℃ 1 h后 4 ℃过夜。洗涤后加入10%脱脂乳,每孔200 μL,37 ℃封闭1 h。洗涤拍干后分别加入1∶100、1∶200、1∶400、1∶800稀释的 IBD 阳性血清和阴性血清进行ELISA方阵试验,100 μL/孔,37 ℃ 1 h,洗涤后加入1∶1800稀释的酶标抗体,100 μL/孔,37 ℃ 1 h;洗涤后加入TMB 底物溶液,100 μL/孔,37 ℃ 10 min,50 μL 2 mol/L H2SO4终止反应。在酶标仪上测定OD450nm值,每个稀释度做2个重复,取其平均值。以阳性血清的OD450nm值接近1.0、P/N值最大的所在孔的抗原浓度和血清稀释倍数作为最佳抗原工作浓度和血清稀释度。
1.2.2 酶标抗体稀释度的确定 固定抗原包被浓度和待检血清稀释度,将HRP标记的驴抗鸡酶标抗体稀释为1∶10000、1∶12000、1∶15000、1∶18000、1∶20000,按照ELISA程序进行检测,筛选酶标抗体的最佳稀释度。
1.2.3 封闭液的确定 以1% BSA、10%脱脂乳、10%马血清、3%明胶,1% OVA封闭包被板,用IBDV标准阴性、阳性血清进行检测,以确定最佳包被液。
1.2.4 最佳包被条件的确定 分别选择4 ℃过夜、37 ℃ 1 h+4 ℃过夜、37 ℃ 2 h三个反应条件进行检测,以确定最佳包被条件。
1.2.5 抗原稀释液的确定 分别用0.01 mol/L碳酸盐缓冲液(pH9.6)和0.01 mol/L PBS(pH7.2)稀释VP2蛋白进行检测,确定抗原稀释液。
1.2.6 ELISA反应时间的优化
1.2.6.1 待检血清反应时间的确定 加入最佳稀释度的IBDV标准阳性血清和阴性血清,按作用时间分别为37 ℃ 30 min、37 ℃ 60 min、37 ℃ 90 min及37 ℃ 120 min进行ELISA检测,确定血清最佳反应时间。
1.2.6.2 酶标抗体作用时间的确定 加入酶标抗体后,分别按37 ℃ 30 min、37 ℃ 60 min、37 ℃ 90 min及37 ℃ 120 min进行ELISA检测,确定酶标抗体最佳反应时间。
1.2.6.3 底物反应时间的确定 加入底物后,按室温10、15、20 min进行反应,以P/N值最高确定最终反应时间。
1.2.7 阴阳性临界值的确定 按照已建立的IBDV抗体间接ELISA方法进行检测。通过对375份阴性鸡血清样品进行检测,根据检测结果计算阴性血清的OD450nm平均值和标准差,将平均值+3×标准差作为判断阴阳性血清临界值的标准。
1.2.8 特异性试验 用已建立的IBDV抗体间接ELISA检测方法对抗EDSV、NDV、IBV、ILTV、REV、ALV(H5)、ALV(H9)和HVT等8种禽常见传染病病毒阳性血清和鸡大肠杆菌阳性血清进行测定,评价该IBDV抗体间接ELISA检测方法的特异性。
1.2.9 敏感性试验 取4份IBDV阳性血清,分别进行1∶400、1∶800、1∶1600、1∶3200稀释后进行检测,同时与IDEXX公司生产的IBDV抗体检测试剂盒进行比较,以评价IBDV抗体间接ELISA检测方法的敏感性。
1.2.10 重复性试验
1.2.10.1 批内重复性试验 取同一批次三块ELISA板,对4份阳性血清、4份阴性血清进行ELISA测定,每个平行做3孔,进行批内重复性试验,检测结果进行统计学分析、计算变异系数。
1.2.10.2 批间重复性试验 不同时间制备的三批抗原包被的ELISA板,对4份阳性血清、4份阴性血清进行ELISA测定,每个平行做3孔,进行批间重复性试验,检测结果进行统计学分析、计算变异系数。
1.2.11 与IDEXX公司的IBDV抗体检测试剂盒进行符合率比较 用已建立的IBDV抗体间接ELISA检测方法检测不同抗体效价的血清184份,同时将这些血清按照IDEXX公司的IBDV抗体检测试剂盒说明进行测定。根据结果确定两者之间的符合率。
2 结果与分析
2.1 抗原包被浓度和待检血清稀释度的确定 ELISA方阵试验结果表明,在抗原的包被浓度为8 μg/mL,每孔100 μL,待检血清稀释度为1∶400时,阳性血清OD450nm在1.0左右,且P/N值最大(表1)。
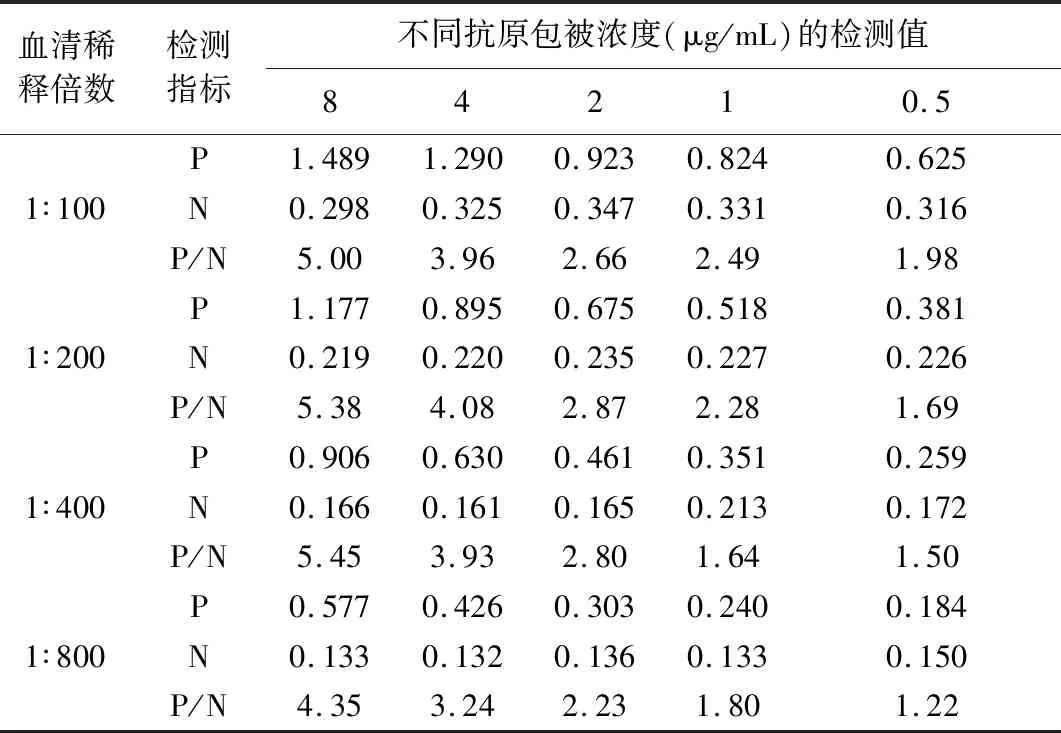
表1 抗原包被浓度和待检血清稀释度的确定Tab 1 Determination of antigen concentration and serum dilution
2.2 酶标抗体稀释度的确定 在最适抗原包被浓度和待检血清最佳稀释度条件下,将HRP标记的驴抗鸡酶标抗体稀释为1∶10000、1∶12000、1∶15000、1∶18000、1∶20000,按照ELISA程序检测,结果表明酶标抗体的最佳稀释度为1∶15000(表2)。

表2 不同酶标抗体稀释度的ELISA结果Tab 2 ELISA results of dilution of different enzyme-labeled antibodies
2.3 封闭液的确定 分别以1%BSA、10%脱脂乳、10%马血清、3%明胶、1% OVA封闭包被板,用IBDV标准阴性、阳性血清进行检测,结果显示10%马血清的封闭效果最好(表3)。

表3 不同封闭液条件的ELISA结果Tab 3 ELISA results of different sealing fluid
2.4 最佳包被条件的确定 分别选择4 ℃过夜、37 ℃ 1 h+4 ℃过夜、37 ℃ 2 h三个反应条件进行检测,结果显示4 ℃过夜、37 ℃ 1 h+4 ℃过夜效果较好,确定最佳包被条件为4 ℃过夜(表4)。

表4 不同包被条件的ELISA结果Tab 4 ELISA results of different coating conditions
2.5 抗原稀释液的确定 分别用0.01 mol/L碳酸盐缓冲液(pH9.6)和0.01 mol/L PBS(pH7.2)稀释VP2蛋白进行检测,两者差异不大,选择常用的0.01 mol/L PBS(pH7.2)作为抗原稀释液(表5)。

表5 不同抗原稀释液的ELISA结果Tab 5 ELISA results of different Antigen Diluents
2.6 待检血清反应时间的确定 加入最佳稀释度的IBDV标准阳性血清和阴性血清,按作用条件分别为37 ℃ 30 min、37 ℃ 60 min、37 ℃ 90 min及37 ℃ 120 min进行ELISA检测,确定血清最佳反应时间为90 min(表6)。

表6 不同血清反应时间的ELISA结果Tab 6 ELISA results of different serum reaction time
2.7 酶标抗体作用时间的确定 加入酶标抗体后,分别按37 ℃ 30 min、37 ℃ 60 min、37 ℃ 90 min及37 ℃ 120 min进行ELISA检测,确定酶标抗体最佳反应时间为37 ℃ 60 min(表7)。

表7 不同酶标抗体作用时间的ELISA结果Tab 7 ELISA results of different enzyme labeled antibody reaction time
2.8 底物反应时间的确定 加入底物后,按室温10、15、20 min进行反应,确定最终反应时间为15 min(表8)。

表8 不同底物作用时间的ELISA结果Tab 8 ELISA results of different substrates reaction time
2.9 阴阳性临界值的确定 按照已建立的IBDV抗体间接ELISA方法进行检测。通过对370份阴性鸡血清样品进行检测,计算得到阴性血清的OD450 nm平均值为0.144,标准差为0.048,临界值=平均值+3×标准差=0.144+3×0.044=0.288(表9)。
2.10 特异性试验 用已建立的IBDV抗体间接ELISA检测方法对抗EDSV、NDV、IBV、ILTV、REV、ALV(H5)、ALV(H9)和HVT等8种禽常见传染病病毒阳性血清和鸡大肠杆菌阳性血清进行测定,检测结果均为阴性,证明无血清交叉反应,建立的IBDV抗体间接ELISA检测方法具有很好的特异性(表10)。
2.11 敏感性试验 表11结果表明,本试验建立的ELISA方法检测1∶400至1∶1600倍稀释的血清均为阳性,IDEXX公司生产的IBDV抗体检测试剂盒检测的最高限1∶1600为阳性,说明两者的敏感性相当(表11)。

表11 ELISA方法敏感性试验结果Tab 11 The results of the sensitivity of ELISA method
2.12 重复性试验
2.12.1 批内重复性试验 结果见表12,变异系数为3.3%~7.3%,小于10%,表明有很好的批内重复性。
2.12.2 批间重复性试验 结果见表12,变异系数为1.9%~6.0%,小于10%,表明有很好的批间重复性。

表12 ELISA方法批内重复试验和批间重复试验结果Tab 12 The results of the repeated batch test and iner batch test
2.12.3 与IDEXX公司IBDV抗体检测试剂盒进行符合率比较 结果见表13。建立的IBDV抗体间接ELISA检测方法,检测结果为阳性12份,阴性172份;IDEXX公司IBDV-ELISA抗体试剂盒的检测结果为阳性14份阳性,阴性170份,符合率为95.7%。
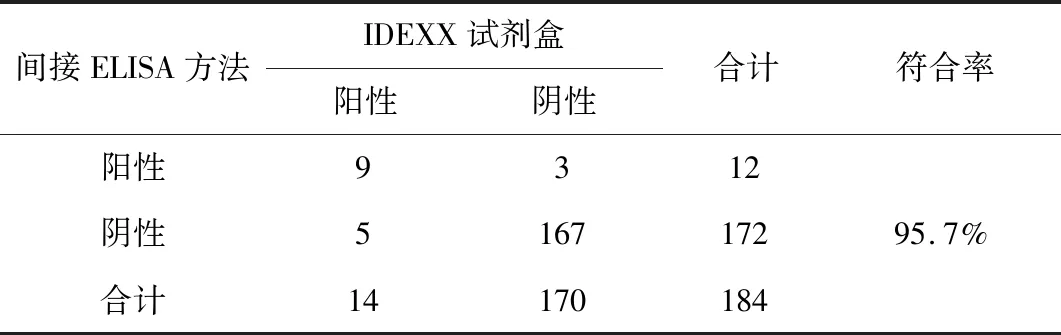
表13 建立的间接ELISA方法与IDEXX-ELISA试剂盒检测结果比较Tab 13 Comparision the results of the indirect ELISA method with the IDEXX-ELISA kit
3 讨 论
目前,商品化的IBD抗体间接ELISA试剂盒采用的是全病毒包被酶标板,病毒的制备过程繁琐,成本高,不利于推广应用,而且全病毒包被,有较强的背景反应和非特异性反应,易造成实验结果不准确。在IBDV的5个病毒蛋白中,VP2和VP3蛋白均可以用来研制IBDV的抗体检测试剂盒,VP2是病毒的衣壳蛋白,也是病毒的主要保护性抗原,有研究表明用VP2蛋白来研制IBDV抗体检测试剂盒比VP3具有更好的优势[7-8]。虽然,IBD重组VP2蛋白可由多种表达系统进行表达[9-12],但若要研制IBDV抗体检测试剂盒,大肠杆菌表达系统是首选,表达量高,生产和纯化方便。为此,试验选用重组VP2蛋白作为包被抗原,并通过原核表达系统来制备,操作简便,经济,特异性高。
在对临床样品的检测中,本方法跟IDEXX公司的试剂盒相比符合率很高,IDEXX试剂盒多检出的两份阳性样品,用经典的琼脂扩散试验方法(参照《中国兽药典》2020年版三部)进行复核,结果为阴性,与本方法检测结果一致,说明本方法检测准确率高。酶标液的选择是影响ELISA试验特异性的主要因素[13]。研究使用10%的马血清做为封闭液封闭酶标板,大大降低了非特异性因素影响。包被抗原的浓度和阴阳性血清稀释度是否适宜也影响ELISA试验特异性和敏感性,试验中阳性血清稀释到1∶1600仍然能检测出来,说明方法的敏感性非常好。抗原的包被浓度如果太高,蛋白分子间相互作用会造成分子的多层化,洗的时候这些蛋白容易被洗掉,造成试验的非特异性;浓度太低,载体表面吸附的抗原量太少,容易出现假阴性的情况,造成结果的不准确。试验将包被抗原稀释为8 μg/mL,每孔加入100 μL,试验的特异性最高。血清的稀释度也直接影响试验的特异性和灵敏度。试验显示,随着血清稀释度的增加,阳性样品OD值有下降趋势。而阴性样品的OD值变化不大。可能是因为血清中蛋白成分复杂,有可能在ELISA反应体系会出现非特异性反应,因此对血清做适宜的稀释可降低这种非特异性反应。该方法与其他血清不出现交叉反应,说明方法的特异性好。
本研究优化了间接ELISA方法的反应体系和反应条件,证明方法的敏感性高、特异性和重复性好,与国外同类型的商品化试剂盒的复合率高,初步建立了检测IBDV抗体的间接ELISA方法,为商品化试剂盒的研制奠定了基础。
