无血清分离培养兔脂肪间充质干细胞及其生物学特性
2022-10-24蔺春恒赵文亮李珊珊白士斌张俊鹏郑树贵张树义
蔺春恒,赵文亮,李珊珊,白士斌,张俊鹏,段 爽,郑树贵,张树义
(沈阳农业大学 动物科学与医学学院,辽宁 沈阳 110161)
间充质干细胞(mesenchymal stem cells,MSCs)是一种具有多向分化能力的成体干细胞,能够分化为多种细胞类型,包括成骨细胞、软骨细胞、神经细胞和脂肪细胞等[1-3]。MSCs存在于多种组织中,如脂肪组织、脐带、胎盘、骨骼肌、皮肤和骨髓等[4]。此外,MSCs还能产生具有参与免疫调节与再生能力的生长因子和细胞因子等。目前,在兽医领域中已有许多研究表明可以从犬、猫、猪、马和牛等动物中分离出不同类型的MSCs[4-9]。虽然MSCs可以从多种组织中分离出来,但由于其应用广泛,需求量大,仍需要对其进行体外的扩增培养,以获得足够的数量。MSCs的体外培养有多种分离方法和培养条件,不同的分离方法或培养条件(如培养试剂、培养容器和培养环境等)对MSCs的异质性均有重要影响[10]。
胎牛血清(fetal bovine serum,FBS)是MSCs扩增的标准培养液成分[11]。FBS为人和动物MSCs的体外培养提供生长因子和许多其他营养物质。但是,FBS也可能是外来病原体的来源,并且含有可能引起受体免疫反应的血清蛋白[12]。为了克服在MSCs培养中加入FBS的一些缺陷,包括安全性、有效性、一致性和可重复性,使得使用无血清培养基培养MSCs的命题很有吸引力[13]。
目前,已有关于无血清培养基能够有效支持人、犬和马的MSCs分离培养的报道[14-15],但尚未见使用无血清培养兔MSCs相关研究的报道。兔作为兽医领域中常用的一种动物模型,体型适中,脂肪数量充足[16]。因此,本试验拟以兔为试验对象,建立无血清分离培养兔脂肪间充质干细胞(adipose-derived mesenchymal stem cells,AD-MSCs)的完整体系。并采用PCR技术对兔AD-MSCs进行基因表达鉴定,观察兔AD-MSCs在无血清培养基中的生长能力,以及成脂和成软骨的分化能力,为无血清培养的MSCs在细胞临床治疗中的应用提供理论依据。
1 材料与方法
1.1 试验动物新西兰白兔系的健康雌性兔,取自沈阳农业大学动物科学与医学学院。动物处理符合机构实验室动物使用指南。
1.2 主要试剂MSCs无血清基础培养基、MSCs无血清培养基添加剂、干细胞温和消化酶和脂肪组织消化酶均购自友康生物公司;干细胞成脂诱导分化完全培养基试剂盒和干细胞成软骨诱导分化完全培养基试剂盒购自Cyagen公司;RNA提取试剂盒购自QIAGEN公司;反转录试剂盒购自TaKaRa公司。
1.3 主要仪器SW-CJ-1F型超净工作台购自苏净安泰公司;371型CO2培养箱购自Thermo Fisher公司;DKZ-2B型恒温震荡水槽购自上海一恒科学仪器有限公司;AE2000型倒置显微镜购自Motic公司;ProFle型PCR仪购自Thermo Fisher公司;多功能微孔板酶标仪购自Tecan公司。
1.4 原代AD-MSCs的分离培养使用丙泊酚麻醉新西兰兔,在兔腹股沟处剥离脂肪组织,去除脂肪组织的血管和筋膜,反复清洗。将脂肪组织剪碎成糊样状,1 300 r/min离心5 min。加入与组织等体积的脂肪组织消化酶,37℃震荡消化40~60 min。加入与脂肪组织消化酶等体积的无血清完全培养基(无血清基础培养基+1%无血清培养基添加剂+1%双抗)终止消化,使用80目的细胞筛网过滤,将过滤液 1 300 r/min离心5 min,去除上清液。将细胞沉淀用无血清完全培养基重悬,调整细胞浓度,接种于T25培养瓶中,置于37℃、5%CO2饱和湿度的培养箱中。培养48 h后进行第1次换液,以后每隔3 d进行1次换液,直至细胞汇合度达到80%~90%后进行传代培养。
1.5 AD-MSCs的传代当原代细胞汇合度达到80%~90%时,弃掉原培养基,使用PBS缓冲液清洗细胞,加入1 mL的干细胞温和消化酶进行消化,消化时间为2~5 min。添加2 mL的无血清完全培养基终止消化, 1 300 r/min离心5 min,弃掉上清液。按5 000/cm2接种于T25瓶中继续传代培养。
1.6 AD-MSCs的生长曲线及群体倍增时间制作分别选取P2代和P5代细胞,调整细胞浓度,以2×104/cm2接种于24孔板,置于37℃、5%CO2饱和湿度的培养箱中。每天随机选取3个孔进行细胞计数,每3 d换1次液,培养8 d。以培养天数为横坐标,细胞数量为纵坐标,绘制生长曲线。细胞群体倍增时间的计算公式为:PDT=t×[lg2/(lgNt- lgN0)]。其中,t为细胞培养的时间(单位:h),Nt是培养t时间后细胞的数量,N0是初始接种的细胞数量。
1.7 PCR检测MSCs表面标志物基因的表达提取兔AD-MSCs总RNA,使用酶标仪检测RNA浓度。将RNA反转录成cDNA,并按照表1的引物序列,以cDNA为模板,95℃预变性2 min;95℃变性25 s,60℃退火30s,72℃延伸30 s,进行35个循环;72℃延伸5 min;将PCR扩增产物加到1.5%的琼脂糖凝胶中电泳检测CD44、CD45、CD105、CD90和CD73的表面标志物基因。

表1 MSCs表面标记基因引物序列
1.8 AD-MSCs的成脂诱导分化取P2代兔AD-MSCs,调整细胞浓度为5×104个/mL并接种到六孔板中,将细胞培养至汇合度100%。吸走上清液,加入成脂诱导分化培养基。继续培养21 d后,用甲醛溶液将细胞固定,油红O染料进行染色,在倒置显微镜下观察成脂染色效果。
1.9 AD-MSCs的成软骨诱导分化取P2代兔AD-MSCs,将1×106个细胞转移到15 mL离心管中,1 500 r/min离心5 min,去上清,加入0.5 mL成软骨诱导分化完全培养基的预混液重悬;重复上一步骤;将沉淀用0.5 mL成软骨诱导分化完全培养基重悬,1 500 r/min离心5 min,置于37℃、5%CO2饱和湿度培养箱中。每隔2 d换液,培养21 d后,对软骨球进行福尔马林固定和石蜡包埋切片,阿利辛蓝染色,在显微镜下观察成软骨染色效果。
2 结果
2.1 兔AD-MSCs的形态观察原代培养的细胞在显微镜下观察可见到各种不规则形状。此时的培养基内有杂质存在,随着更换培养基或传代可以逐渐去除。细胞培养到P3代在显微镜下可以观察到细胞呈长梭形或多边形等,以纺锤形均匀的分布,聚集性生长(图1)。
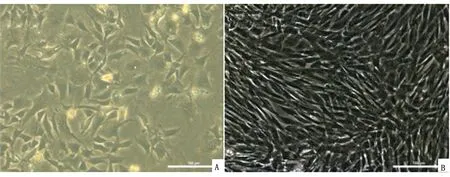
A.原代培养96 h(200×);B.P3代(×200)
2.2 生长曲线及群体倍增时间测定由图2可知,P3代的MSCs在第1 天时增殖不明显,第2~5 天进入对数生长期,第5 天以后进入平台期;P6代的MSCs在第3~5 天进入对数生长期。由图3可知,根据P3、P6代的细胞生长曲线可得到兔AD-MSCs的群体倍增时间,分别为(18.38±0.23) h和(21.76±1.28) h。

图2 兔AD-MSCs生长曲线
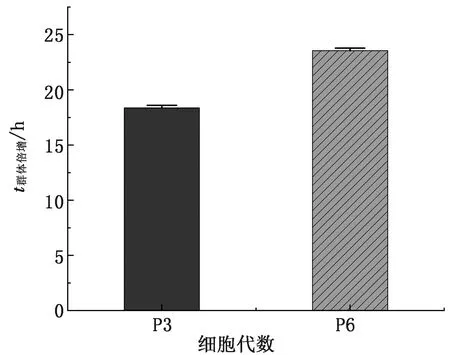
图3 群体倍增时间
2.3 PCR检测MSCs表面标志物基因如图4所示,兔AD-MSCs表达CD73、CD90和CD105基因,不表达其他造血细胞系的表面标记(如CD34与CD45),结果符合MSCs的国际鉴定标准。

图4 PCR验证细胞表面标记基因表达
2.4 兔AD-MSCs的成脂和成软骨分化MSCs经成脂分化诱导液21 d诱导后,大部分细胞形态逐渐变为扁平的圆形,细胞体积增大,出现许多的脂滴,诱导后的细胞经油红O染色后,在显微镜下观察,可见AD-MSCs胞质中的脂滴被染成红色(图5A)。MSCs经成软骨分化诱导液21 d的立体诱导培养后,对软骨球进行福尔马林固定和石蜡包埋切片,阿利辛蓝染色,在显微镜下观察可见,软骨组织中的内酸性粘多糖被染成蓝色(图5B)。
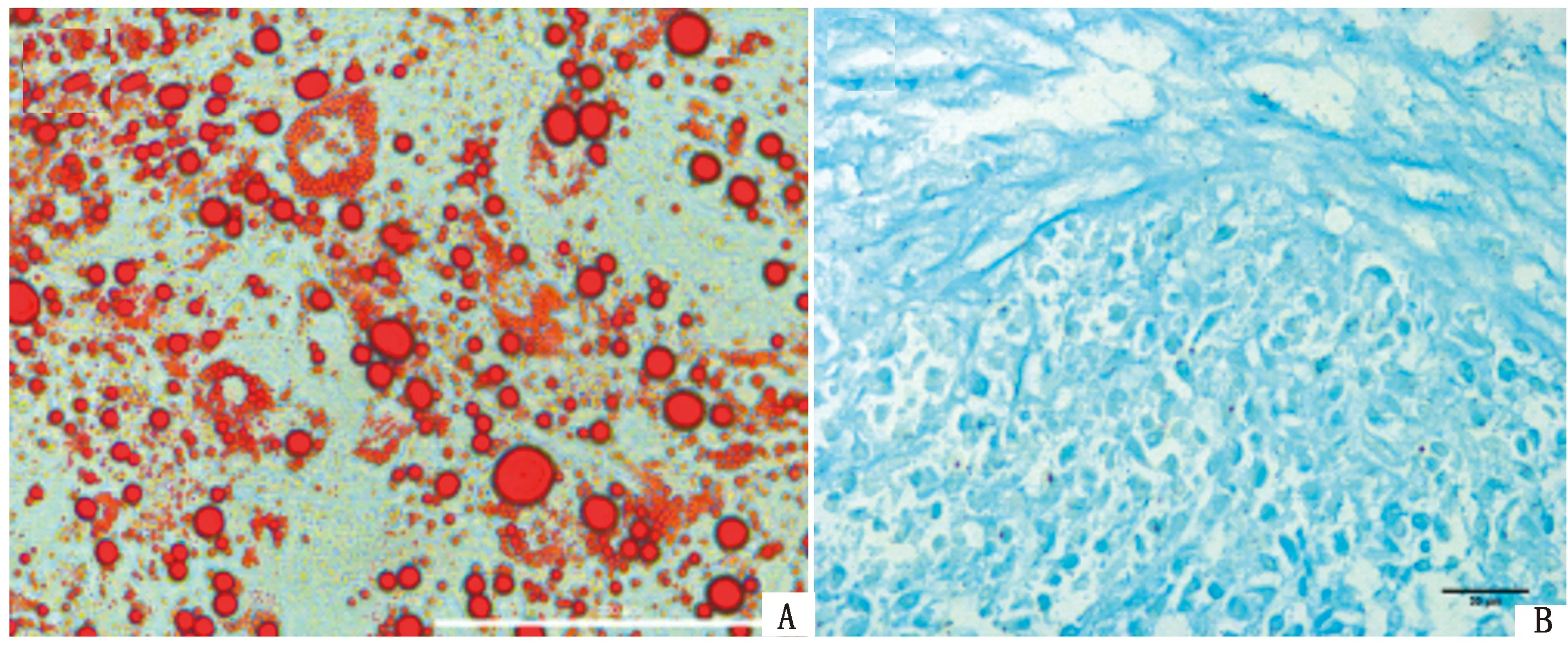
A.油红O染色(400×);B.阿利辛蓝染色(×400)
3 讨论
MSCs的显著特征是具有自我更新能力和分化为多种细胞类型的潜能[20]。MSCs可以通过产生和分泌多种细胞因子、趋化因子及生长因子等,对许多不同类型的细胞发挥旁分泌作用。因此,可以应用于临床治疗方面,特别是在自身免疫性疾病、宿主移植和器官移植等方面,是再生医学和免疫治疗领域的新方向[21-22]。虽然FBS作为MSCs体外扩增的一种培养液成分,为人和动物MSCs提供了许多营养物质,但是有可能会带来新的病原感染等问题[13]。因此,为了MSCs在临床上使用的安全可靠,可以通过在无异种蛋白的条件下培养细胞,来减少异种蛋白的免疫反应和传染性疾病的传播,使用无血清完全培养基来替代含血清完全培养基,将为动物MSCs的治疗应用提供新的方向。
ZHAN等[23]的研究表明,比较同一代不同来源的5种MSCs,MSCs均呈现长梭形等形状,聚集成漩涡状;MSCs的增殖能力均随着传代次数的增加而逐渐下降,其中AD-MSCs在体外具有较高的增殖活性。本试验采用无血清培养的方式培养兔AD-MSCs,细胞呈长梭形或多边形等不规则形状,聚集性生长,铺满底面后呈现出漩涡状;P3代的AD-MSCs具有较强的增值能力和较短的倍增时间,随着传代次数的增加,细胞增殖能力有所下降。
目前,国际上MSCs的表面标记物的鉴定标准为表达CD73、CD90和CD105等,不表达CD34、CD45、CD14和CD19等[24]。TIRPAKOVA等[25]结合流式细胞仪和PCR方法检测兔AD-MSCs的标记物在mRNA水平上的表达,结果显示兔AD-MSCs表达CD29、CD44、CD73、CD90和CD105,符合MSCs的国际鉴定标准。根据KOVAC等[17]的试验,对兔羊水来源的MSCs表面标志物的基因进行检测,为了比较表面标记基因的转录谱和表面标记蛋白的表达,采用RT-PCR方法对CD29、CD34、CD44、CD45、CD73、CD90、CD105和CD166进行了检测,根据RT-PCR的结果,观察到兔的羊水来源的MSCs标记物除了不表达造血细胞系的表面标记CD45和CD34外,其余标记物均有表达,满足MSCs的检测标准。本试验通过PCR技术检测兔AD-MSCs表面标记物,结果表明AD-MSCs表达CD105、CD90和CD73,但不表达CD34和CD45。结合上述的试验结果,本试验采用无血清分离培养的兔AD-MSCs符合MSCs的鉴定标准。
动物MSCs具有多向分化潜能,能够在体外诱导下分化为多种细胞类型,如软骨细胞和脂肪细胞等。VILLATORO等[26]在试验中用犬的脂肪组织与骨髓组织分离培养MSCs,并分别在体外进行成脂和成软骨诱导分化,结果表明成脂诱导分化后的细胞,可观察到大量的脂滴,脂滴可以被油红O染料染成红色;成软骨诱导分化后的细胞,经阿利辛蓝染色可以染成蓝色。在本试验中,对无血清分离培养的兔AD-MSCs分别进行成脂与成软骨诱导分化,结果表明成脂诱导21 d后,成脂诱导分化液诱导培养后的细胞,可以分化成扁平的圆形,出现大量的脂滴,脂滴可以被油红O染料染成红色,说明成功将AD-MSCs诱导分化为脂肪细胞;成软骨诱导21 d后,成软骨诱导分化液培养的细胞,诱导分化后细胞聚集成球状,对软骨球进行福尔马林固定和石蜡包埋切片后可以被阿利辛蓝染成蓝色,说明成功将无血清分离培养的兔AD-MSCs诱导分化为软骨细胞。结合成脂和成软骨诱导分化的试验结果证明,兔AD-MSCs具有向脂肪细胞和成软骨细胞分化的潜能。
本试验结果表明,无血清分离培养兔AD-MSCs的生物学特性,与含血清分离培养MSCs的生物学特性相同,并且避免了血清带来的安全隐患。无血清分离培养的兔AD-MSCs,具有较强的增殖能力以及成脂和成软骨的分化能力,AD-MSCs的表面标记物鉴定结果符合国际鉴定标准,能够为兽医临床治疗提供理想的细胞。
