基于非洲猪瘟病毒p30蛋白的间接ELISA抗体检测方法的建立
2022-10-24张文燕陈立功腾召剑林依丹逯继成孙泰然宋勤叶
张文燕,陈立功,腾召剑,林依丹,逯继成,孙泰然,张 芳,宋勤叶*
(1.河北农业大学 动物医学院 河北省兽医生物技术创新中心,河北 保定 071000;2.保定市动物疫病预防控制中心,河北 保定 071001)
非洲猪瘟病毒(Africa swine fever virus,ASFV)可引起不同年龄的猪高热、全身脏器广泛性出血、脾脏急性肿大,病死率高达100%。世界动物卫生组织(OIE)将非洲猪瘟(Africa swine fever,ASF)列为法定报告动物疫病之一,我国将其列为一类动物传染病。2018年8月,我国沈阳市确诊首例ASF,随后该病在全国各地迅速流行,给我国的养猪业造成了巨大的经济损失[1-6]。
ASFV属于非洲猪瘟病毒科(Asfarviridaefamily)非洲猪瘟病毒属(genusAsfivirus)的唯一成员,也是目前发现的唯一虫媒DNA病毒[7]。病毒粒子呈二十面体对称,直径170~190 nm,由多层结构构成,由内到外依次包括病毒基因组DNA、内核芯壳、内囊膜、衣壳和外囊膜5部分。病毒基因组庞大复杂,长170~193 kb,包含151~167个开放阅读框(ORFs),共编码150~200种蛋白[7]。ASFV虽只有1个血清型,但病毒基因易发生变异。目前,ASFV至少有24个基因型,不同基因型之间存在明显差异,其间交叉免疫保护性低[8-11]。此外,ASFV对外界环境抵抗力强,很难将其从污染的环境和圈舍内彻底清除,从而造成疫情反复发生。已知p30是ASFV最重要的结构蛋白之一,由CP204L基因编码。该蛋白表达于病毒感染的早期,在病毒入侵宿主细胞和诱导机体免疫应答过程中发挥作用[7,9-10]。研究表明,与基于ASFV结构蛋白p54的ELISA抗体检测方法相比,基于p30的ELISA敏感性更高[12]。因此,p30是抗体检测和血清学诊断方法研究的理想靶标,尤其适合于ASFV感染的早期检测。
本试验拟以重组p30为包被抗原,建立了检测ASFV抗体的间接ELISA方法,旨在为ASF的血清学诊断、感染猪筛查与有效防控提供技术支持。
1 材料与方法
1.1 载体与菌株原核表达质粒pET-28a(+)、大肠杆菌(E.coli)DH5α和Rosetta(DE3)感受态细胞,均由河北农业大学传染病实验室保存。
1.2 主要试剂、试剂盒和血清HRP-山羊抗兔IgG(H+L)和兔抗His标签多克隆抗体,购自北京康为世纪生物科技有限公司;HRP-羊抗猪IgG,购自北京索莱宝生物技术有限公司;ASFV多抗原(P32、P62和P72)间接ELISA试剂盒,ID.Vet公司产品;ASFV抗体阳性、阴性猪血清和血清样本,由保定市动物疫病预防控制中心保存;猪伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV2)、猪瘟病毒(CSFV)和猪繁殖与呼吸综合征病毒(PRRSV)抗血清,由河北农业大学传染病实验室保存。
1.3 基因序列合成与重组表达质粒ASFV中国分离株Pig/HLJ/2018(GenBank ID:MK333180)的p30基因序列及其重组质粒(T-p30),由生工生物工程(上海)股份有限公司合成与构建。
1.4 p30蛋白的制备与检测以重组质粒T-p30为模板,通过PCR扩增得到含有BamHⅠ-NotⅠ酶切位点的p30基因片段,然后将扩增的目的基因片段与原核表达载体pET28a(+)连接,构建了p30原核表达载体pET28a-ASFV-p30。将质粒pET28a-ASFV-p30转化到Rosetta(DE3)感受态细胞,挑选单菌落接种于含有Kan+/LB液体培养基中,37℃、200 r/min振摇培养过夜。随后按照1∶100比例接种新鲜Kan+/LB液体培养基中,待培养至对数期,即D630 nm值为0.6~0.8时加入终浓度为 0.5 mmol/L的IPTG,28℃、230 r/min继续诱导培养4 h。离心收集菌体沉淀,经SDS-PAGE检测目的蛋白表达情况。另取菌体沉淀,按照文献[13]所述方法纯化蛋白,并进行Western blot检测。
Western blot的主要试验步骤如下:将纯化的p30蛋白进行SDS-PAGE,同时设立阴性对照(转化空质粒pET28a的DE3诱导产物)。将蛋白转印到PVDF膜上,于4℃下封闭过夜;洗膜,加入兔抗His标签多克隆抗体(1∶3 000倍稀释),室温孵育1.5 h;洗膜,加入羊抗兔-HRP(1∶4 000稀释),室温孵育1.5 h;洗膜,将膜置DAB显色液中于暗处显色,观察结果。
1.5 抗原包被质量浓度与待检血清稀释倍数的确定采用方阵滴定法同时确定抗原包被质量浓度和待检血清稀释倍数,即:分别用4.0,2.0,1.0,0.5 mg/L的重组p30蛋白包被酶标板,100 μL/孔,每个梯度重复1孔,置37℃孵育1 h,4℃过夜;弃去包被液,洗涤3次,加入封闭液 于 37℃封闭1 h;加入1∶50,1∶100,1∶200,1∶400,1∶800,1∶1 600倍比稀释的阴、阳性血清与不同质量浓度的包被抗原组成方阵,100 μL/孔,各稀释度重复1孔,37℃反应1 h;弃去孔内液体,洗涤3次,每孔加入HRP-羊抗猪IgG(1∶2 500倍稀释)100 μL,于37℃反应45 min;弃去孔内液体,洗涤3次,加入底物(TMB)显色液,100 μL/孔,室温避光显色15 min;每孔加入2 mol/L H2SO450 μL终止反应。用酶标检测仪测定D450 nm值,计算阳性血清(P)与阴性血清(N)D值的比值(P/N值),确定抗原最佳包被质量浓度和待检血清的最佳稀释倍数。
1.6 封闭液和酶标抗体工作浓度的确定以确定的抗原质量浓度包被酶标板,固定血清稀释倍数,分别用5%犊牛血清、5%脱脂奶粉、1%明胶或2%BSA的封闭液与1∶500,1∶1 000,1∶2 500,1∶5 000 倍稀释的羊抗猪IgG-HRP组成方阵,进行间接ELISA,筛选最佳封闭液,确定酶标抗体的工作浓度。
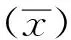
1.8 特异性试验用建立的ELISA方法检测PRV、PCV2、CSFV、PRRSV等抗血清,同时设立阳性对照与阴性对照,评价方法的特异性。
1.9 敏感性试验将5份ASFV抗血清作1∶100~1∶12 800倍比稀释,分别用建立的ELISA方法与商品试剂盒检测血清抗体效价,分析方法的敏感性。
1.10 重复性检测分别用同一批次和3个批次的p30蛋白包被酶标板,检测9份血清,重复3~5次。计算批内和批间试验的变异系数(coefficients of variation,CV),检验方法的重复性。
1.11 初步应用与Western blot验证分别用建立的ELISA方法和商品试剂盒检测116份血清样本,比较两者检测结果的符合率。同时随机选择两者检测均为阳性或阴性以及试剂盒检测为阴性、建立方法检测为阳性的血清共20份,进一步用Western blot验证。Western blot的主要操作步骤同1.4所述,其中待检血清作1∶100倍稀释,HRP-羊抗猪IgG作1∶4 000倍稀释。
2 结果
2.1 表达的重组p30蛋白将重组质粒pET28a-ASFV-p30转化到Rosetta感受态细胞后,经IPTG诱导表达4 h后,可见重组表达质粒转化菌株能够表达与预期大小相符的目的蛋白(约30 kDa)。蛋白经纯化后,电泳检测无肉眼可见杂带,NanoDrop2000测定其质量浓度为1.2 g/L。Western blot验证显示,在目的蛋白大小一致处出现1条带(图1)。结果表明,重组p30蛋白得到了正确表达,可以作为检测抗原用于下一步试验。

A.SDS-PAGE分析;B.Western blot鉴定。M1.Protein RulerⅠ蛋白相对分子质量标准;M2.Pre-Stained Marker Ⅲ蛋白相对分子质量标准;1,2.p30蛋白;3.空质粒pET28a(+)转化菌诱导产物对照
2.2 抗原包被质量浓度和待检血清稀释倍数由表1可知,当抗原包被质量浓度为1~4 mg/L、待检血清稀释倍数为1∶50~1∶100倍时,P/N大于24。考虑到抗原成本,并保持阴性对照D值较低,本试验确定抗原的包被质量浓度为1 mg/L,ASFV的抗体最佳稀释倍数为1∶100倍。
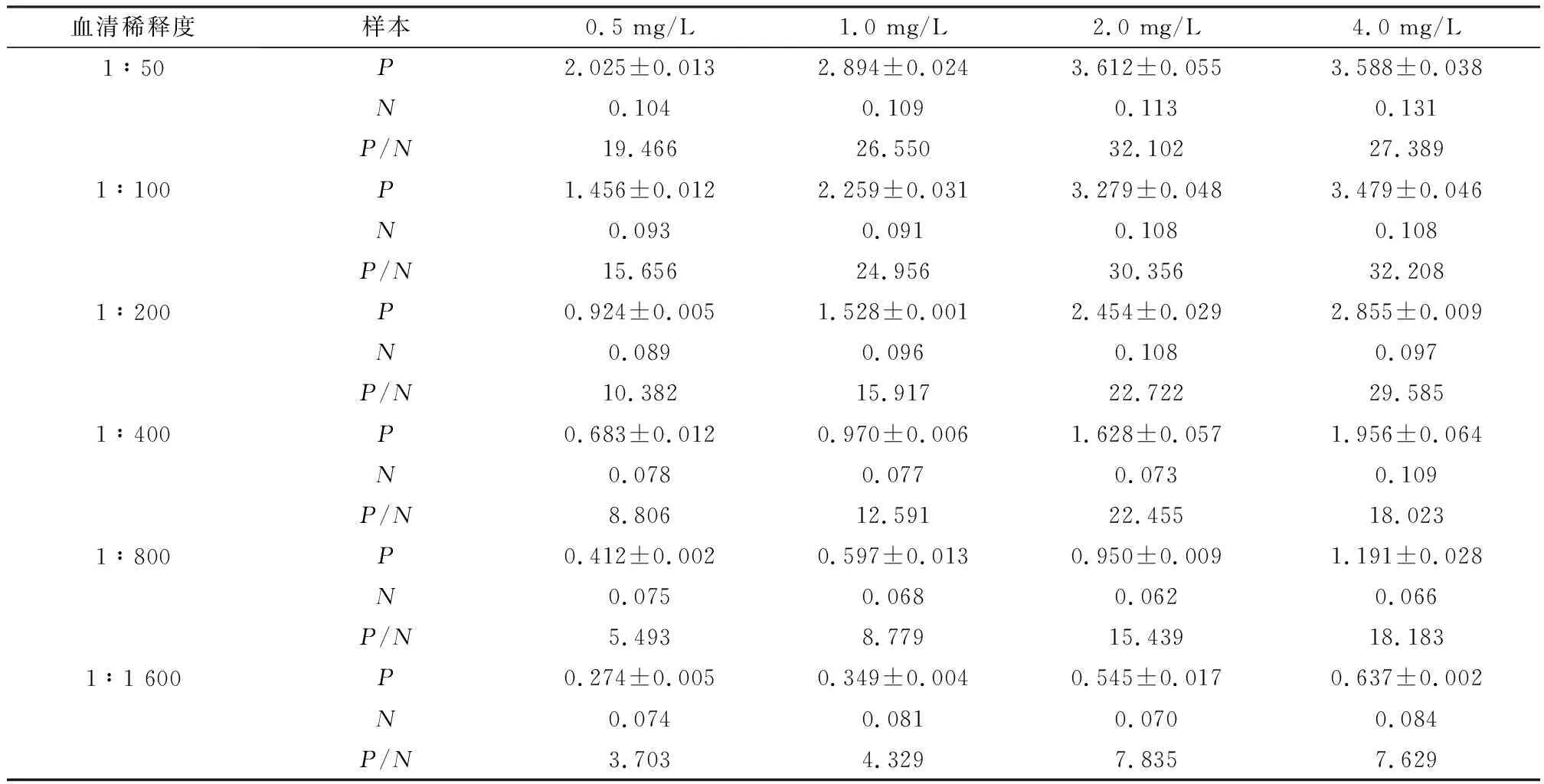
表1 抗原最佳包被质量浓度和血清最佳稀释度的确定(D450 nm 值)
2.3 封闭液与酶标抗体稀释度固定抗原包被质量浓度和待检血清稀释倍数,以不同封闭液和不同稀释倍数的酶标抗体组成方阵进行ELISA。结果当用5%小牛血清或5%脱脂奶粉的封闭液封闭酶标板、酶标抗体作1∶5 000倍稀释时,P/N比值分别为20.653或19.102,高于用1%明胶或2% BSA封闭时的P/N比值(表2)。由于脱脂奶粉储存方便、成本低,故本试验选用5%脱脂奶粉作为封闭液,酶标抗体的最佳稀释倍数为1∶5 000。
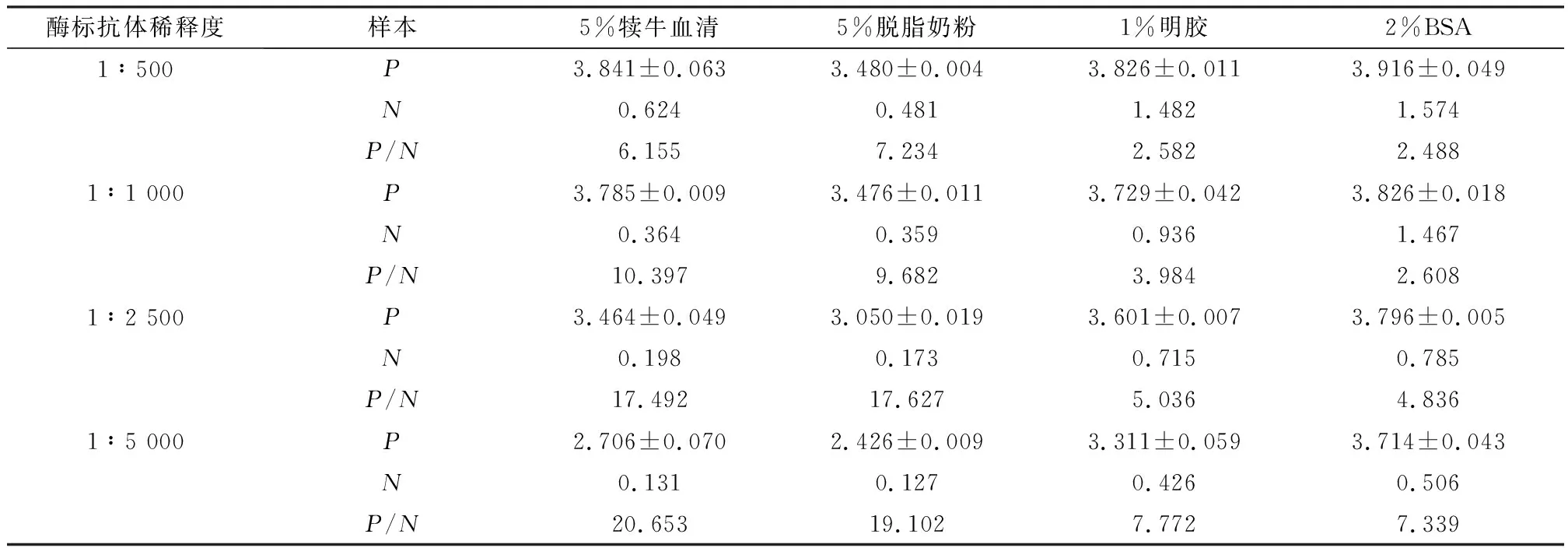
表2 最佳封闭液和酶标抗体稀释度的确定(D4 50nm 值)

图2 ELISA结果的正态分布分析
2.5 特异性用建立的ELISA同时检测ASFV及PRV、PCV2、CSFV、PRRSV等抗血清,结果只有ASFV抗血清与p30蛋白结合,呈现阳性反应,D值为1.711,其他病毒抗血清的D值均低于0.248,为阴性(图3)。该结果表明,建立的间接ELISA方法具有良好的特异性。
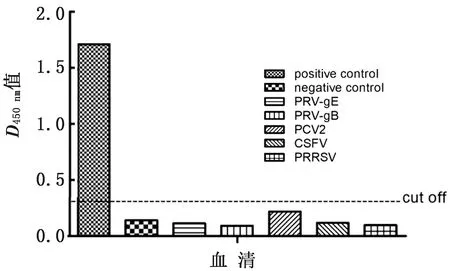
图3 ELISA的特异性检测
2.6 敏感性用本试验建立的ELISA检测5份阳性血清,ASFV抗体效价分别为1∶1 600,1∶800,1∶400,1∶3 200,1∶1 600,同时用商品试剂盒检测的抗体效价分别为1∶200,1∶200;阴性为1∶800,1∶800(图4)。此结果表明,建立的ELISA方法的敏感性更高。

A.本试验建立的ELISA;B.商品试剂盒
2.7 重复性以同一批次的p30蛋白包被酶标板检测9份血清,其CV在1.703%~7.901%之间,平均为4.723%(表3)。以3个批次的p30蛋白包被酶标板,检测9份血清,其CV在1.247%~9.211%之间,平均为4.923%(表4)。可见,建立的ELISA具有很好的重复性。
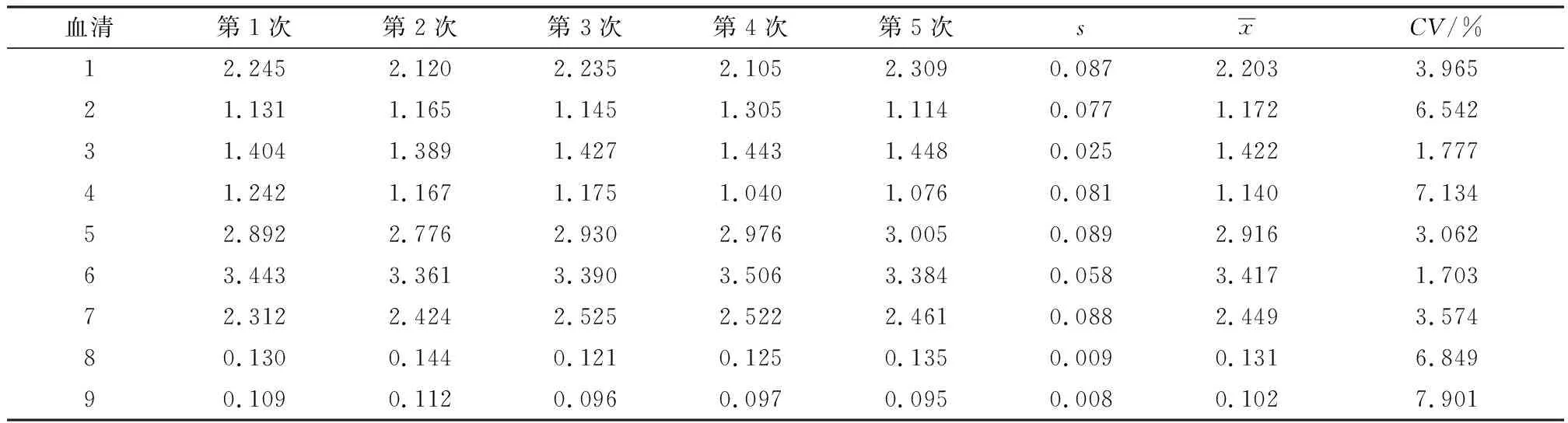
表3 批内重复性试验
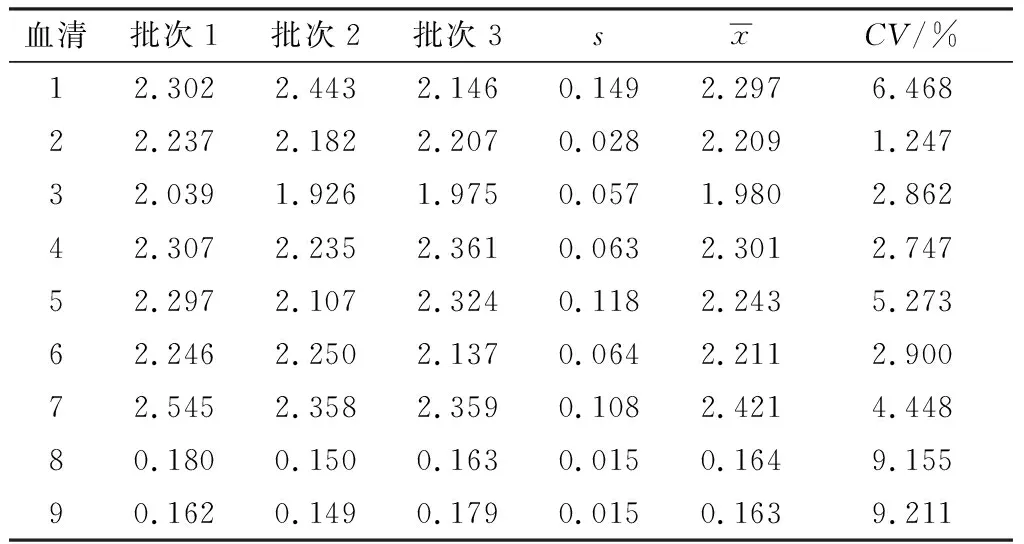
表4 批间重复性试验
2.8 临床应用与符合率为了检测建立方法的临床应用效果,同时与商品试剂盒进行比较,分别用建立的ELISA方法和试剂盒检测116份血清样本,结果抗体阳性检出率分别为72.4%(84/116)和34.5%(40/116),抗体阴性检出率分别为27.6%(32/116)和65.5%(76/116)(表5)。2种方法检测结果的阳性符合率为100%,阴性符合率为42.1%,总符合率为62.1%,结果表明建立的ELISA方法的抗体阳性检出率高于试剂盒,检测结果与试剂盒的符合率较低。应用Western blot进一步验证显示,2种方法检测结果同为阳性的血清及试剂盒检测为阴性而ELISA检测为阳性的血清,Western blot检测均出现目的条带;试剂盒和ELISA检测均为阴性的血清无目的条带出现(图5),结果表明ELISA方法的检测结果与Western blot的结果完全一致。
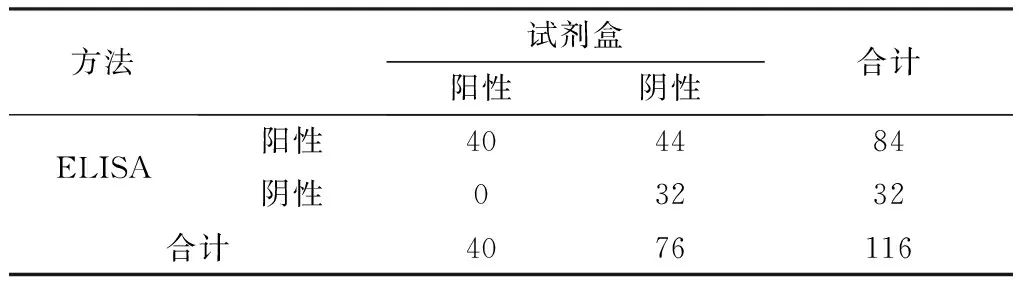
表5 建立的ELISA方法与试剂盒检测结果的符合率 份

M.蛋白相对分子质量标准(Pre-Stained Marker Ⅲ);1~9.本试验建立的ELISA和试剂盒检测均为阳性的血清;10~16.本试验建立的ELISA检测为阳性而试剂盒检测为阴性的血清;17~20.本试验建立的ELISA和试剂盒检测双阴性的血清;21.阳性对照;22.阴性对照
3 讨论
自2018年8月我国确诊首例ASF病例以来,该病迅速在国内流行,致使大量生猪死亡或被扑杀,给猪场乃至全国的生猪生产造成了极其巨大的经济损失。特别是2020年ASFV变异减毒株的出现,使猪群中病毒携带率和持续感染率增加,ASFV在猪群中长期扩散和流行的风险提高,ASF的防控形势更加严峻,但目前尚无针对该病的有效疫苗及防治制剂[14]。鉴于此,不断改进和完善诊断与监测手段,研制更加敏感的检测技术对于非洲猪瘟的有效防控至关重要。
血清学诊断技术是动物传染病临床诊断、流行病学调查以及病原携带者筛查等传染病防控实践的重要支撑,特别是ELISA抗体检测技术具有敏感性高、操作简单、便于批量检测和商品化等优势,在抗体检测和临床诊断中被广泛应用。在ASFV血清学诊断中,具有诊断意义的蛋白主要有p30、p72、p54等,其中p30和p54在病毒感染早期表达,p72在病毒感染晚期表达[7,15]。猪在感染ASFV后7~10 d即可产生特异性抗体,而血清中p30抗体不仅产生早,并且抗体效价高于p54和p72,故p30及其抗体在ASFV感染血清学诊断中是更理想的靶标[15-17]。由于以纯化的病毒或提取的病毒蛋白作为检测抗原不仅成本高,而且在制备过程中存在生物安全隐患,所以通过基因工程手段获取目的蛋白是当前血清学检测技术研究的主流。近年来,国内亦有p30-ELISA方法的研究报道[18-19],但迄今尚未见到理想的商品化ASFV抗体检测ELISA试剂盒。由于利用真核表达系统制备蛋白的成本高,故本试验利用原核表达系统表达和制备了重组p30,并建立了相应的间接ELISA方法。
抗原封闭液直接关系到ELISA的特异性,为此本试验比较了犊牛血清、脱脂奶粉、明胶或BSA封闭液的ELISA结果,结果发现5%犊牛血清或5%脱脂奶粉作为封闭液时,阳性与阴性血清D值的比值接近,均高于明胶和BSA封闭液的P/N比值,考虑到脱脂奶粉保存便捷且经济实惠,故选择5%脱脂奶粉作为本方法的封闭液。该结果与吴竞等[19]报道的基于p30建立的ELISA中介绍的封闭液(1% BSA)不同,此差别可能与ELISA反应体系受多种因素和反应条件的影响有关。
临界值的确定是判定ELISA检测结果的关键参数,故本试验除了通过ELISA常用阴阳性临界值判定的标准方法计算临界值外,还分析了阴性血清D值的正态分布情况,在保证结果服从正态分布的基础上,最后确定方法的临界值,这样既保证了检测结果具备高特异性和灵敏性,同时又不失其准确性。进一步检测证明建立的ELISA方法与CSFV、PRRSV、PRV等病毒抗血清无交叉反应,具有很高的特异性,而且比试剂盒的敏感性高。随后应用建立方法与试剂盒同时检测了临床血清样本,发现试剂盒检测为阳性的样本,建立方法的检测结果也为阳性,但试剂盒检测为阴性的样本中,建立方法却检出了阳性样本,致使2种方法检测结果的总符合率较低。为了证明ELISA检测结果的准确性,进而用Western blot对ELISA检测结果进行了验证,发现ELISA的检测结果与Western blot结果完全一致。这不仅证明了建立方法检测结果的准确性,而且具有更高的敏感性。
总之,建立的基于ASFV-p30的ELISA方法特异、敏感,可用于ASFV感染的早期诊断与感染猪筛查,在ASFV综合防控中具有广泛的开发与应用前景。
