猪圆环病毒3型SYBR GreenⅠ实时荧光定量PCR方法的建立
2022-10-24李杰峰王华健孙艳玲杨旭光马玉忠翟向和
王 星,李杰峰,张 宁,王华健,孙艳玲,杨旭光,马玉忠,杨 威*,翟向和*
(1.河北农业大学 动物医学院,河北 保定 071001;2.河北省畜牧兽医研究所,河北 保定 071001;3.衡水市动物疫病预防控制中心,河北 衡水 053000)
猪圆环病毒3型(porcine circovirus type 3,PCV3)是美国学者PALINSKI等[1]在临床症状表现为猪的皮炎肾病综合征的母猪和流产木乃伊胎中发现的一种单链DNA病毒,该病毒属于圆环病毒科、圆环病毒属,直径为17~20 nm,立体结构呈现为对称的二十面体,无囊膜。PCV3含有2个主要的开放阅读框ORF1和ORF2,其中ORF1以GTC作为起始密码子,编码Rep蛋白,与PCV3的复制相关;ORF2以ATG作为起始密码子,编码Cap蛋白,是PCV3主要的结构蛋白[2]。自PALINSKI等[1]报道之后,PCV3在全球各地均有报道,如英国、韩国、德国、波兰、意大利、日本等[3]。2016年11月,KU等[4]对来自我国安徽、重庆、福建、河北、河南等11个省份或地区的222份样品进行了PCV3检测,结果显示在11个省份或地区的样品中均能检测到PCV3,证明PCV3已在我国广泛传播。
鉴于PCV2对全球养猪产业带来的巨大经济损失,PCV3已成为一个世界养猪产业面临的新威胁,而目前对于PCV3的诊断方法有常规PCR、巢式PCR、环介导等温扩增技术(LAMP)、间接ELISA等[5]。相比常规PCR检测方法,SYBR GreenⅠ荧光定量PCR具有灵敏度高、特异性好、用时短的优点[6]。本试验拟根据PCV3 ORF1基因建立检测PCV3的SYBR GreenⅠ荧光定量PCR,为PCV3的快速诊断、流行病学调查及防控提供技术支持。
1 材料与方法
1.1 病原及样本高致病性蓝耳病病毒(HP-PRRSV)、猪圆环病毒2型(PCV2)、口蹄疫病毒(FMDV)、猪细小病毒(PPV)、猪瘟病毒(CSFV)、伪狂犬病病毒(PRV)、猪博卡病毒(PBoV)、猪流行性腹泻病毒(PEDV)阳性核酸均为河北省畜牧兽医研究所保存;PCV3阳性样本为本试验室鉴定保存(GenBank登录号:MK105924);100份猪血清采自河北省内养殖场。
1.2 主要试剂病毒基因组DNA/RNA提取试剂盒、RNA反转录试剂盒、质粒小提试剂盒、M5 HiPer pPOTO-TA Cloning Kit试剂盒、M5 HiPer plus Taq HiFi PCR mix(2×)、M5 HiPer SYBR Premix EsTaq(2×)、2 000 bp DNA marker、DH5α感受态细胞均购自北京聚合美生物公司;MiNi BEST DNA Fragment 纯化试剂盒,购自北京宝日医生物技术公司。
1.3 引物的设计与合成使用DNAStar软件对PCV3 Rep基因进行序列分析,参考GenBank上发布的PCV3基因序列(GenBank登录号:MK105924),选取保守序列使用Primer Premier 5软件,设计1对特异性引物,引物序列见表1。

表1 引物序列信息
1.4 DNA/RNA的提取参考病毒基因组DNA/RNA提取试剂盒说明书,提取血清总DNA/RNA,并参考RNA反转录试剂盒说明书对总RNA进行反转录,将获取的DNA/cDNA置于-20℃保存。

1.6 SYBR GreenⅠ实时荧光定量PCR反应体系退火温度的优化按照SYBR Premix说明书推荐构建反应体系及PCR扩增程序,反应体系为25 μL。其中,SYBR Premix ESTaq(2×)12.5 μL,DNA 模板2 μL,10 μmol/L 上、下游引物各0.5 μL,ddH2O补足至25 μL。分别以6.55×103,6.55×105拷贝/μL的标准品质粒为模板,在56~64℃范围内对引物的退火温度进行优化,选取最小Ct值,确定最佳退火温度。
1.7 标准曲线及熔解曲线的建立将已知拷贝数的标准品质粒用ddH2O进行10倍倍比稀释,选取梯度为6.55×102~6.55×108拷贝/μL的标准品质粒作为模板,采用优化后的反应条件进行SYBR GreenⅠ实时荧光定量PCR扩增,建立标准曲线;在扩增程序后添加熔解曲线程序(60~95℃,升温速率为0.5℃/s),建立熔解曲线,根据熔解曲线得出PCV3的溶解温度(Tm)。
1.8 灵敏度试验使用建立的SYBR GreenⅠ实时荧光定量PCR对浓度为6.55×100~6.55×107拷贝/μL标准品质粒进行检测,测定SYBR GreenⅠ实时荧光定量PCR所能检测的最低拷贝数,并和常规PCR进行比较。
1.9 特异性试验分别以HP-PRRSV、FMDV、CSFV、PEDV的cDNA以及PCV2、PPV、PRV、PBoV的DNA、标准品质粒(阳性对照)和ddH2O(空白对照)为模板,进行特异性检测。
1.10 重复性试验分别选取浓度为6.55×103,6.55×105,6.55×107拷贝/μL标准品质粒为模板,对所建立SYBR GreenⅠ实时荧光定量PCR进行重复性试验。设置批内和批间试验,每个浓度进行3个重复,计算Ct值的批内和批间变异系数,验证该方法的可重复性。
1.11 临床样品检测以河北省内收集的100份猪血清DNA为模板,分别使用SYBR GreenⅠ实时荧光定量PCR和常规PCR进行检测,并选取部分SYBR GreenⅠ实时荧光定量PCR阳性产物进行测序,验证产物序列。
2 结果
2.1 标准品质粒验证结果重组质粒PCR产物经过1%琼脂糖凝胶电泳验证,出现约为228 bp的条带,与预期相符(图1);重组质粒测序结果比对正确,说明标准品质粒构建成功;质粒小提试剂盒提取的重组质粒经K5500超微量分光光度计测得质量浓度为0.14 g/L,根据公式计算重组质粒拷贝数为6.55×1010拷贝/μL。
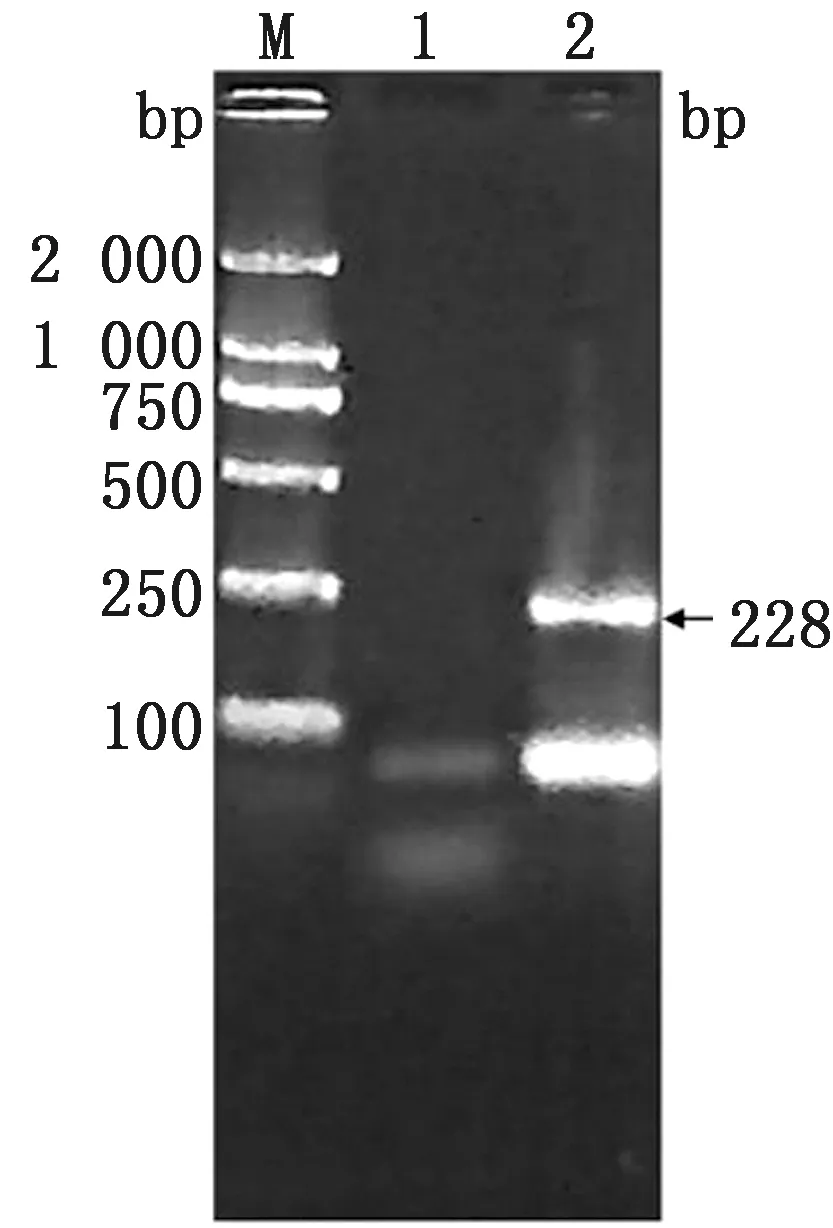
M.2 000 bp Marker;1.空白对照;2.质粒PCR产物
2.2 SYBR GreenⅠ实时荧光定量PCR退火温度的优化分别使用浓度为6.55×105,6.55×103拷贝/μL的标准品质粒为模板,对SYBR GreenⅠ实时荧光定量PCR的退火温度进行优化,结果显示当温度为56℃时Ct值最小(表2);最后确定反应体系为:SYBR Premix ESTaq(2×) 12.5 μL,DNA模板 2 μL,10 μmol/L 上、下游引物各0.5 μL,ddH2O 9.5 μL;反应程序为:95℃ 预变性30 s;95℃ 5 s,56℃ 30 s,40个循环,后增加熔解曲线程序:60~95℃,升温速率为0.5℃/s。

表2 退火温度优化(Ct值)
2.3 标准曲线及熔解曲线的建立分别以浓度为6.55×102~6.55×108拷贝/μL的标准品质粒为模板,进行SYBR GreenⅠ实时荧光定量PCR扩增,并以标准品质粒初始浓度的对数为横坐标,荧光Ct值为纵坐标绘制曲线,结果可得标准曲线的线性关系式为:y=-3.329x+34.382,相关系数R2=0.996,扩增效率E=99.7%(图2);多次试验结果显示,不同浓度的质粒标准品的熔解曲线具有单一峰值,Tm为(81.0±0.5)℃(图3)。
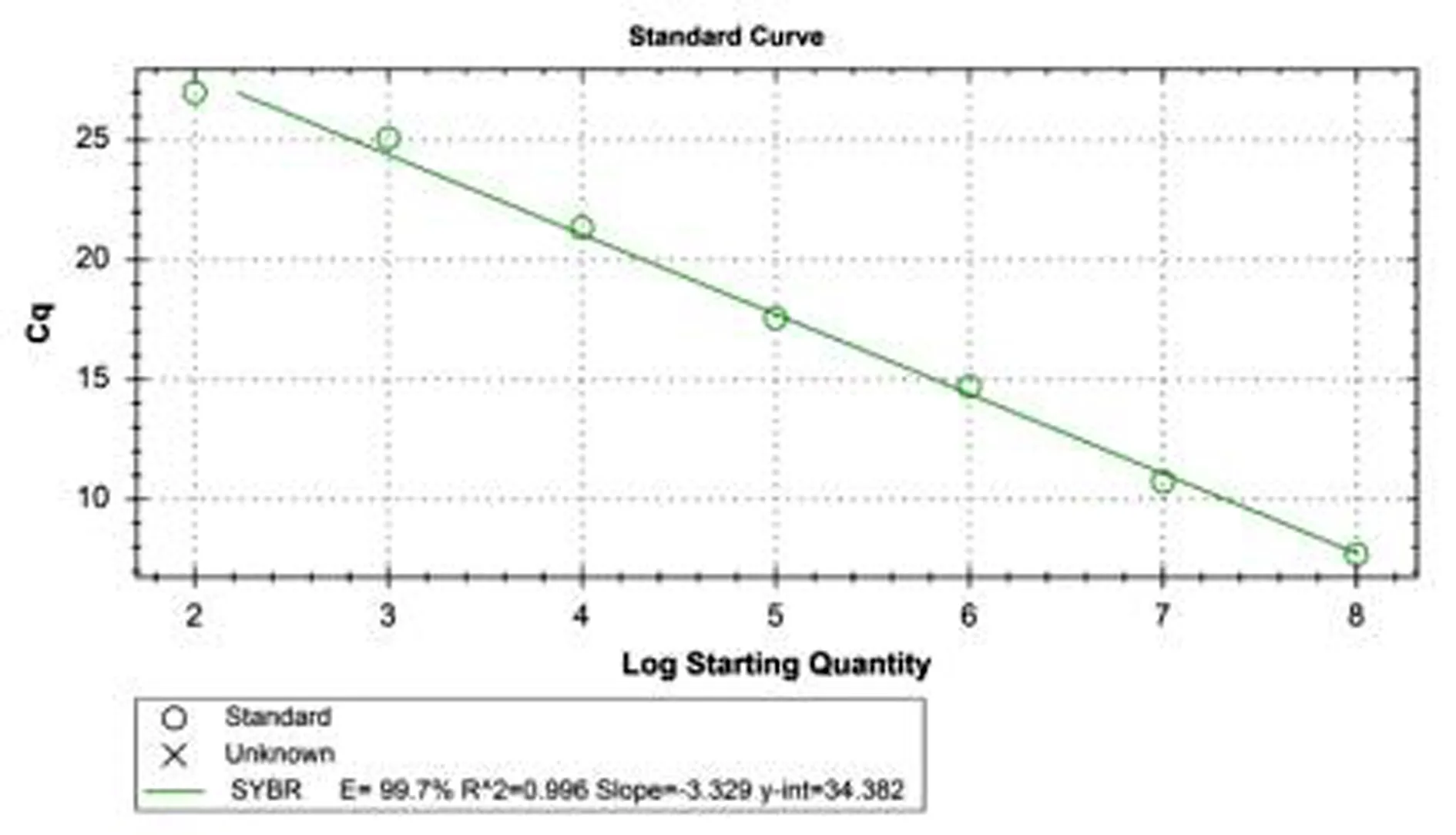
图2 SYBR GreenⅠ实时荧光定量PCR标准曲线

图3 SYBR GreenⅠ实时荧光定量PCR熔解曲线
2.4 灵敏度试验选取浓度为6.55×100~6.55×107拷贝/μL的标准品质粒为模板,分别进行常规PCR和SYBR GreenⅠ实时荧光定量PCR的灵敏度检测。结果显示,常规PCR最低可检测到的标准品质粒拷贝数为6.55×102拷贝/μL(图4);SYBR GreenⅠ实时荧光定量 PCR最低可检测到的标准品质粒拷贝数为6.55 拷贝/μL(图5),灵敏度达到了常规PCR的100倍。

M.2 000 bp marker;1.空白对照;2~9.6.55×100~6.55×107 拷贝/μL标准品质粒
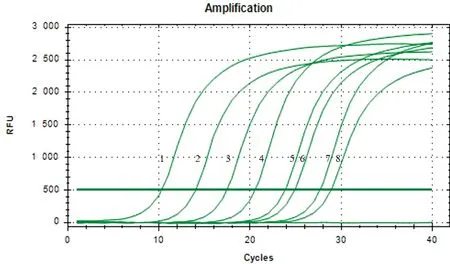
1~8.6.55×107~6.55×100 拷贝/μL标准品质粒
2.5 特异性试验特异性试验结果显示,建立的SYBR GreenⅠ实时荧光定量PCR只对PCV3标准品质粒模板有特异性扩增,而对HP-PRRSV、FMDV、CSFV、PEDV、PCV2、PPV、PRV、PBoV均无扩增产物(图6)。
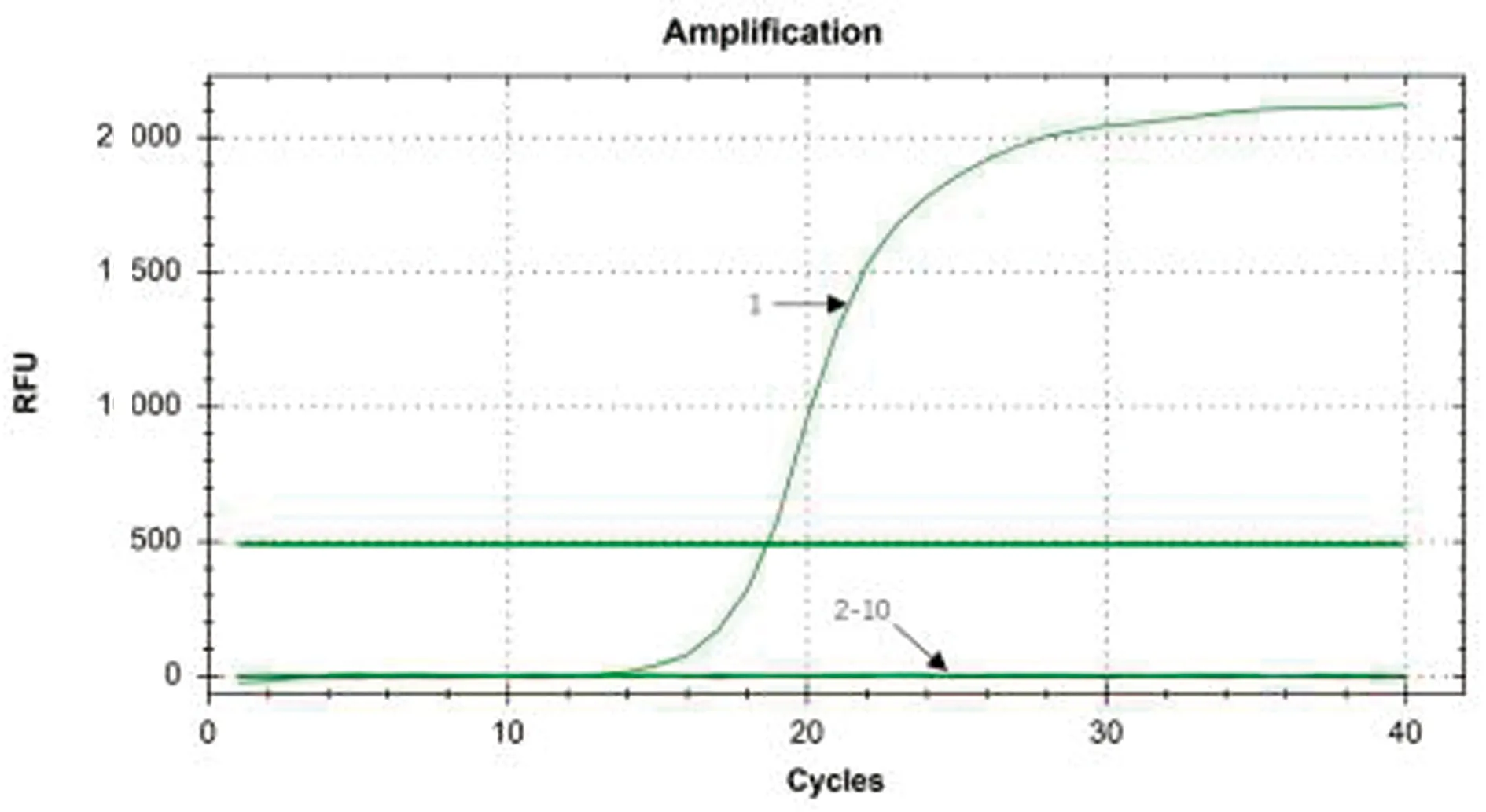
1.PCV3标准品质粒;2~10.HP-PRRSV、FMDV、CSFV、PEDV、PCV2、PPV、PRV、PBoV、空白对照
2.6 重复性试验批内重复性试验结果显示,浓度为6.55×103拷贝/μL的标准品质粒变异系数为0.72%,浓度为6.55×105拷贝/μL的标准品质粒变异系数为0.68%,浓度为6.55×107拷贝/μL的标准品质粒变异系数为1.59%;批间重复性试验结果显示,浓度为6.55×103拷贝/μL的标准品质粒变异系数为0.75%,浓度为6.55×105拷贝/μL的标准品质粒变异系数为0.94%,浓度为6.55×107拷贝/μL的标准品质粒变异系数为1.19%,批间和批内变异系数均小于2%(表3)。
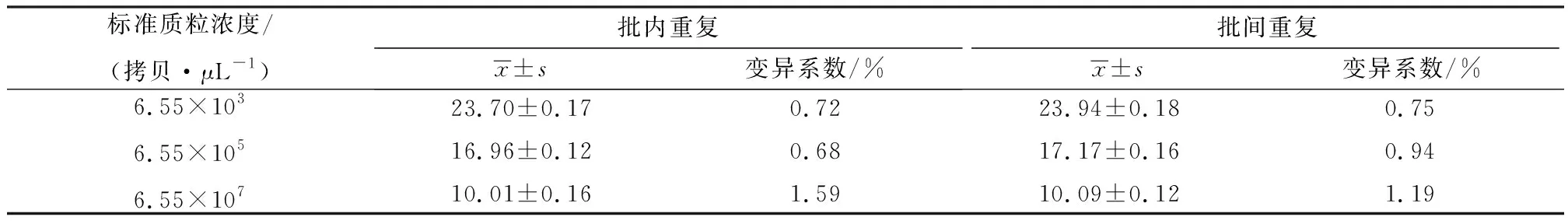
表3 SYBR GreenⅠ实时荧光定量PCR重复性试验结果
2.7 临床试验结果100份来自河北省内养殖场的猪血清DNA分别使用SYBR GreenⅠ实时荧光定量PCR和常规PCR进行PCV3检测。结果显示,SYBR GreenⅠ实时荧光定量PCR的阳性率为16%(16/100),而常规PCR的阳性率为10%(10/100);在SYBR GreenⅠ实时荧光定量PCR的16份阳性扩增产物中选取5份进行测序,测序结果经比对均为PCV3 Rep基因序列。
3 讨论
目前,猪圆环病毒(PCV)包含PCV1、PCV2、PCV3和PCV4等4种病毒类型。其中,PCV1对猪不致病,PCV4是最新发现的一种猪圆环病毒,目前研究较少[7]。PCV2可以引起断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)以及繁殖障碍等相关疾病。PCV2还会引起猪的免疫抑制,导致猪混合感染几率上升,对全球养猪产业带来巨大的经济损失[8]。PHAN等[2]研究结果表明,PCV3与猪繁殖障碍、心脏和多器官炎症反应以及PDNS有一定的联系。KU等[4]研究结果显示,不仅可以在动物的脑、心脏、肺脏、淋巴结等器官或组织中检出PCV3,而且可以在死胎和精液中检出PCV3,这代表着PCV3能够垂直传播。赵振翔等[9]通过构建PCV3 Cap真核表达质粒来研究PCV3 Cap蛋白对天然免疫应答的调控,试验结果证实了PCV3-Cap 通过作用于cGAS-MITA 通路中的MITA抑制Ⅰ型干扰素通路的活化,进而抑制IFN-β、ISG15、ISG54和MxA 等细胞因子的表达,抑制天然免疫抗病毒反应。CHEN等[10]研究发现,PCV3与PCV2、PRRSV存在混合感染,因此对PCV3的监测需加以重视。
SYBR GreenⅠ实时荧光定量PCR作为实时荧光定量PCR中的一种,与探针法实时荧光定量PCR相比,SYBR GreenⅠ实时荧光定量PCR具有成本低、无需合成价格昂贵的探针和操作简单的优点;与常规PCR相比,SYBR GreenⅠ实时荧光定量PCR具有灵敏度高、反应时间短、特异性强的优点。SYBR GreenⅠ实时荧光定量PCR的熔解曲线Tm值受到核酸片段的GC含量、片段长度和结构影响[11],因此可以根据熔解曲线Tm值判断PCR产物的正确性。依据以上原理,可以设计扩增不同长度产物的引物,建立多重SYBR GreenⅠ实时荧光定量PCR检测方法。
本试验针对PCV3的ORF1基因设计了1对特异性引物,建立了SYBR GreenⅠ实时荧光定量PCR。该方法特异性良好,除PCV3以外,对多种病毒均无非特异性扩增;灵敏度高,最低检测限为6.55 拷贝/μL,是常规PCR的100倍;以6.55×102~6.55×108拷贝/μL的标准品质粒为模板,所建立的标准曲线线性关系良好,R2=0.966,扩增效率可达99.7%;熔解曲线峰值单一且稳定,熔解温度Tm为(81±0.5)℃;重复性良好,批间和批内重复性试验结果显示变异系数均低于2%;临床样品检测结果说明,本试验建立的PCV3 SYBR GreenⅠ实时荧光定量PCR具有临床实用性。综上所述,本试验成功地建立了一种SYBR GreenⅠ实时荧光定量PCR检测方法,为PCV3快速诊断、流行病学调查及其防控奠定了基础。
