葛根芩连汤抑制TNF-α诱导的Caco-2细胞氧化损伤配伍规律研究
2022-10-21董文敏张倩芸刘王振祖王新宏
林 川,董文敏,张倩芸,刘王振祖,梁 琨,王新宏,安 叡*
葛根芩连汤抑制TNF-α诱导的Caco-2细胞氧化损伤配伍规律研究
林 川1,董文敏2,张倩芸1,刘王振祖1,梁 琨1,王新宏1,安 叡1*
1. 上海中医药大学中药学院,上海 201203 2. 复旦大学附属浦东医院,上海 201200
探讨葛根芩连汤缓解肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的人结肠癌Caco-2细胞氧化应激损伤作用及其配伍规律。将Caco-2细胞随机分为对照组、TNF-α(80 μg/L)组、小檗碱(6.73 μg/mL)组及葛根芩连汤配伍组(全方组、去甘草组、去葛根组、葛根甘草组和黄芩黄连组,18.75 μg/mL)。除对照组外,其余各组细胞给予TNF-α预处理2 h,再给予相应药物处理24 h。MTT检测Caco-2细胞活力;流式细胞术检测细胞内活性氧(reactive oxygen species,ROS)水平;比色法检测细胞中总超氧化物歧化酶(total superoxide dismutase,T-SOD)活性和丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutathione,GSH)水平;qRT-PCR和Western blotting分别检测核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,)、还原型辅酶I/II醌氧化还原酶1[NAD(P)H quinine oxidoreductase 1,]和血红素氧合酶-1(heme oxygenase 1,)mRNA和蛋白表达;荧光显微镜观察Nrf2蛋白入核情况。5.0~25.0 μg/mL的含药培养基和10~80 μg/L的TNF-α对Caco-2细胞活性无明显影响。与TNF-α组比较,各给药组Caco-2细胞ROS水平显著降低(<0.01);除去葛根组和黄芩黄连组外,其余各组MDA水平显著降低(<0.01),GSH水平明显升高(<0.01);除去葛根组外,其余各给药组基因表达明显升高(<0.01),全方组和去甘草组基因表达明显升高(<0.05、0.01),全方组和葛根甘草组基因表达明显升高(<0.05、0.01);除黄芩黄连组外,其余各组Nrf2和HO-1蛋白表达显著升高(<0.01);除去葛根组和黄芩黄连组外,其余各组NQO1蛋白水平显著升高(<0.05、0.01),Nrf2蛋白入核明显增加(<0.05、0.01)。缺少葛根对葛根芩连汤抑制Caco-2细胞氧化应激损伤有较大影响。
葛根芩连汤;葛根;配伍规律;氧化应激;结肠癌细胞
氧化应激是体内氧化与抗氧化作用失衡的一种状态,倾向于氧化,中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物。氧化应激是自由基在体内产生的一种负面作用,是导致衰老和疾病的一个重要因素。葛根芩连汤出自《伤寒论》,为医圣张仲景的名方之一。方中葛根为君,以其甘辛而凉,主入阳明经,外解肌表之邪、内清阳明之热,使表解里和;臣以黄芩、黄连苦寒清热,坚阴止利;佐使以甘草甘缓和中,调和诸药;四药合用,外疏内清,表里同治。研究表明,葛根芩连汤对氧化应激损伤有一定的缓解作用[1-2]。本课题组前期从化学成分[3]、入血成分[4]、在人结肠癌Caco-2细胞模型中的吸收特征[5]、对肝脏细胞色素P450(cytochrome P450,CYP450)具体亚型酶活性的影响[6]、肠外翻吸收[7-9]、在体肠道灌流吸收及对急性肠炎大鼠肠道菌群多样性的影响[10-11]等方面对葛根芩连汤的配伍机制进行了大量研究。本研究以人肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)为刺激因素[12-13],激活Caco-2细胞炎症反应,观察葛根芩连汤及不同配伍组对Caco-2细胞的影响,以及对氧化应激相关细胞因子和通路的作用,以阐释葛根芩连汤抗氧化应激作用机制及其配伍的合理性,为更全面地揭示该复方配伍规律的研究奠定基础。
1 材料
1.1 细胞
Caco-2细胞购自赛百慷生物技术股份有限公司。
1.2 药材
葛根、黄芩、黄连和炙甘草饮片均购自上海康桥中药饮片有限公司,批号分别为201016、201103、201118、201109,经上海中医药大学倪梁红副教授鉴定分别为豆科植物野葛(Willd.) Ohwi的干燥根、唇形科植物黄芩Georgi的干燥根、毛茛科植物黄连Franch的干燥根茎和豆科植物甘草Fisch.的干燥根和根茎,符合《中国药典》2020年版规定。
1.3 药品与试剂
小檗碱(质量分数≥98%,批号Y18N8S48598)购自上海源叶生物科技有限公司;MEM培养基(批号20210706)、青链霉素混合液(批号20211119)、0.25%胰蛋白酶(批号2021060105)均购自武汉普诺赛生命科技有限公司;胎牛血清(fetal bovine serum,FBS,批号2217479CP)购自美国Gibco公司;MTT(批号CR2107085)、β-actin抗体(批号AC2102050A)、HRP标记的山羊抗兔IgG抗体(批号CR2104079)购自武汉赛维尔生物科技有限公司;TNF-α(批号021825)购自PeproTech公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)测定试剂盒(批号20201231)、还原型谷胱甘肽(glutathione,GSH)测定试剂盒(批号20210106)、丙二醛(malondialdehyde,MDA)测定试剂盒(批号20210105)购自南京建成生物工程研究所;活性氧(reactive oxygen species,ROS)检测试剂盒(批号01152120319)、总RNA抽提试剂Trizol(批号030221211216)、ECL化学发光试剂盒(批号031519190503)、Triton X-100(批号120921220118)、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI,批号091720210121)购自碧云天生物技术公司;ChamQ Universal SYBR qPCR Master Mix(批号027E1280LB)、HiScript®II Q RT SuperMix for qPCR(批号017E2232BA)购自诺唯赞公司;RIPA裂解液(批号R1001221)、BCA蛋白定量试剂盒(批号B1001231)购自上海翊圣生物公司;核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗体(批号00102781)、还原型辅酶I/II醌氧化还原酶1[NAD(P)H quinine oxidoreductase 1,NQO1]抗体(批号10017852)、血红素氧合酶-1(heme oxygenase-1,HO-1)抗体(批号00083458)购自Proteintech公司;浓缩型正常山羊血清(批号17G04A09)、荧光(Cy3)标记的羊抗兔IgG抗体(批号BST16L31C17G32)购自武汉博士德生物工程有限公司。
1.4 仪器
SW-CJ-1FD型超净工作台(苏州集团安泰空气技术有限公司);FlexStation3型多功能酶标仪(Molecular Devices公司);cytoFLEX型流式细胞仪(Beckman Coulter公司);BioPhotometer D30型核酸蛋白检测仪,Mastercycler pro型梯度PCR仪(德国Eppendorf公司);StepOnePlus型qRT-PCR仪(美国ABI公司);PowerPac Basic型电泳仪及Mini Transblot型湿转印槽(美国Bio-Rad公司);AI 600型超灵敏多功能成像仪(美国GE公司);BX53型生物显微镜(日本Olympus公司)。
2 方法
2.1 葛根芩连汤的制备
设置全方(GQ)组、去甘草(WGC)组(葛根、黄芩、黄连)、去葛根(WG)组(黄芩、黄连、甘草)、葛根甘草(GG)组、黄芩黄连(QL)组,将葛根、黄芩、黄连、甘草按照5∶3∶2∶2的比例混合(各组中缺味药材按0计算),分别加10倍量水,葛根先煎20 min,余药共煎30 min,煎煮2次,滤过,合并滤液,采用液相色谱串联质谱(LC-MS/MS)测定成分及含量[1,3],GQ组、WGC组和GG组葛根素质量分数分别为4.86、3.78和3.14 mg/g,GQ组、WGC组、WG组和QL组小檗碱质量分数分别为6.76、0.73、6.91和1.79 mg/g。滤液于60 ℃旋转蒸发浓缩,放至室温后于−20 ℃冰箱预冻,转入冻干机,真空冷冻干燥,取出并碾压得到冻干粉。以二甲基亚砜(dimethyl sulfoxide,DMSO)溶解冻干粉[14],经微孔滤膜滤过,使用时以培养基稀释。
2.2 细胞培养
Caco-2细胞用含20% FBS和1%青链霉素混合液的MEM培养基[15-16],于37 ℃、5% CO2的培养箱中培养,待细胞融合至对数生长期时进行后续实验。
2.3 葛根芩连汤及配伍对Caco-2细胞存活率的影响
取处于对数生长期的Caco-2细胞,以5×103个/孔接种至96孔板,培养过夜。设置对照组、GQ组、WGC组、WG组、GG组和QL组,各给药组分别以5.0、12.5、25.0、50.0、100.0、200.0 μg/mL的相应药物处理24 h,对照组给予等体积培养基培养24 h。每孔加入10 μL MTT,37 ℃培养4 h;弃去培养基,加入150 μL DMSO振荡10 min,采用酶标仪测定490 nm处的吸光度()值,计算细胞存活率。
细胞存活率=给药/对照
2.4 TNF-α对Caco-2细胞存活率的影响
取处于对数生长期的Caco-2细胞,以5×103个/孔接种至96孔板,培养过夜。设置对照组和TNF-α组,TNF-α组分别以10、20、40、80、100 μg/L的TNF-α处理26 h,对照组给予等体积培养基培养26 h。按“2.3”项下方法测定各组值,计算细胞存活率。
2.5 细胞内ROS含量的测定
取处于对数生长期的Caco-2细胞,以2×105个/孔接种至6孔板,培养过夜。设置对照组、TNF-α组、小檗碱组和葛根芩连汤及其配伍组,TNF-α组给予80 μg/L TNF-α处理26 h,各给药组给予80 μg/L TNF-α预处理2 h后,BBR组给予6.73 μg/mL小檗碱[2,17],葛根芩连汤及其配伍组分别给予18.75 μg/mL药液[2],与TNF-α共同作用24 h,对照组给予等体积培养基培养26 h,按照试剂盒说明书检测细胞内ROS水平。
2.6 细胞T-SOD活性和MDA、GSH水平的检测
取处于对数生长期的Caco-2细胞,按“2.5”项下方法分组并给药,收集细胞,按照试剂盒说明书检测T-SOD活性和MDA、GSH水平。
2.7 qRT-PCR检测Nrf2、NQO1和HO-1 mRNA表达
取处于对数生长期的Caco-2细胞,按“2.5”项下方法分组并给药,收集细胞,用预冷的PBS洗涤。按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析[17]。引物由生工生物工程(上海)股份有限公司设计合成,引物序列见表1。
2.8 Western blotting检测Nrf2、NQO1和HO-1蛋白表达
取处于对数生长期的Caco-2细胞,按“2.5”项下方法分组并给药,收集细胞,用预冷的PBS洗涤。加入100 μL含1%磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液,提取细胞总蛋白。采用BCA蛋白定量试剂盒测定蛋白浓度,加入Loading buffer混匀,95 ℃加热使蛋白变性,分装后于−80 ℃保存。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后,分别加入Nrf2(1∶2000)、NQO1(1∶10 000)、HO-1(1∶1000)和β-actin(1∶3000)抗体,4 ℃孵育过夜;加入相应二抗(1∶3000),室温孵育2 h,显影后,用Image J软件分析目的条带灰度值[18]。
表1 引物序列
Table 1 Primer sequences
基因序列 (5’-3’) Nrf2F: GACAATGAGGTTTCTTCGGCTACG R: GGAGAGGATGCTGCTGAAGGAATC NQO1F: CGCAGACCTTGTGATATTCCAG R: CGTTTCTTCCATCCTTCCAGG HO-1F: CAGCATGCCCCAGGATTTG R: AGCTGGATGTTGAGCAGGA β-actinF: CCTGACTGACTACCTCATGAAG R: GACGTAGCACAGCTTCTCCTTA
2.9 免疫荧光染色检测Caco-2细胞Nrf2入核作用
取处于对数生长期的Caco-2细胞,接种于细胞爬片上,按“2.5”项下方法分组并给药,24 h后吸弃培养板中液体,加入PBS洗涤,于4%多聚甲醛中固定,加入0.5% Triton X-100室温通透,滴加正常山羊血清,室温封闭。吸干封闭液,滴加Nrf2抗体(1∶50),放入湿盒,4 ℃孵育过夜。浸洗,吸干,滴加荧光(Cy3)标记的羊抗兔IgG抗体(1∶100),于37 ℃湿盒中孵育1 h。滴加DAPI,避光孵育染核。洗涤,吸干液体,加入含抗荧光淬灭剂的封片液封片,于荧光显微镜下观察,采集图像,使用IPP 6.0软件对免疫荧光照片进行分析。
2.10 统计学分析
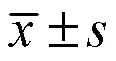
3 结果
3.1 葛根芩连汤及配伍对Caco-2细胞存活率的影响
如表2所示,葛根芩连汤及其配伍在5.0~25.0 μg/mL时,Caco-2细胞存活率基本在80%及以上,说明Caco-2细胞未受到明显影响。根据前期研究,GQ为18.75 μg/mL时[2],对Caco-2细胞损伤缓解作用较好,因此后续实验中葛根芩连汤及其配伍组的质量浓度设定为18.75 μg/mL。
3.2 TNF-α对Caco-2细胞存活率的影响
如表3所示,Caco-2细胞给予10~80 μg/L的TNF-α处理时,细胞存活率均大于80%,活性基本未见明显影响。根据前期研究[2],80 μg/L TNF-α显著诱导细胞内促炎细胞因子白细胞介素-1β(interleukin-1β,)mRNA的表达,因此在后续实验中选择80 μg/L TNF-α诱导细胞损伤。
3.3 葛根芩连汤及配伍对细胞内ROS水平的影响
如表4所示,与对照组比较,TNF-α诱导后细胞内ROS水平明显升高(<0.01);经药物干预后,Caco-2细胞内ROS水平均显著降低(<0.01);与GQ组比较,WG组和QL组细胞内ROS水平显著升高(<0.01)。
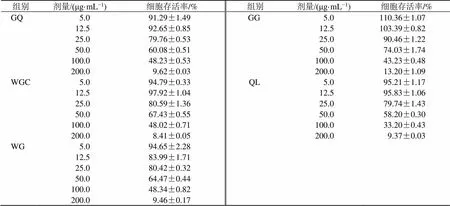
组别剂量/(μg·mL−1)细胞存活率/%组别剂量/(μg·mL−1)细胞存活率/% GQ5.091.29±1.49GG5.0110.36±1.07 12.592.65±0.85 12.5103.39±0.82 25.079.76±0.53 25.090.46±1.22 50.060.08±0.51 50.074.03±1.74 100.048.23±0.53 100.043.23±0.48 200.09.62±0.03 200.013.20±1.09 WGC5.094.79±0.33QL5.095.21±1.17 12.597.92±1.04 12.595.83±1.06 25.080.59±1.36 25.079.74±1.43 50.067.43±0.55 50.058.20±0.30 100.048.02±0.71 100.033.20±0.43 200.08.41±0.05 200.09.37±0.03 WG5.094.65±2.28 12.583.99±1.71 25.080.42±0.32 50.064.47±0.44 100.048.34±0.82 200.09.46±0.17
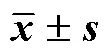
表3 TNF-α对Caco-2细胞存活率的影响(, n = 3)
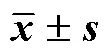
表4 葛根芩连汤及配伍对Caco-2细胞内ROS水平的影响(, n = 3)
与对照组比较:**<0.01;与TNF-α组比较:#<0.05##<0.01;与GQ组比较:&<0.05&&<0.01,下表同
**< 0.01control group;#< 0.05##< 0.01TNF-α group;&< 0.05&&< 0.01GQ group, same as below tables
3.4 葛根芩连汤及配伍对细胞内T-SOD活性和MDA、GSH水平的影响
如表5所示,与对照组比较,TNF-α组细胞中MDA水平显著升高(<0.01),T-SOD活性和GSH水平显著降低(<0.01);与对照组比较,小檗碱组、GQ组、WGC组和GG组MDA水平显著降低(<0.01),GSH水平显著升高(<0.01);与GQ组比较,WG组和QL组MDA水平显著升高(<0.01),GSH水平显著降低(<0.01)。
3.5 葛根芩连汤及配伍对细胞内Nrf2、NQO1和HO-1 mRNA表达的影响
如表6所示,与对照组比较,TNF-α组mRNA表达呈下降趋势,和mRNA表达水平均明显降低(<0.01);与TNF-α组比较,小檗碱组、GQ组、WGC组、GG组和QL组mRNA表达水平均显著升高(<0.05、0.01),GQ组和WGC组mRNA表达水平均显著升高(<0.05、0.01),GQ组和GG组mRNA表达水平均显著升高(<0.05、0.01);与GQ组比较,WGC组、WG组、GG组和QL组和mRNA表达水平均明显降低(<0.01),WGC组、WG组和QL组mRNA表达水平均明显降低(<0.01)。
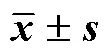
表5 葛根芩连汤及配伍对Caco-2细胞中T-SOD活性和MDA、GSH水平的影响(, n = 3)
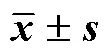
表6 葛根芩连汤及配伍对Caco-2细胞Nrf2、NQO1和HO-1 mRNA表达的影响(, n = 3)
3.6 葛根芩连汤及配伍对细胞内Nrf2、NQO1和HO-1蛋白表达的影响
如图1和表7所示,与对照组比较,TNF-α组NQO1蛋白表达呈下降趋势,Nrf2和HO-1蛋白表达水平均明显降低(<0.01);与TNF-α组比较,小檗碱组、GQ组、WGC组、WG组和GG组Nrf2和HO-1蛋白表达水平均显著升高(<0.01),小檗碱组、GQ组、WGC组和GG组NQO1蛋白表达水平显著升高(<0.05、0.01);与GQ组比较,QL组Nrf2、NQO1和HO-1蛋白表达水平均明显降低(<0.05、0.01)。

图1 各组Nrf2、NQO1和HO-1蛋白表达情况
3.7 葛根芩连汤及配伍对Nrf2蛋白入核影响
如图2和表8所示,与对照组比较,TNF-α组细胞核内Nrf2蛋白阳性表达呈下降趋势;与TNF-α组比较,小檗碱组、GQ组、WGC组和GG组细胞核内Nrf2蛋白阳性表达明显增加(<0.05、0.01)。
表7 葛根芩连汤及配伍对Caco-2细胞Nrf2、NQO1和HO-1蛋白表达的影响(, n = 3)
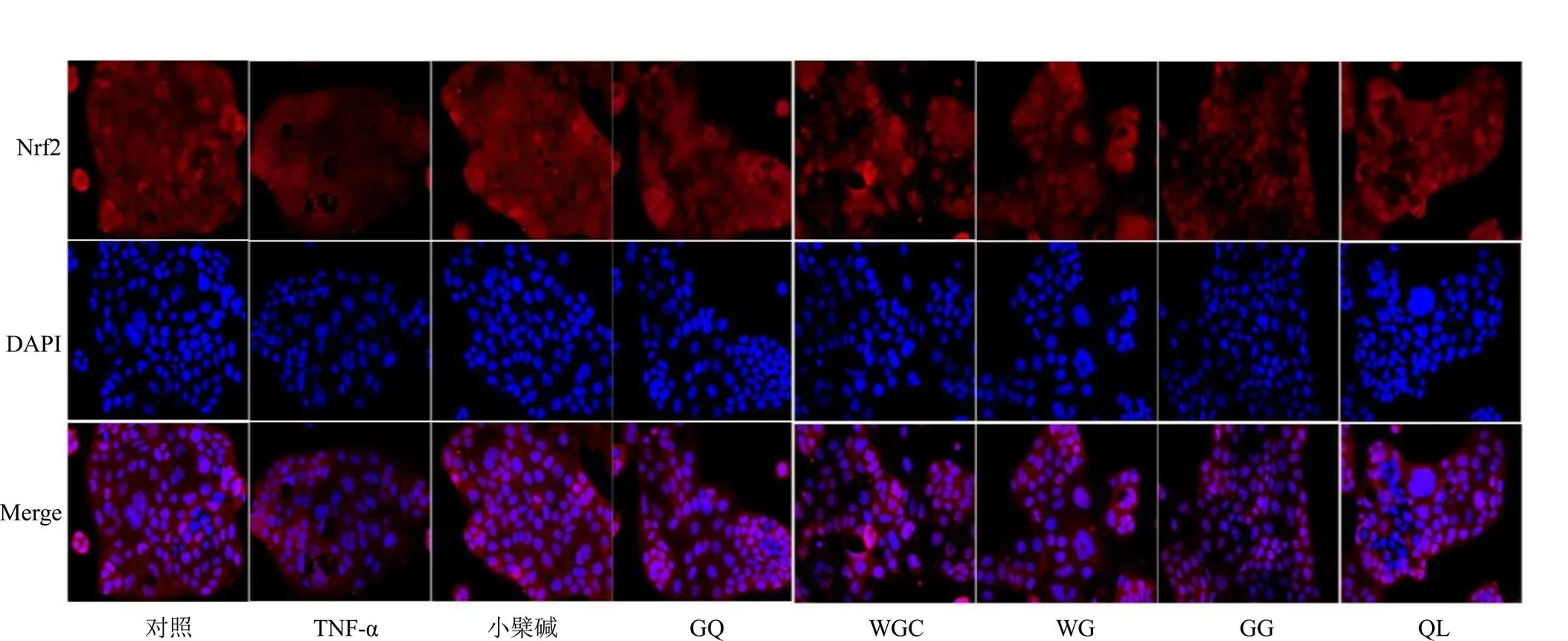
图2 各组Caco-2细胞中Nrf2蛋白入核情况 (×400)
表8 各组Caco-2细胞中Nrf2蛋白表达 (, n = 3)
4 讨论
研究发现,葛根芩连汤可上调Nrf2信号通路缓解TNF-α诱导Caco-2细胞氧化应激损伤和溃疡性结肠炎大鼠病理损伤[1-2]。本课题组在动物实验中初步探讨了葛根芩连汤抗氧化应激作用的配伍规律,发现组方中缺少君药葛根或仅有臣药黄芩和黄连对减轻氧化应激损伤作用有较大影响[1]。因此,本研究以TNF-α诱导Caco-2细胞氧化损伤,进一步探讨葛根芩连汤抗氧化应激作用的配伍规律。
TNF-α可以激活炎症反应,引起氧化应激损伤,导致ROS产生大量增加[19-20]。ROS的增加会引起细胞内的脂质、蛋白质和核酸氧化,进而造成细胞氧化应激损伤,甚至会导致细胞毒性。MDA为ROS与细胞膜上不饱和脂肪酸发生脂质过氧化反应的终产物[21],其含量可以间接反映脂质过氧化程度。本研究结果显示,葛根芩连汤及不同配伍组均可以显著降低TNF-α引起的ROS含量增加,但去葛根组和黄芩黄连组降低ROS含量的作用比全方组弱且有显著性差异。去葛根组和黄芩黄连组对TNF-α诱导的MDA含量增加无明显降低作用。前期动物实验[1]中,去葛根组对大鼠血清中MDA含量的降低明显弱于全方组。表明全方中君药葛根对于降低过氧化物含量起重要作用。
SOD可以清除机体内产生的超氧化阴离子和自由基[22],GSH可以保护细胞膜结构和功能免受过氧化氢的氧化损伤[23]。SOD活性和GSH水平降低会导致自由基堆积[24]。本研究结构显示,给予药物干预后,TNF-α引起的T-SOD活性和GSH水平下降得到了改善,但去甘草组和去葛根组T-SOD活性与对照组相比具有显著性差异,去葛根组和黄芩黄连组对GSH的作用明显低于全方组。前期动物实验[1]中,去葛根组大鼠血清中T-SOD活性明显低于对照组,黄芩黄连组GSH活性与全方组相比具有显著性差异,与本研究结果基本一致。提示葛根芩连汤能够促进抗氧化酶活性,其中君药葛根的作用较大。
Nrf2是机体抵抗氧化应激的关键调控因子,Nrf2的激活可以抑制氧化应激和炎症反应,减少细胞凋亡[12,23-24]。NQO1同时也是辅酶Q(泛醌)和维生素E的还原酶,可通过维持辅酶Q和维生素E的还原状态来发挥抗氧化应激作用[1-2]。HO-1是血红素生成胆绿素、一氧化碳和铁离子的限速酶[22-23]。NQO1和HO-1是体内重要的II相解毒酶和抗氧化剂,在体内发挥着重要的抗氧化作用。本研究结果显示,葛根芩连汤及配伍对TNF-α引起的、和mRNA和蛋白表达降低均有一定的恢复作用。其中对mRNA的促进作用,其他配伍组均弱于全方组,黄芩黄连组Nrf2、NQO1和HO-1蛋白表达明显低于全方组,与动物实验结果基本一致[1]。在此基础上,进一步研究药物对Nrf2蛋白入核的影响,发现去葛根组和黄芩黄连组对TNF-α导致的Nrf2蛋白入核减少没有明显改变。上述结果证实缺少葛根的配伍组激活Nrf2信号通路作用较弱。
本课题组前期研究发现,对于TNF-α诱导的氧化应激损伤,葛根素、黄芩苷、小檗碱和甘草苷均具有一定的抑制作用,其中葛根素和小檗碱的抗氧化应激作用相对较好[2]。本研究以小檗碱为阳性对照药物,质量浓度为6.73 μg/mL,但去葛根组和黄芩黄连组中所含小檗碱仅有0.13和0.03 μg/mL,因此去葛根组和黄芩黄连组尽管含小檗碱成分,由于含量低导致其抗氧化应激作用与全方组相比有明显差异,同时这2个配伍组又不含有葛根素,这也是抗氧化应激作用弱的又一原因。
以上研究结果表明,葛根芩连汤及不同配伍对TNF-α诱导的氧化应激损伤均有一定的抑制作用。综合细胞实验和动物实验[1]结果,方中缺少君药葛根对抗氧化应激作用有明显影响。然而葛根芩连汤抑制氧化应激损伤的配伍规律及其药效物质基础还有待通过在体实验进一步验证。本课题组将进一步展开葛根芩连汤抗氧化应激损伤的有效成分研究,深入探讨葛根芩连汤配伍规律的物质基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 林川, 王菲, 王鸿卿, 等. 葛根芩连汤及配伍调控Nrf2/NQO1信号通路抑制溃疡性结肠炎大鼠氧化应激损伤 [J]. 中国实验方剂学杂志, 2022, 28(13): 19-27.
[2] Lin C, Zhou Z H, Zhang L J,. Gegen Qinlian Decoction relieves ulcerative colitis via adjusting dysregulated Nrf2/ARE signaling [J]., 2022, 2022: 2934552.
[3] 王婷婷, 安叡, 梁琨, 等. 基于UPLC-LTQ-Orbitrap高分辨质谱的葛根芩连汤的化学成分分析 [J]. 中草药, 2020, 51(6): 1498-1507.
[4] 张艺竹, 安叡, 袁瑾, 等. 基于药代动力学参数分析比较葛根芩连汤的不同配伍肠吸收特性 [J]. 药学学报, 2013, 48(10): 1611-1617.
[5] 顾青青, 邵以诺, 安叡, 等. 葛根芩连汤有效成分对黄芩苷在Caco-2细胞模型中吸收转运的影响 [J]. 中成药, 2015, 37(4): 694-699.
[6] 陈烨, 袁瑾, 王新宏, 等. 葛根芩连汤及不同配伍对肝细胞色素P450酶的影响 [J]. 中成药, 2013, 35(8): 1593-1598.
[7] 张华, 安叡, 徐冉驰, 等. 葛根芩连汤及不同配伍组中生物碱类成分的肠外翻吸收研究 [J]. 中成药, 2012, 34(4): 620-625.
[8] 张华, 安叡, 徐冉驰, 等. UPLC快速测定葛根芩连汤肠外翻囊样品中6个黄酮类成分含量 [J]. 药物分析杂志, 2012, 32(1): 15-19.
[9] 张华, 安叡, 徐冉驰, 等. 葛根芩连汤及不同配伍组中黄酮类成分的肠外翻吸收研究 [J]. 中国中药杂志, 2011, 36(23): 3332-3337.
[10] 陈阳, 陆杰, 朱思敏, 等. 基于高通量测序技术研究葛根芩连汤及其配伍对急性肠炎大鼠肠道菌群多样性的影响 [J]. 中国中药杂志, 2020, 45(6): 1406-1417.
[11] 安叡, 张华, 张艺竹, 等. 采用在体单向肠灌流模型研究葛根芩连汤不同配伍组主要指标成分的肠吸收特性 [J]. 药学学报, 2012, 47(12): 1696-1702.
[12] 秦劭晨, 王爱梅, 李若瑜. 茯苓酸对TNF-α诱导SH-SY5Y细胞炎症氧化应激反应和凋亡的拮抗作用研究 [J]. 中国中医药科技, 2019, 26(6): 854-858.
[13] 郑晓珂, 刘彩霞, 翟英英, 等. 卷柏中穗花杉双黄酮对TNF-α诱导的血管内皮细胞损伤的保护作用 [J]. 药学学报, 2013, 48(9): 1503-1509.
[14] 王雪纯, 陈丽, 曹旭梅, 等. 落地生根冻干粉对HepG2细胞增殖及凋亡的影响 [J]. 中药材, 2022, 45(3): 726-731.
[15] 陈晓雷, 陈思如, 修光辉, 等. 高迁移率族蛋白B1在脂多糖诱导的Caco-2细胞上皮屏障损伤中的作用 [J]. 中华急诊医学杂志, 2021, 30(3): 287-292.
[16] 何萍萍, 郑雅君, 郑明静, 等. 红毛藻多糖对H2O2诱导的Caco-2细胞氧化损伤的保护作用 [J]. 食品科学, 2021, 42(17): 113-120.
[17] Lu J Z, Ye D, Ma B L. Constituents, pharmacokinetics, and pharmacology of Gegen-Qinlian Decoction [J]., 2021, 12: 668418.
[18] Chen Y R, Zhang P, Chen W R,. Ferroptosis mediated DSS-induced ulcerative colitis associated with Nrf2/HO-1 signaling pathway [J]., 2020, 225: 9-15.
[19] Wang X H, Dai C, Wang J,. Therapeutic effect of neohesperidin on TNF-α-stimulated human rheumatoid arthritis fibroblast-like synoviocytes [J]., 2021, 19(10): 741-749.
[20] 贺佳林, 胡瑞成, 戴爱国. COPD大鼠肺组织和骨骼肌中ROS、MDA、IL-6和TNF-α含量变化 [J]. 国际呼吸杂志, 2020, 40(20): 1537-1542.
[21] He M H, Pan H, Chang R C C,. Activation of the Nrf2/HO-1 antioxidant pathway contributes to the protective effects ofpolysaccharides in the rodentafter ischemia-reperfusion-induced damage [J]., 2014, 9(1): e84800.
[22] Weerachayaphorn J, Mennone A, Soroka C J,. Nuclear factor-E2-related factor 2 is a major determinant of bile acid homeostasis in the liver and intestine [J]., 2012, 302(9): G925-G936.
[23] Hu T X, Wei G, Xi M M,. Synergistic cardioprotective effects of Danshensu and hydroxysafflor yellow A against myocardial ischemia-reperfusion injury are mediated through the Akt/Nrf2/HO-1 pathway [J]., 2016, 38(1): 83-94.
[24] Li J Q, Ichikawa T, Janicki J S,. Targeting the Nrf2 pathway against cardiovascular disease [J]., 2009, 13(7): 785-794.
Combination rule of Gegen Qinlian Decoction on inhibiting oxidative damage stimulated by TNF-α in Caco-2 cells
LIN Chuan1, DONG Wen-min2, ZHANG Qian-yun1, LIU Wang-zhenzu1, LIANG Kun1, WANG Xin-hong1, AN Rui1
1. School of Pharmacy, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China 2. Pudong Hospital Affiliated to Fudan University, Shanghai 201200, China
To investigate the effect of Gegen Qinlian Decoction (葛根芩连汤) on relieving tumor necrosis factor-α (TNF-α)-induced oxidative stress injury in human colon cancer Caco-2 cells and its compatibility.Caco-2 cells were randomly divided into control group, TNF-α (80 μg/L) group, berberine (6.73 μg/mL) group and Gegen Qinlian Decoction compatibility group [Gegen Qinlian group (GD), Gancao (et) absent group (WGC), Gegen () absent group (WG),-etgroup (GG), Huangqin ()-Huanglian () group (QL), 18.75 μg/mL]. Except for the control group, cells in other groups were pretreated with TNF-α for 2 h, and then treated with corresponding drugs for 24 h. Caco-2 cell viability was detected by MTT; Intracellular reactive oxygen species (ROS) level were detected by flow cytometry; Total superoxide dismutase (T-SOD) activity and malondialdehyde (MDA), glutathione (GSH) levels were detected by colorimetry; qRT-PCR and Western blotting were used to detect nuclear factor erythroid 2-related factor 2 (Nrf2), NAD(P)H quinine oxidoreductase 1 (NQO1) and heme oxygenase-1 (HO-1) mRNA and protein expressions; Fluorescence microscope was used to observe nuclear penetration of Nrf2 protein.5.0—25.0 μg/mL drug-containing medium and 10—80 μg/L TNF-α had no significant effect on the viability of Caco-2 cells. Compared with TNF-α group, ROS level in Caco-2 cells of each administration group were significantly decreased (< 0.01). Except for WG group and QL group, MDA level in the other groups were significantly decreased (< 0.01), and GSH level was significantly decreased (< 0.01).gene expression was significantly increased in all drug-administered groups except WG group (< 0.01), andgene expression was significantly increased in GD group and WGC group (< 0.05, 0.01),gene expression was significantly increased in GD group and GG group (< 0.05, 0.01). Except for QL group, protein expressions of Nrf2 and HO-1 in other groups were significantly increased (< 0.01); Except for WG group and QL group, NQO1 protein expression was significantly increased in the other groups (< 0.05, 0.01), and Nrf2 protein into the nucleus was significantly increased (< 0.05, 0.01).The lack ofhas a negative effect on the inhibition of oxidative stress injury of Caco-2 cells by Gegen Qinlian Decoction.
Gegen Qinlian Decoction;; compatibility of medicines; oxidative stress; colon cancer cells
R285.5
A
0253 - 2670(2022)20 - 6492 - 08
10.7501/j.issn.0253-2670.2022.20.021
2022-07-15
上海市科技创新行动计划自然科学基金资助项目(19ZR1451900)
林 川,男,硕士研究生,从事药物分析与体内过程研究。Tel: 19821726781 E-mail: 3325892608@qq.com
安 叡,女,博士,教授,从事药物分析与体内过程研究。Tel: (021)51322183 E-mail: anruimw@126.com
[责任编辑 李亚楠]
