RNA甲基化修饰在膀胱癌中的研究进展
2022-10-20杨小清白一多胡海龙韩瑞发
杨小清,丁 娜,白一多,胡海龙,,韩瑞发,
膀胱癌是一种复杂的疾病,具有发病率高、易复发及预后差等特点。目前已经报道的mRNA甲基化修饰包括N7-甲基鸟苷(m7G)、N1-甲基腺苷(m1A)、N6-甲基腺苷(m6A)、2' -O-二甲基腺苷(m6Am)、5-甲基胞嘧啶(m5C)、5-羟甲基胞嘧啶(hm5C)、肌苷(I)、2' -O-甲基化核苷(Nm)和假尿苷(Ψ)等。在膀胱癌中,RNA甲基化修饰研究主要聚焦于m6A和m5C甲基化修饰,因此,本综述将主要讨论m6A和m5C RNA甲基化修饰在膀胱癌发生、进展、复发、预后和治疗反应等方面的研究进展。
1 m6A RNA甲基化修饰
m6A RNA甲基化是在腺苷N6位发生的甲基化修饰,是mRNAs中最普遍、最丰富和最保守的内部转录修饰。在哺乳动物中,m6A的频率估计为每个mRNA转录本3~5个位点,占所有腺苷核苷酸的0.1%~0.4%,在一些mRNA中,则可能超过20个[1]。在mRNA中,m6A修饰主要位于编码序列(CDS)和3' UTR区(3' UTR),特别是在终止密码子附近富集,以及剪接位点附近的外显子,具有典型的共识序列RRACH-3' (R是A或G,H可以是A、C或U)[1]。除mRNAs外,m6A修饰也存在于非编码RNA(ncRNA)中,调节它们的生物发生过程和功能[2]。最近,研究者们开始认识到由RNA修饰调节的大量分子过程,包括RNA稳定性、衰变、剪接或加工、翻译、定位等,从而使遗传信息多样化。
1.1 人类m6A调节因子 m6A的甲基转移酶和去甲基化酶分别介导RNA的m6A甲基化修饰的“写入”和“擦除”,又分别被称为“写入器”和“擦除器”,二者的动态调节决定了RNA m6A的水平。此外m6A修饰的“读取”也由特异的识别蛋白(又称“读取器”)完成,并介导m6A修饰后的下游生物学功能,见表1。
1.1.1 RNA m6A甲基转移酶 RNA m6A甲基转移酶包括:甲基转移酶样3(METTL3)、甲基转移酶样 14(METTL14)、甲基转移酶样 16(METTL16)及它们的辅助因子Wilms肿瘤相关蛋白(WTAP)、RNA结合基序蛋白15(RBM15/15B)、Cbl原癌基因样1(CBLL1,又称Hakai)、CCCH型锌指蛋白13(ZC3H13)和病毒样m6A甲基转移酶相关蛋白(VIRMA,又称KIAA1429),最近,另一种CCHC锌指蛋白ZCCHC4被鉴定为一种新的甲基转移酶[3]。
m6A的写入主要由甲基转移酶复合物(MTC)催化。MCT中,METTL3是唯一起催化作用的蛋白,其内部含有S-腺苷蛋氨酸(SAM)结合结构域,可催化SAM中的甲基转移到RNA中的腺嘌呤碱基,产生S-腺苷同型半胱氨酸(SAH);METTL14为稳定MTC结构的蛋白,与METTL3共同形成MCT的核心,并确定特定的RNA序列(“RACH”)作为催化底物;WTAP通过将METTL3和METTL14招募到核斑点来起到稳定核心复合物并促进m6A修饰的作用;RBM15/15B的功能是协助METTL3和WTAP的结合,将它们定向到目标位点[4];VIRMA优先定位3' -UTR和终止密码子区域附近的mRNA甲基化修饰[5]。其他蛋白质,如ZC3H13和CBLL1,则与包括WTAP在内的其他辅助因子协同作用[6]。
除MTC外,2017年发现,METTL16是一种新的独立RNA甲基转移酶,发挥催化m6A甲基化修饰作用[7],它也可以甲基化ncRNAs[2]。
1.1.2 RNA m6A去甲基化酶 脂肪量及肥胖相关蛋白(FTO)在2011年被确认为第一个m6A去甲基化酶,FTO的发现表明RNA修饰可以是可逆和动态的。2013年,第二个RNA去甲基化酶AlkB对应物5(ALKBH5)被发现。FTO和ALKBH5属于α-酮戊二酸依赖的双加氧酶家族,以Fe(II)和α酮戊二酸依赖的方式催化m6A去甲基化。2017年发现的另一种m6A去甲基酶,碱性B同源物3(ALKBH3),也可能通过上述机制去甲基化[8]。
1.1.3 RNA m6A识别蛋白 RNA m6A识别蛋白包括YTH结构域的蛋白(YTHDF1/2/3和YTHDC1/2)、异质核糖核蛋白(包括HNRNPC、hnRNPG和hnRNPA2B1)和胰岛素样生长因子2 mRNA结合蛋白(IGF2BP,包括IGF2BP1/2/3)三大类。它们通过读取mRNA上的m6A修饰,介导m6A修饰的结果。YTHDF1-3蛋白具有保守的m6A结合口袋结构,能与含RNA的m6A结合域直接结合,它们是被发现的第一组也是最重要的m6A“读取器”。
此外,一些新的m6A“读取器”包括真核细胞启动因子3(eIF3)、脆性X智力低下1(FMR1)和ATP结合盒F亚家族成员1(ABCF1)也被鉴定出来,在胞浆中,它们可直接读取mRNA的m6A修饰,来促进其翻译[9]。
1.2 m6A调节因子的细胞内定位及其介导的主要生物学功能 m6A“写入器”和“擦除器”共同定位在核斑点中,核斑点是mRNA加工和储存的主要场所,在那里它们对目标转录本发挥甲基化和去甲基化作用。“读取器”既有核分布也有细胞质分布,表明其功能具有多样性,见表1。

表1 m6A甲基化相关调节器及其亚细胞定位和生物学功能
2 RNA m5C甲基化修饰
由于检测丰度低及结果的不一致性,在人类mRNA中是否存在m5C修饰曾经受到质疑。近年来m5C检测手段不断改进,使人们认识到m5C是人类另一个丰富的RNA修饰,它广泛存在于mRNA和ncRNA中[10]。在mRNA中,m5C出现在明确的一致序列上:CNGGG和CTCCA,主要富集在翻译起始位点的cg富集区,在哺乳动物中保守[11]。mRNA的m5C在RNA的稳定性、翻译和核转运中也发挥着重要作用[11-12]。
RNA m5C修饰的调节及下游生物学功能的实现也是由m5C“写入器”“擦除器”和“读取器”所介导,见表2。
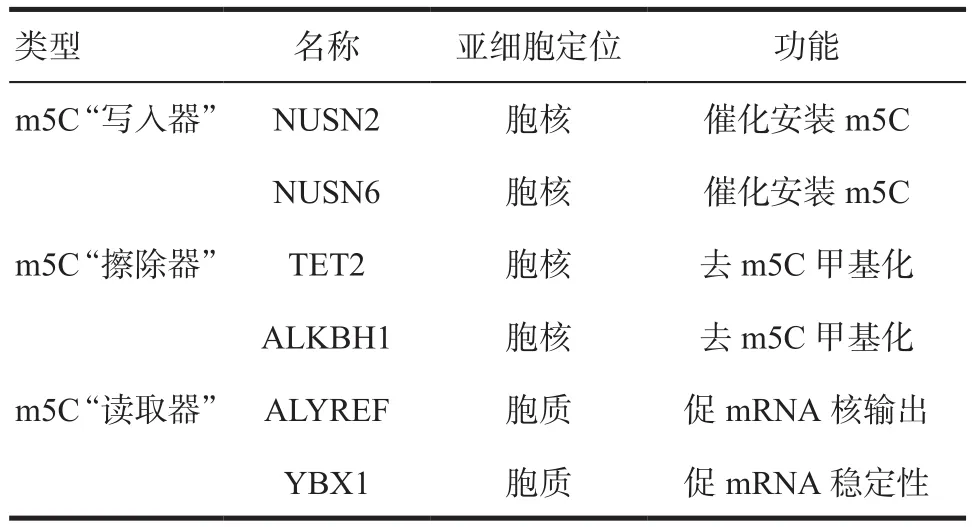
表2 人mRNA m5C甲基化相关调节因子及其生物学作用
2.1 胞嘧啶-5甲基转移酶 在人类中,NOL1/NOP2/sun (Nsun)家 族 中 的 NSUN1、NSUN2、NSUN3、NSUN4、NSUN5和 NSUN6均是胞嘧啶-5甲基转移酶,此外胞嘧啶-5甲基化酶还包括DNA甲基转移酶成员2(DNMT2,也被称为RDMT1)。证据显示,mRNA的m5C甲基化主要由NSUN2[13]和NSUN6[14]催化。
2.2 胞嘧啶-5去甲基化酶 目前认为,胞嘧啶-5去甲基化与mRNA中转位器家族(TET)和酮戊二酸依赖的双加氧酶AlkB同源物1(ALKBH1)有关,TET可将m5C氧化生成5-羟甲基胞嘧啶(hm5C),在线粒体tRNA,ALKBH1在其摆动位置催化m5C形成f5C,f5C在线粒体tRNAs中的沉积与ALKBH1的生物学相关性已被确认,但在mRNA中低丰度的hm5C沉积与TET的生物学相关性仍有待确定。
2.3 mRNA m5C识别蛋白 Aly REF输出因子(ALYREF,也称THOC4)作为一种特定的mRNA m5C结合蛋白,在体内外研究中被证实可特异性识别m5C,并调控mRNA的输出[11]。最近还有研究表明,Y盒结合蛋白1(YBX1)是人类另一种m5C识别蛋白,能够通过结合m5C位点增强mRNA的稳定性[12]。
3 RNA甲基化修饰与膀胱癌相关问题的研究
3.1 m6A RNA甲基化与膀胱癌发生的研究 大多数膀胱癌中的甲基转移酶的研究表明,METTL3在膀胱癌组织中的高表达,发挥癌基因作用,在化学致癌物诱导正常尿路上皮细胞的恶行转化过程中m6A mRNA修饰水平出现动态变化[15],同时在转基因小鼠模型中,膀胱尿路上皮METTL3的缺失可以减少膀胱癌的肿瘤发生[16],而METTL14在膀胱癌组织中的低表达,发挥了肿瘤抑制基因的作用[17],见图1。

图1 m6A甲基化在膀胱癌发生中的研究进展
METTL3促进膀胱癌发生的证据及可能机制包括:1)基于TCGA数据的m6A调节因子拷贝数变异(CNV)分析发现,METTL3的CNV与膀胱癌患者的分子特征,如TP53突变相关以及多种癌症发生相关的细胞过程有关[18],提示METTL3与膀胱癌的相关性。2)膀胱癌干细胞(BCSCs)中的总RNA m6A丰度和m6A形成酶METTL3高表达,METTL3的缺失抑制BCSCs的自我更新并减弱其肿瘤驱动能力;METTL3可能通过METTL3-AFF4-SOX2/MYC信号轴诱导SOX2(BCSCs的标志物)的m6A修饰来保持BCSCs的特征[19],提示m6A修饰通过METTL3-AFF4-SOX2/MYC信号轴在BCSCs的自我更新和致瘤性中起关键作用。3)研究还提示,METTL3/YTHDFs或METTL3/miRNA途径对肿瘤抑制因子,如 SETD7、KLF4[20]、PTEN[21]和癌基因如ITGA6[22]和CDCP1[15]的表达调控可能促进肿瘤发生。
除 METTLE3外,METTLE14、FTO及hnRNPC可能也在膀胱癌的发生过程中起作用。研究发现METTL14敲除促进肿瘤起始细胞(TIC)
的增殖、自我更新、转移和肿瘤起始能力,过表达则发挥相反作用;进一步发现,METTL14以m6A修饰方式参与NOTCH1 mRNA的稳定性,而NOTCH1在膀胱肿瘤的发生和TIC自我更新中发挥重要作用[23]。FTO在膀胱肿瘤组织表达增加,它在体内外刺激膀胱癌细胞活力和致瘤性方面发挥了癌基因的功能。机制上可能与FTO通过其去甲基化酶活性,调控转移相关肺腺癌转录本1(MALAT1)[24]和PYCR1[25]mRNA稳定性及作用,从而促进膀胱癌的发生有关。此外,m6A修饰通过RNA结合蛋白hnRNP C影响中国膀胱癌患者SOD2的多态性时的SOD2表达水平,而SOD2在膀胱癌细胞中发挥关键的抑癌作用[26]。
3.2 m6A RNA甲基化修饰与膀胱癌复发进展的研究 尽管在膀胱癌组织中的表达水平不同,多个m6A相关基因对膀胱癌的增殖、迁移、侵袭、血管生成有关,从而促进膀胱癌的复发和进展,见图2。
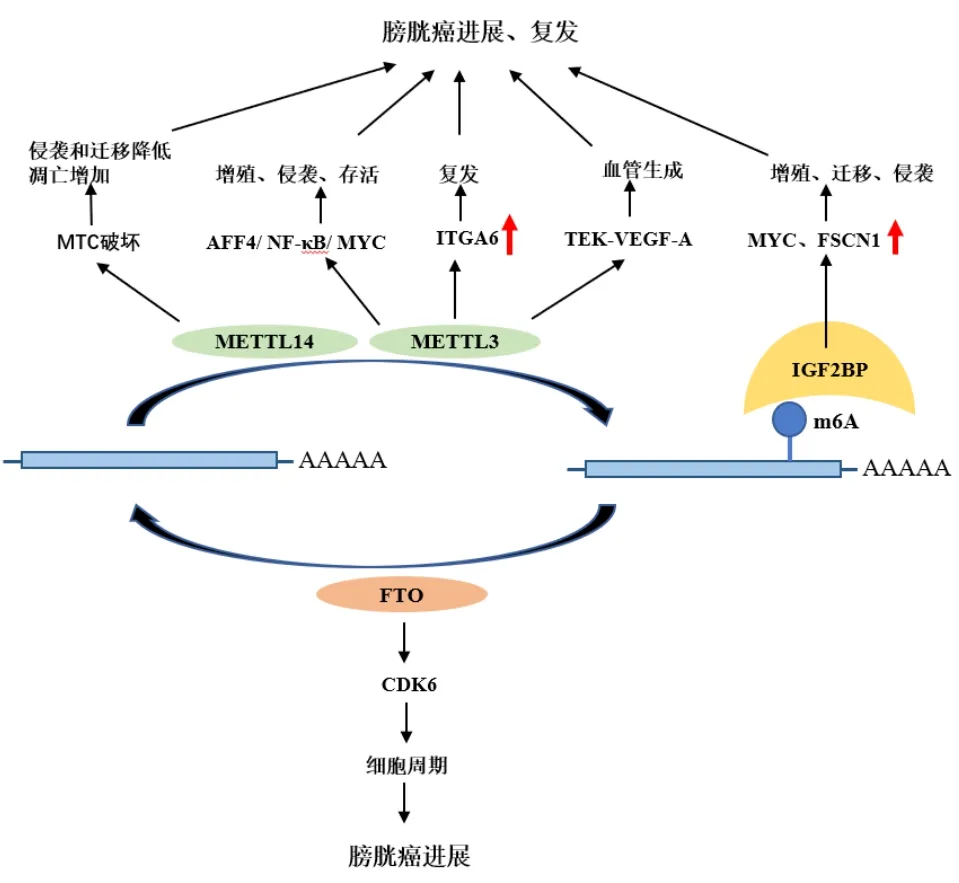
图2 m6A甲基化在膀胱癌进展和复发中的研究进展
Cheng等[27]在体内外实验中证实,过表达METTL3显著促进膀胱癌细胞的生长和侵袭,而敲除METTL3则显著减少膀胱癌细胞的增殖、侵袭和存活,进一步研究揭示AF4/FMR2家族成员4(AFF4)、NF-kB通路中2个关键调节因子(IKBKB和RELA)和MYC都是METTL3介导的m6A修饰的直接靶基因,METTL3介导的m6A修饰通过调节AFF4/NF-κB/MYC信号网络促进膀胱癌进展。在膀胱癌中ITGA6的表达水平与肿瘤复发亦显著相关,且ITGA6已被定义为“肿瘤分化特征”的18个基因之一,用于膀胱癌分层,在膀胱癌组织中,ITGA6的表达上调与METTL3的表达增加相关[22]。此外,Wang等[16]的研究还发现,条件性敲除BCSCs中的METTL3可抑制膀胱癌的进展,这一作用与METTL3缺失导致的酪氨酸激酶内皮细胞(TEK)和血管内皮生长因子A(VEGF-A)的m6A丰度及表达水平降低有关。因此,METTL3可能通过m6A修饰影响AFF4/NF-κB/MYC、ITGA6、TEK和VEGF-A的表达和功能,从而促进肿瘤进展。
METTL14基因敲除导致MCT的破坏和m6A丰度以及肿瘤侵袭性的降低[28]。膀胱癌中FTO表达与膀胱癌的临床病理分期及不良预后密切相关;FTO过表达促进膀胱癌细胞增殖,而FTO敲除抑制膀胱癌细胞增殖,机制可能与FTO/miR-576/细胞周期素依赖性激酶(CDK6)途径有关[29]。IGF2BP1 可识别MYC和FSCN1 mRNA的m6A修饰,从而调节MYC和FSCN1的表达,促进膀胱癌细胞的增殖、迁移和侵袭,阻断IGF2BP1对m6A修饰RNA的识别,可抑制肿瘤进展[30]。
3.3 m6A RNA甲基化修饰与膀胱癌治疗反应及预后评估 以顺铂为基础的化疗是肌肉浸润性和转移性膀胱癌的一线治疗方法,研究发现,m6A甲基化修饰与顺铂化疗敏感性有关,调节m6A甲基化修饰可能改善顺铂敏感性[31]。
多项研究利用生物信息学分析研究探讨了m6A评分或调节因子对膀胱癌预后的预测作用。来自癌症基因组图谱(TCGA)、基因表达数据库(GSE)、基因表达综合数据库(GEO)和人类蛋白质图谱(HPA)数据库的多项分析表明,m6A评分及m6A调节因子在预测总体存活率、免疫细胞浸润和经典癌基因突变、药物治疗敏感性方面可能发挥重要作用。其中一项研究还建立了预后风险预测模型:0.164FTO-(0.081YTHDC1+0.032WTAP)[32],另一项则认为FTO和YTHDF2可能作为膀胱癌患者预后生物标志物[33]。
利用GEO和TCGA数据的分析还发现,四个m6A相关免疫基因(m6AIGs)(BGN、GRK5、IL32和SREBF1)与膀胱癌患者的预后显著相关[34]。此外,还有分析发现,m6A相关的ncRNA或lncRNA可用于膀胱癌的预后预测[35]。
3.4 m6A RNA甲基化可作为膀胱癌治疗新的靶标 在体外实验中,阻断IGF2BP1对m6A修饰RNA的识别,可抑制肿瘤进展[30],靶向circ0008399/WTAP/TNFAIP3轴可增强顺铂的疗效[31],这些结果初步显示出针对m6A 修饰的分子手段可能成为膀胱癌患者的治疗靶点。Ying等[36]在证实了m6A修饰的CDCP1在膀胱癌进展中的作用后,在膀胱癌细胞中进行了CDCP1mRNA的工程化m 6 A修饰,他们在CDCP1的3'非翻译区靶向m6A安装,该工程化操作促进了CDCP1 mRNA的翻译,并在体外和体内促进了膀胱癌的发展,该研究为膀胱癌的m6A修饰调节治疗提供了理论上的可行性。
3.5 m5C RNA甲基化在膀胱癌中的研究进展m5C甲基化修饰在膀胱癌的发生、侵袭、转移、治疗反应及预后的评估初步证实具有重要价值。2019年,Yang等[15]发现,膀胱癌患者NUSN2、YBX1和癌基因HDGF高表达其生存率最低,膀胱癌与正常组织相比,m5C位点甲基化水平较高;这些m5C位点高甲基化在致癌相关途径及肿瘤侵袭和转移相关基因中富集;进一步研究证明,YBX1通过招募mRNA稳定性维持因子ELAVL1保持癌基因HDGF mRNA的稳定性,驱动膀胱癌的发生。2021年,Wang等[25]首次证明膀胱癌患者ALYREF的高表达预示生存率较低。基于ALYREF与PKM2 mRNA3' -非翻译区m5C位点结合增加了PKM2 mRNA稳定性,导致PKM2介导的糖酵解增强,促进膀胱癌细胞增殖。Hu等[37]将m5C评分与膀胱癌的经典分子亚型、免疫表型、临床结果和治疗时机相关联,结果显示,m5C评分可以准确地预测膀胱癌的经典分子亚型、免疫表型、预后和治疗机会,提示基于m5C的分型系统可反映膀胱癌生物学特征的许多方面,有望成为膀胱癌患者免疫治疗反应和预后及精准医学治疗的预测指标。
4 结论和展望
RNA甲基化修饰尤其是m6A和m5C甲基化修饰,通过多种途径参与膀胱癌的发生、复发和进展,在化疗和免疫抑制剂治疗的敏感性以及预后和临床结果的预测上显示出应用潜力。但挑战依然存在,在膀胱癌中,支持RNA甲基化修饰参与膀胱癌发生和发展的机制尚不完全清楚,特别是目前证据显示m6A同种类修饰蛋白(如METTLE3和METTLE14)可能具有不同的作用(如致癌或抑制肿瘤);m6A调节因子及其相关通路作为可能治疗靶点的研究证据太少;m5C修饰在肿瘤中的作用一直存在争议等,因此需要更多的研究来充分探索这些争议和挑战。
