HRCT密度差值在诊断前庭窗型耳硬化症中的应用
2022-10-20伊景如陈雪霞白奥涵潘初
伊景如, 陈雪霞, 白奥涵, 潘初
耳硬化症又名耳海绵症,是发生于耳囊的骨营养不良性疾病,常导致渐进性听力下降。既往认为该病最常见于白种人[1],最新文献报道亚洲人发病率呈上升趋势,可达0.5%[2]。其发病机制尚不明确。据病变累及部位可分为前庭窗型、耳蜗型及混合型,其中以前庭窗型最常见(85%)[3]。诊断耳硬化症需综合病史、体格检查、听力测试和影像学检查。目前颞骨高分辨率CT已成为评估耳硬化症的首选影像学方法,可对临床疑似耳硬化症的病灶进行可视化、定位和量化[4-8]。多数文献采用测量前庭窗前区CT平均值的方法进行诊断,但各研究的测量方法及诊断标准尚未统一。本研究对前庭窗型耳硬化症患者耳前庭窗前区骨密度进行定量分析,并与同侧锤骨头密度相比较,探讨骨密度差值在诊断前庭窗型耳硬化症中的应用价值。
材料与方法
1.一般资料
搜集2003年1月-2021年10月经临床确诊的前庭窗型耳硬化症患者107例共180耳(34例患者单耳发病)纳入耳硬化组,入组标准:①临床确诊为耳硬化症,诊断标准为进行性听力下降、耳镜检查鼓膜正常、测听为传导性或混合性聋[9,10],其中52例(99耳)经手术病理证实。②无颞骨外伤及原发或继发肿瘤病史;③临床确诊2周内完成颞骨HRCT检查;④排除HRCT表现为耳蜗骨质密度减低或耳蜗和前庭窗前区同时密度减低的患者。另选取同期112例共224只耳纳入慢性中耳炎组,入组标准:①患者有耳道流水流脓病史,病程超过6周;②耳科检查发现鼓膜穿孔或耳道内有脓性分泌物,临床诊断为慢性中耳炎;③临床确诊2周内完成HRCT检查;排除明显有胆脂瘤或软组织肿块的患者;④无颞骨外伤、手术及原发或继发肿瘤病史。选取同期110例共220只纳入对照组,入组标准:①短期(2周)出现听力下降或耳鸣头晕症状;②耳科检查无穿孔或炎性分泌物,听力检查无阻抗性听力下降,耳科检查未见异常;③既往无中耳炎病史,无颞骨外伤、手术及原发或继发肿瘤病史,④具有完整清晰的颞骨HRCT图像,CT无明显的阳性征象 (表1)。正常耳及窗型耳硬化症的HRCT图像见图1a、b。
2.仪器与方法
采用Siemens Somatom Definition 64层双源螺旋CT扫描仪。受检者取仰卧位,摆位时双耳尽量对称。对所有患者均行轴面扫描,扫描基线与上眶耳线平行,扫描范围为乳突尖部至颞骨岩部上部,包括整个内耳。参数:管电压120 kV,管电流320 mA,探测器选择0.6 mm×64,螺距0.8,管球旋转时间0.5 s/r,高分辨率采集层厚5 mm。在扫描操作中尽量避免图像左右不对称,对于由于患者不能完全配合出现的细微偏差我们采用骨算法对原始图像进行重建,重建图像层厚约0.6~1 mm。重建范围为乳突尖部至颞骨岩部上部,包括整个内耳。将所有数据传至PACS系统进行CT值测量。
3.CT值测量方法
在轴面图像上勾画ROI,首先在前庭窗层面置ROI(大小为2 mm2),覆盖前庭窗前区的中心,测量CT值,每侧分别测量3次,取平均值(图1c)。在同侧锤骨头最大显示层面置ROI(大小为1.5 mm2),覆盖整个锤骨头的中心,测量CT值,每侧分别测量3次,取平均值(图1d)。计算两组差值(差值=前庭窗前区骨CT值-锤骨头骨CT值)并进行比较。为了尽可能的减小主观误差,所有数据均由两名研究者独立测量3次,采用双盲方法(测量者、经验丰富的影像学医师均不清楚分组情况)进行数据的可重复性评价。组间相关系数(ICC)值>0.75表示可重复性高、信度良好。
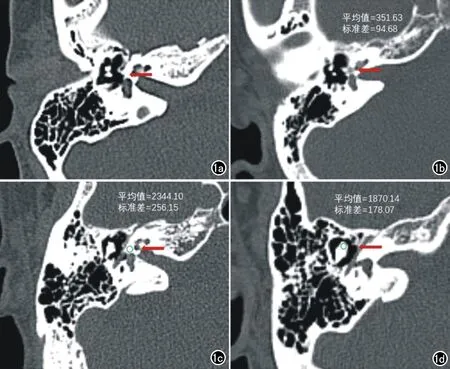
图1 a)正常耳HRCT图像,前庭前区骨质密度均匀(箭);b)前庭窗型耳硬化症HRCT图像,前庭前区骨质密度减低(箭);c)骨迷路CT值测量,ROI放置于骨迷路前庭窗前区,几乎全覆盖其中心(绿圈);d)锤骨头CT值测量,ROI放置于锤骨头最大显示层面,几乎全覆盖其中心(绿圈)。
4.统计学分析
采用SPSS 26.0软件及Prism软件对数据进行整理分析。符合正态分布的数据用平均值±标准差描述,不符合正态分布的数据用中位数(25%,75%)表示。分别对3组患者的年龄、病程进行非参数检验、性别进行卡方检验;分别对3组前庭窗前区、锤骨头、差值进行Kruskal-Wallis检验,记P<0.05为具有统计学意义,并对统计结果进行berferni校正。采用ROC曲线对3项数值诊断耳硬化症的效能进行评价。
结 果
1.三组患者CT值和差值的比较
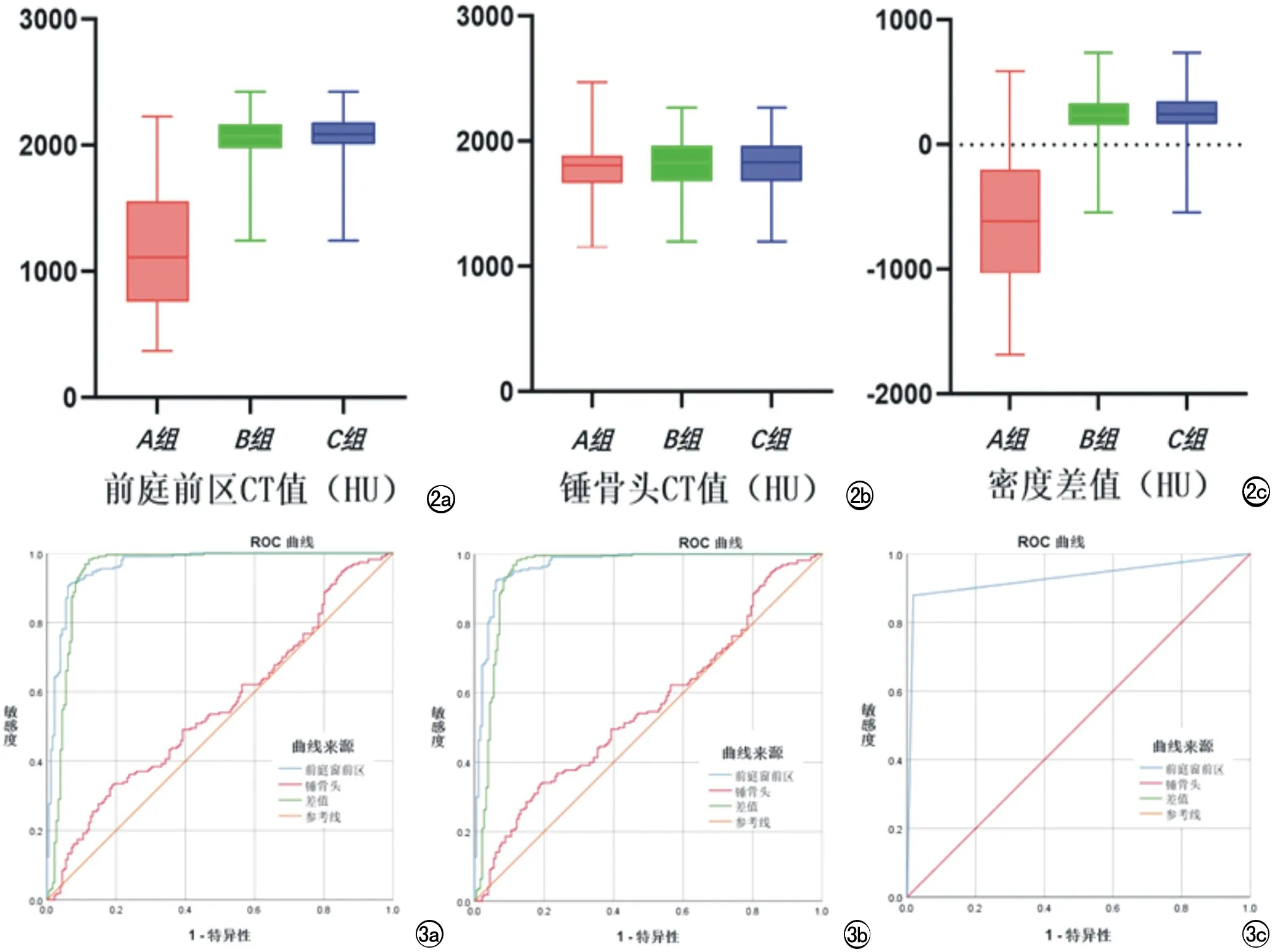
3组患者不同部位骨密度值分布见图2、表2。经统计学分析后得出3组患者在年龄、性别方面均无显著的差异性(P分别为0.063、0.384)。耳硬化组与慢性中耳炎组在病程方面无显著差异性(P=0.344),对照组病程与这两组病程相比较短(P<0.001)。对前庭窗前区和锤骨头CT值以及差值的统计结果进行berferni校正,k=3,P'=0.05/3=0.017。耳硬化组前庭窗前区平均CT值明显低于慢性中耳炎组和对照组(c=-15.821,P<0.001 表2 三组患者不同部位骨密度值 图2 a) 耳硬化组 、慢性中耳炎组和正常对照组3组患者前庭前区平均CT值分布; b) 耳硬化组 、慢性中耳炎组和正常对照组3组患者锤骨头平均CT值分布; c) 耳硬化组、慢性中耳炎组和正常对照组3组密度差值的分布。箱型图由上限、上四分位数、中位数、下四分位数、下限构成。 图3 a) 采用前庭窗前区平均CT值、锤骨头平均CT值以及密度差值鉴别耳硬化症和慢性中耳炎的ROC曲线; b) 采用前庭窗前区平均CT值、锤骨头平均CT值以及密度差值鉴别耳硬化症和正常耳的ROC曲线; c) 差值的阈值设为0时诊断耳硬化症的ROC曲线。 2.CT值和差值对耳硬化症的诊断效能 采用前庭窗前区CT平均值鉴别耳硬化症与慢性中耳炎的AUC为0.964(P<0.001),诊断阈值为1892.42 HU,诊断的敏感性为90.63%,特异度为93.92%;采用前庭窗前区CT平均值鉴别耳硬化症与正常耳的AUC为0.967(P<0.001),诊断阈值为1892.42 HU,诊断的敏感性为92.27%,特异度为93.92%。采用密度差值鉴别耳硬化症与慢性中耳炎的AUC为0.948(P<0.001),诊断阈值为-0.42,诊断的敏感度为98.21%,特异度为87.85%(图3a、b,表3);采用密度差值鉴别耳硬化症与正常耳的AUC为0.949(P<0.001),诊断阈值为-0.42,诊断的敏感度为98.18%,特异度为87.85%。将差值的阈值设置为0时,诊断的灵敏度为87.85%,特异度为98.20%,ROC曲线下面积为0.930(P<0.001),见图3c。使用前庭窗前区骨密度CT平均值和差值诊断耳硬化症均具有较高的准确性,且使用差值诊断耳硬化症可取得更高的灵敏度。 表3 三组患者不同参数诊断效能 耳硬化症是一种病因不明的骨迷路的局灶性病变。病理上分海绵化期及硬化期,海绵化期即活动期,为耳囊致密骨骨质破坏、吸收,被海绵状新生骨替代,在CT上可清晰显示,表现为局灶性密度减低。硬化期即静止期,为病灶内骨质沉着、硬化,产生致密硬化斑,该期病灶与周围骨质密度接近[11-15]。颞骨HRCT是评估耳硬化症存在的高度敏感和特异的工具,可以对临床怀疑耳硬化症的病灶进行可视化、精准定位和量化。 大量研究表明,HRCT骨密度测量可发现前庭窗前区骨密度值减低,提示耳硬化症。这些研究[16-19]测量了有无耳硬化症患者的前庭窗前区的骨密度值,并通过ROC分析获取诊断的阈值,诊断的灵敏度及特异度均超过了80%。本文中,耳硬化组患者前庭窗前区骨密度平均值明显低于慢性中耳炎组和对照组,与以往的研究报道基本吻合。本研究通过ROC分析显示,当CT值取1892.42 HU时,与慢性中耳炎鉴别时诊断耳硬化症的敏感度为90.63%,特异度为93.92%,曲线下面积为0.964;与正常对照者鉴别时诊断耳硬化症的敏感度为92.27%,特异度为93.92%,曲线下面积为0.967,与以往研究相比,灵敏性及特异度均取得良好的结果。 近年来,随着计算机断层扫描成像的进步,特别是更小的像素尺寸、更好的准直性等使得计算机断层扫描诊断耳硬化症的灵敏度大大提高[19-21]。HRCT在临床上有助于检测低密度病变,骨密度可以通过精确的ROI设置来测量。目前国内外研究多采用在病变区域勾画多个ROI(每个ROI的面积为1 mm2或直径为0.2 mm)的方法,其临床效能较好。然而,选择过小的ROI可能会降低诊断的准确性,尤其是在耳硬化症病灶局限于较小区域的情况下。多数学者认为应选择更大的ROI、尽可能填满前庭窗前区的半自动分析进行精准评估[17]。因此本研究选用较大ROI行骨密度测量,将ROI分别放置于前庭窗前区以及同侧锤骨头,将这两个部位的中心完全覆盖,对三组两个区域的骨密度平均值进行定量分析。 目前大多数研究表明耳硬化组前庭窗前区的平均CT值低于对照组,但有文献报道早期耳硬化病变时,耳硬化症与正常骨之间的平均CT值可能十分相似,经临床或手术诊断为耳硬化症的患者中,约1%~35%在颞骨HRCT检查中未发现病灶,这是HRCT检查的潜在局限性[22-24]。且当患者本身存在生理性变异或慢性炎症时,前庭区域的骨密度值可能降低,此时仅依靠以往的研究方法进行诊断时,很大可能将误诊为耳硬化症。因此仅仅依靠前庭窗前区的密度差别进行耳硬化症的诊断存在假阴性或假阳性。而且,由于扫描设备及扫描参数的差异,目前耳硬化症HRCT的诊断标准尚未统一,同一部位单纯的CT值测量存在很大差别,单纯计算前庭窗前区的绝对值用于诊断耳硬化症并不客观。 前庭窗型耳硬化症一般不累及锤骨,且锤骨头在听骨链中面积较大、剖面较易显示、测量密度值较易操作,故选取锤骨头作为基线具有较强的可操作性。目前多数研究单纯计算前庭窗前区的绝对值用于诊断耳硬化症,这种诊断方法目前尚缺乏统一标准。故本研究提出差值(前庭窗前区骨CT值-锤骨头骨CT值)这一较客观的诊断方法。同一患者采用不同设备及参数扫描时锤骨头与前庭窗前区两个部位的密度值测量受到的影响是一致的,两者的差值不易受到原始CT值变化的影响,与单纯的前庭窗前区密度值相比更加客观。本研究通过ROC分析显示,当密度差值取-0.42时,鉴别耳硬化症与慢性中耳炎的敏感度为98.21%,特异度为87.85%,AUC为0.948;鉴别耳硬化症与正常耳的灵敏度为98.18%,特异度为87.85%,AUC为0.949,与以往研究相比,灵敏性有所提高。为了提高临床应用的简便性,本研究将前庭窗前区与锤骨头两者的差值的阈值设为0,诊断的灵敏度为87.85%,特异度为98.20%,AUC为0.930,其诊断准确效能与前庭窗前区绝对值的诊断效能差异并不明显,但在临床应用上更加方便与客观。 正常组织中前庭窗前区的密度值通常略高于锤骨头[13]。当患者发生耳硬化症时,前庭窗前区骨质密度减低,锤骨头密度理论上应保持不变,两者差值(前庭窗前区骨CT值-锤骨头骨CT值)应减小;而对于慢性中耳炎患者,锤骨头受累密度减低,前庭窗前区密度通常不变,其差值(前庭窗前区骨CT值-锤骨头骨CT值)加大。因此,理论上应用差值法可以有效的鉴别耳硬化症和慢性中耳炎。本研究中慢性中耳炎组锤骨头CT值,低于正常对照组但统计学无明显差异,可能是由于本研究的样本量较小且为勾画ROI完整时剔除了有明显锤骨头破坏的病例。但耳硬化组与慢性中耳炎组CT差值的统计学显著差异证实了我们的推测。 本研究尚存在一定的局限性,骨密度以及差值的测量计算只在前庭窗型耳硬化症中进行,此方法有待在耳蜗型及混合型耳硬化症中进行验证;此外本研究的部分入组患者为临床诊断未获得手术病理验证。 本研究可得出以下结论:①前庭窗型耳硬化症患者的前庭窗前区骨密度明显低于慢性中耳炎与正常对照者;②前庭窗型耳硬化症患者锤骨头一般不受累,但前庭窗前区和锤骨头两者密度差值明显低于慢性中耳炎与正常对照者;③取前庭窗前区骨密度为1892.42 HU作为阈值诊断前庭窗型耳硬化症具有较高的效能;④将差值(前庭窗前区骨CT值-锤骨头骨CT值)等于0作为诊断前庭窗型耳硬化症的阈值时,可获得87.85%的诊断灵敏度,98.20%的特异性,可用于临床。总之,骨密度测量对于耳硬化症的诊断具有重要的应用价值,采用骨密度差值诊断耳硬化症简单、可行,并有助于提高在前庭窗型耳硬化症诊断中的客观性。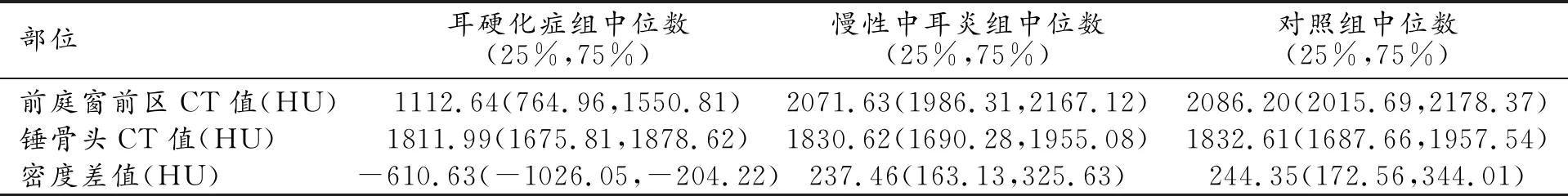

讨 论
